1 . 表中所列的字母分别代表某一种化学元素,下列说法正确的是


| A.沸点A2D<A2X | B.CA3分子是非极性分子 |
| C.B、C、D形成的气态氢化物互为等电子体 | D.C形成的单质中σ键与π键个数之比为1∶2 |
您最近一年使用:0次
2021-03-15更新
|
143次组卷
|
3卷引用:山西省实验中学2017-2018学年高二下学期第一次月考化学试题
10-11高二下·湖北武汉·期中
名校
解题方法
2 . 下列现象与氢键有关的是
①NH3的熔、沸点比VA族其他元素氢化物的高 ②小分子的醇、羧酸可以和水以任意比互溶 ③冰的密度比液态水的密度小 ④尿素(CO(NH2)2)的熔、沸点比醋酸的高 ⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 ⑥水分子高温下也很稳定
①NH3的熔、沸点比VA族其他元素氢化物的高 ②小分子的醇、羧酸可以和水以任意比互溶 ③冰的密度比液态水的密度小 ④尿素(CO(NH2)2)的熔、沸点比醋酸的高 ⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 ⑥水分子高温下也很稳定
| A.①②③④⑤⑥ | B.①②③④⑤ | C.①②③④ | D.①②③ |
您最近一年使用:0次
2020-09-11更新
|
622次组卷
|
33卷引用:2010-2011学年湖北省武汉市三角路中学高二下学期期中考试化学试卷
(已下线)2010-2011学年湖北省武汉市三角路中学高二下学期期中考试化学试卷(已下线)2011-2012学年宁夏银川一中高二下学期期末考试化学试卷(已下线)2011-2012学年海南省海南中学高二下学期期末理科化学试卷(已下线)2012-2013学年吉林省龙井市三中高二下学期期中考试化学试卷(已下线)2012-2013学年宁夏银川一中高二下学期期末考试化学试卷(已下线)2013-2014广西桂林十八中高二下学期开学考试化学试卷(已下线)2014届江苏省启东中学第二学期期中考试高二化学试卷2015-2016学年黑龙江省哈尔滨六中高二下期中化学试卷2015-2016学年山西省怀仁一中高二下第三次月考化学试卷2016-2017学年四川省成都市石室佳兴外国语学校高二下学期第一次月考化学试卷宁夏育才中学2016-2017学年高二下学期期中考试化学试题宁夏银川市第一中学2016-2017学年高二下学期期末考试化学试题四川省乐山沫若中学2017-2018学年高二上学期第一次月考化学试题安徽省安庆市五校联盟2017-2018学年高二上学期期中联考化学试题甘肃省嘉峪关市一中2017-2018学年高二上学期期末考试化学(理)试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二下学期4月月考化学试题广西宾阳县宾阳中学2018-2019学年高二5月月考化学试题宁夏银川一中2018-2019学年高二下学期期末考试化学试题陕西省宝鸡中学2019-2020学年高二下学期期中考试化学试题河北省衡水市桃城区第十四中学2019-2020学年高二下学期摸底考试化学试题内蒙古自治区包头市北方重工业集团有限公司第三中学2019-2020学年高二下学期期中考试化学试题(已下线)第35讲 分子结构与性质-2021年高考化学一轮复习名师精讲练辽宁师范大学附属中学2019-2020学年高二下学期期末考试化学试题山西省朔州市怀仁县大地学校2019-2020学年高二下学期第二次月考化学试题四川省成都市蒲江县蒲江中学2019-2020学年高二下学期5月月考化学试题山西省吕梁市2023-2024学年高二上学期1月期末化学试题(已下线)第2章 微粒间相互作用与物质性质(基础过关)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)甘肃省兰州二十七中学2020-2021学年高二下学期期中考试化学试题陕西省宝鸡市渭滨区2020-2021学年高二下学期期末考试化学试题(已下线)2.3.2 氢键 溶解性 分子的手性-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)河南省渑池高级中学2021-2022学年高二11月月考化学试题湖南省常德市安乡县第一中学2021-2022 学年高二下学期期中考试化学试题福建省莆田市第一中学2021-2022学年高二下学期期末考试化学试题
3 . 钛很多重要的化合物。如TiO2、TiCl4、[Ti(OH)2(H2O)4]Cl2。如图为TiO2催化下,O3降解CH3CHO的示意图。回答下列问题:

(1)基态Ti原子的价层电子排布式为________ 。
(2)1molCH3CHO中含有的σ键的数目为_________ (设阿伏加 德罗常数的值为NA),碳原子的杂化方式为________ 。
(3)乙醛的沸点_________ (填“高于”或“低于”)乙醇的沸点,原因是_________ 。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。

①M中非金属元素O、C的第一电离能大小顺序_________ 。
②基态Cl原子的核外电子占据的最高能级的电子云轮廓图为__________ 形。
③M中不含(填代号)________ 。
a.π键 b.离子键 c.σ键 d.配位键
(5)根据等电子原理,可推断O3的空间构型是__________ 。
(6)TiCl4的沸点为136.4℃易溶于乙醇等有机溶剂,说明TiCl4属于_________ 晶体。
(7)钛原子(Ti)一定条件下和碳原子可形成气态团簇分子;分子模型如图1所示,其中白球表示Ti原子,黑球表示碳原子,则其分子式为________ 。已知晶体TiO2的晶胞如图2所示,其晶胞边长为540.0pm,密度为_________ g•cm-3(列式表示),Ti与O之间的距离为________ pm(列式表示)。


(1)基态Ti原子的价层电子排布式为
(2)1molCH3CHO中含有的σ键的数目为
(3)乙醛的沸点
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。

①M中非金属元素O、C的第一电离能大小顺序
②基态Cl原子的核外电子占据的最高能级的电子云轮廓图为
③M中不含(填代号)
a.π键 b.离子键 c.σ键 d.配位键
(5)根据等电子原理,可推断O3的空间构型是
(6)TiCl4的沸点为136.4℃易溶于乙醇等有机溶剂,说明TiCl4属于
(7)钛原子(Ti)一定条件下和碳原子可形成气态团簇分子;分子模型如图1所示,其中白球表示Ti原子,黑球表示碳原子,则其分子式为

您最近一年使用:0次
2020-08-06更新
|
91次组卷
|
2卷引用:山西省孝义市2019-2020学年高二下学期期末考试化学试题
名校
解题方法
4 . 硫代硫酸钠(Na2S2O3)可作为照相业的定影剂,反应的化学方程式为:AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr。下列说法正确的是
| A.基态Br原子中电子的空间运动状态有35种 | B.[Ag(S2O3)2]3-中含有离子键、共价键、配位键 |
C. 中心原子S的杂化方式为sp3 中心原子S的杂化方式为sp3 | D.非金属元素S、O、Br中电负性最大的是Br |
您最近一年使用:0次
2020-06-22更新
|
423次组卷
|
5卷引用:山东省潍坊市2020届高三第三次模拟化学试题
10-11高二下·河北衡水·阶段练习
名校
解题方法
5 . 下列对一些实验事实的理论解释正确的是
| 选项 | 实验事实 | 理论解释 |
| A | SO2溶于水形成的溶液能导电 | SO2是电解质 |
| B | 白磷为正四面体结构的分子 | 白磷分子中P—P键间的键角是109.5° |
| C | 1体积水可以溶解约700体积氨气 | 氨是极性分子且存在氢键的影响 |
| D | HF的沸点高于HCl | H—F的键长比H—Cl的键长短 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-06-16更新
|
180次组卷
|
18卷引用:山西省孝义市2019-2020学年高二下学期3月阶段性考试化学试题
山西省孝义市2019-2020学年高二下学期3月阶段性考试化学试题(已下线)2010-2011学年河北省冀州中学高二下学期第三次月考化学卷(已下线)2011-2012学年陕西省师大附中高二下学期期中考试化学试卷2014-2015学年辽宁实验分校高二下6月阶段测试化学试卷2016届安徽省六安一中高三上第四次月考化学试卷2015-2016学年四川省南充高中高二下期末化学试卷吉林省长春汽车经济开发区第三中学2018-2019学年高二下学期4月月考化学试题天津市第二十中学2019-2020学年高二下学期阶段性检测化学试题福建省莆田第一中学2019-2020学年高二下学期期中考试化学试题四川省乐山十校2020-2021学年高二上学期半期联考化学试题湖北省孝感市高级中学2020—2021学年高二下学期2月调研考试化学试题(已下线)模块同步卷05 分子的立体构型及分子的性质-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)福建省福清西山学校高中部2020-2021学年高二下学期期中考试化学试题吉林省通化县综合高级中学2020-2021学年高二下学期期末考试化学试题宁夏贺兰县景博中学2021-2022学年高二下学期第一次月考化学试题四川省乐山市沫若中学2022-2023学年高二上学期第一次月考化学试题四川省盐亭中学2022-2023学年高二上学期期中教学质量监测(理科)化学试题河南省焦作市2022-2023学年第四中学高二下学期期中考试 化学试卷
10-11高二下·山西吕梁·阶段练习
名校
6 . 下列各组分子中,属于含有非极性键的非极性分子的是
A.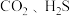 | B.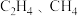 |
C.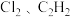 | D. |
您最近一年使用:0次
2020-04-10更新
|
127次组卷
|
18卷引用:2010—2011学年山西省汾阳中学高二3月月考化学试卷
(已下线)2010—2011学年山西省汾阳中学高二3月月考化学试卷(已下线)2010-2011学年湖北省武汉市三角路中学高二下学期期中考试化学试卷(已下线)2011-2012学年河北省邢台一中高二下学期第四次月考化学试卷(已下线)2013届山西省山西大学附属中学高三10月月考化学试卷(已下线)2012-2013学年湖北省荆州市监利县柘木中学高二下第二次月考化学卷(已下线)2014年高二鲁科版选修3化学规范训练2.2.1典型分子空间构型练习卷2016-2017学年河北省张家口一中高二12月月考化学卷2016-2017学年福建省三明市第一中学高二下学期第一次月考化学试卷人教版2017-2018学年高二化学选修三同步训练:第二章 分子结构与性质云南省玉溪市易门中学2017-2018学年高二上学期期中考试化学试题吉林省长春汽车经济开发区第三中学2018-2019学年高二下学期4月月考化学试题吉林省汪清县第六中学2018-2019学年高二下学期期中考试化学试题黑龙江省哈尔滨市阿城区第二中学2018-2019学年高二下学期期中考试化学试题云南省昭通市绥江县二中2019-2020学年高二上学期期末考试化学试题课时3 分子的空间构型与分子性质——A学习区 夯实基础(鲁科版选修3)辽宁省阜新市第二高级中学2019-2020学年高二下学期期末考试化学试题江苏省东台中学2018-2019学年高二上学期期末考试化学试题(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第2节 共价键与分子的空间结构
名校
7 . 固体A的化学式为NH5(也可写为:NH4H),它的所有原子的最外层均满足2个或8个电子的稳定结构。则下列有关说法中错误的是( )
| A.它与水反应的化学方程式为NH5 + H2O ═ NH3•H2O + H2↑ |
| B.NH5中既有共价键又有离子键 |
C.NH5的电子式为  |
| D.1 mol NH5中含有5NA个N﹣H键(NA表示阿伏加 德罗常数的值)。 |
您最近一年使用:0次
2019-10-18更新
|
301次组卷
|
4卷引用:山西省孝义市2019-2020学年高二下学期3月阶段性考试化学试题
名校
8 . N2F2 分子中四个原子都在同一平面内,由于几何形状的不同,存在顺式和反式两种同分异构体。据此判断N2F2分子中两个N原子之间化学键的组成为( )
| A.一个σ键和两个π键 | B.仅有一个σ键 |
| C.仅有一个π键 | D.一个σ键和一个π键 |
您最近一年使用:0次
2019-06-16更新
|
228次组卷
|
7卷引用:山西省吕梁市汾阳中学2018-2019学年高二下学期期中考试化学试题
山西省吕梁市汾阳中学2018-2019学年高二下学期期中考试化学试题【全国百强校】山西大学附属中学2018-2019学年高二下学期3月模块诊断化学试题【全国百强校】山西省山西大学附属中学2018-2019学年高二下学期3月模块诊断化学试题山东省聊城市东阿县第一中学2018-2019学年高二第二学期阶段性测试化学试题(已下线)第二单元 化学键与分子间作用力(基础过关)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)(已下线)2.1.1 共价键的类型-σ键和π键-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)山东省青岛市第二中学2022-2023学年高二上学期期末考试化学试题
9 . 下列说法错误的是( )
A.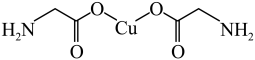 σ键和π键比例为7:1 σ键和π键比例为7:1 |
| B.某元素气态基态原子的逐级电离能(kJ•mol﹣1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+ |
C.C22﹣与O22+互为等电子体,1 mol O22+中含有的π键数目为2NA, O22+的电子式为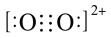 |
| D.已知反应N2O4(l)+2N2H4(l)═3N2(g)+4H2O(l),若该反应中有4 mol N﹣H键断裂,则形成的π键数目为3NA |
您最近一年使用:0次
2019-05-02更新
|
614次组卷
|
4卷引用:山西省孝义市2019-2020学年高二下学期3月阶段性考试化学试题
名校
解题方法
10 . 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。AC2是非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子在外界。根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为_________ ;
(2)B的氢化物的分子立体构型是_____ ;其中心原子采取_______ 杂化。
(3)写出化合物AC2的电子式为_______ ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为______ 。
(4)E的核外电子排布式是______ ,ECl3形成的配合物的化学式为_____
(1)A、B、C的第一电离能由小到大的顺序为
(2)B的氢化物的分子立体构型是
(3)写出化合物AC2的电子式为
(4)E的核外电子排布式是
您最近一年使用:0次
2019-04-20更新
|
161次组卷
|
2卷引用:山西省孝义市2019-2020学年高二下学期3月阶段性考试化学试题



