1 . 、臭氧 在
在 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, 也可在其他条件下被还原为
也可在其他条件下被还原为 。
。
(1)基态铁原子有___________ 种空间运动状态不同的电子; 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为___________ ; 的空间构型为
的空间构型为___________ (用文字描述); 为
为___________ 分子(填“极性”、“非极性”)。
(2)碘的四氯化碳溶液为紫红色,加入浓碘化钾水溶液,振荡后溶液紫色变浅,请用离子方程式说明原因___________ 。
(3)硫单质的常见形式为 ,其环状结构如图所示,
,其环状结构如图所示, 中含有
中含有___________ 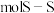 键。
键。 的熔点为1090℃,远高于
的熔点为1090℃,远高于 的192℃,由此可以判断铝氟之间的化学键为
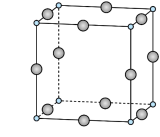
的192℃,由此可以判断铝氟之间的化学键为___________ 键。 结构属立方晶系,晶胞如图所示,
结构属立方晶系,晶胞如图所示, 的配位数为。若晶胞参数为
的配位数为。若晶胞参数为 ,晶体密度
,晶体密度
___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 在
在 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, 也可在其他条件下被还原为
也可在其他条件下被还原为 。
。(1)基态铁原子有
 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为 的空间构型为
的空间构型为 为
为(2)碘的四氯化碳溶液为紫红色,加入浓碘化钾水溶液,振荡后溶液紫色变浅,请用离子方程式说明原因
(3)硫单质的常见形式为
 ,其环状结构如图所示,
,其环状结构如图所示, 中含有
中含有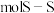 键。
键。
 的熔点为1090℃,远高于
的熔点为1090℃,远高于 的192℃,由此可以判断铝氟之间的化学键为
的192℃,由此可以判断铝氟之间的化学键为 结构属立方晶系,晶胞如图所示,
结构属立方晶系,晶胞如图所示, 的配位数为。若晶胞参数为
的配位数为。若晶胞参数为 ,晶体密度
,晶体密度
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
2 . 已知 呈粉红色,
呈粉红色,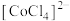 呈蓝色,
呈蓝色,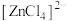 为无色。现将
为无色。现将 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: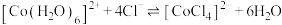 ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
 呈粉红色,
呈粉红色,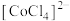 呈蓝色,
呈蓝色,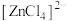 为无色。现将
为无色。现将 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: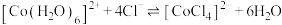 ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
A.等物质的量的 和 和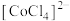 中 中 键数之比为 键数之比为 |
B.由实验1可推知 |
C.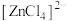 和 和 的配位数之比为 的配位数之比为 |
D.由实验③可知配离子的稳定性: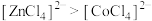 |
您最近一年使用:0次
名校
3 . 下列说法正确的是
| A.烷基是推电子基团,故甲酸的酸性强于乙酸 |
| B.水分子在较高温度下也很稳定与氢键有关 |
C.白磷 空间结构呈正四面体形,1mol白磷含 空间结构呈正四面体形,1mol白磷含 个P-P 个P-P |
D.邻羟基苯甲醛分子内氢键示意图: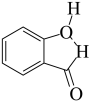 |
您最近一年使用:0次
名校
解题方法
4 .  可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关
可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关 的说法正确的是
的说法正确的是
 可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关
可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关 的说法正确的是
的说法正确的是
A. 是只含极性键的非极性分子 是只含极性键的非极性分子 | B.键角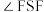 都等于 都等于 |
| C.S与F之间共用电子对偏向S | D.推测 在水中溶解度较大 在水中溶解度较大 |
您最近一年使用:0次
名校
5 . 抗癌药阿霉素与环糊精在水溶液中形成超分子包合物,结构如下图,增大了阿霉素的水溶性,控制了阿霉素的释放速度,从而提高药效。下列说法错误的是
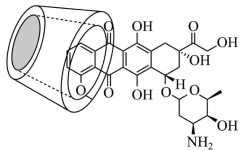
A.阿霉素分子中碳原子的杂化方式为 、 、 |
| B.可以通过晶体的X射线衍射实验获得阿霉素分子的键长和键角 |
C.该超分子包合物中既有 键,又有 键,又有 键 键 |
| D.阿霉素分子中不含手性碳原子 |
您最近一年使用:0次
名校
6 . 下列结论正确,且能用键能解释的是
| 化学键 |  |  |  |  |  |  |
键能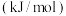 | 411 | 318 | 799 | 358 | 346 | 222 |
A.键角: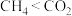 | B.键长: |
C.稳定性: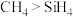 | D.电负性: |
您最近一年使用:0次
2024-03-05更新
|
489次组卷
|
5卷引用:四川省成都市成华区某校2023-2024学年高二下学期4月月考化学试题
四川省成都市成华区某校2023-2024学年高二下学期4月月考化学试题浙江省湖州市德清县求是高级中学有限公司2023-2024学年高二上学期期末考试化学试题(已下线)2.1.2键参数——键能、键长与键角(已下线)2.1.2 键参数——键能、键长与键角(巩固)(已下线)清单02 分子结构与性质(考点清单)(讲+练)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)
名校
解题方法
7 . 钛是20世纪50年代发展起来的一种重要的结构金属,被广泛用于各个领域。回答下列问题:
(1)基态Ti原子的价层电子排布图为___________ 。
(2)Ti的配合物有多种,如Ti(CO)6,[Ti(H2O)5Cl]3+ 等。
①Ti(CO)6和[Ti(H2O)5Cl]3+中配体所含元素的电负性由小到大的顺序是___________ (写元素符号),其中1molTi(CO)6含有σ键的数目为 ___________ 。
②[Ti(H2O)5Cl]3+的配位数为___________ ,配体H2O中键角∠HOH ___________ (填“大于”、“小于”或“等于”)单个H2O分子中键角∠HOH,原因是 ___________ 。
(3)TiO2作光催化剂能将室内空气污染物甲醛、苯等有害物质转化为CO2和H2O。甲醛分子中心原子的杂化方式为___________ ,甲醛极易溶于水的原因是 ___________ 。
(4)某钛的化合物立方晶胞如图所示:
①与Ti4+最邻近且等距离的O2﹣构成的几何图形为___________ 。
②若设晶胞边长为anm,阿伏加德罗常数的值为NA,则该晶体密度为___________ g•cm﹣3.
③原子分数坐标可用于表示晶胞内部各原子的相对位置。其中,原子分数坐标1为(0,0,0),坐标2为 ( ,
, ,
, ),则坐标3的原子分数坐标为
),则坐标3的原子分数坐标为 ___________ 。
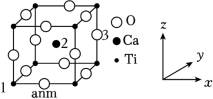
(1)基态Ti原子的价层电子排布图为
(2)Ti的配合物有多种,如Ti(CO)6,[Ti(H2O)5Cl]3+ 等。
①Ti(CO)6和[Ti(H2O)5Cl]3+中配体所含元素的电负性由小到大的顺序是
②[Ti(H2O)5Cl]3+的配位数为
(3)TiO2作光催化剂能将室内空气污染物甲醛、苯等有害物质转化为CO2和H2O。甲醛分子中心原子的杂化方式为
(4)某钛的化合物立方晶胞如图所示:
①与Ti4+最邻近且等距离的O2﹣构成的几何图形为
②若设晶胞边长为anm,阿伏加德罗常数的值为NA,则该晶体密度为
③原子分数坐标可用于表示晶胞内部各原子的相对位置。其中,原子分数坐标1为(0,0,0),坐标2为 (
 ,
, ,
, ),则坐标3的原子分数坐标为
),则坐标3的原子分数坐标为 
您最近一年使用:0次
名校
解题方法
8 . 我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下: ,下列有关说法正确的是
,下列有关说法正确的是
 ,下列有关说法正确的是
,下列有关说法正确的是| A.HCHO分子间存在氢键 | B. 是非极性键组成的非极性分子 是非极性键组成的非极性分子 |
C.每生成 消耗 消耗 | D.HCHO分子中既含σ键又含π键 |
您最近一年使用:0次
名校
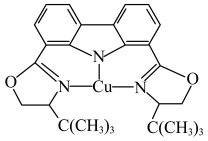
9 . 铜是重要的过渡金属元素,铜被广泛应用于电子工业和航天领域中。回答下列问题:
(1)基态铜原子的核外电子排布式为___________ ,同周期与铜原子未成对电子数相同的p区元素原子为___________ (填符号)。
(2)向CuSO4溶液中滴加氨水可以得到1∶1型离子化合物,其阳离子结构如图所示,阴离子为正四面体结构。________ (填序号)。
A.离子键 B.极性键 C.非极性键 D.σ键 E.π键 F.配位键 G.氢键
②H2O与NH3中键角较大的是________ ,原因是________ 。
③该化合物加热时首先失去的组分是H2O,原因是________ 。
(3)我国科学家制取了一种铜的配合物如图所示,该配合物中四种非金属元素的第一电离能由大到小的顺序是_________ (填元素符号),配合物中sp2 杂化的碳原子与sp3 杂化的碳原子个数比为___________ 。___________ (用含r、ρ、NA的代数式表示)。
(1)基态铜原子的核外电子排布式为
(2)向CuSO4溶液中滴加氨水可以得到1∶1型离子化合物,其阳离子结构如图所示,阴离子为正四面体结构。

A.离子键 B.极性键 C.非极性键 D.σ键 E.π键 F.配位键 G.氢键
②H2O与NH3中键角较大的是
③该化合物加热时首先失去的组分是H2O,原因是
(3)我国科学家制取了一种铜的配合物如图所示,该配合物中四种非金属元素的第一电离能由大到小的顺序是

您最近一年使用:0次
名校
解题方法
10 . 在下列各题的横线上选择正确选项(A.“>”、B.“<”、C.“=”、D.“不确定”)。
(1)键能:
___________ Cl-Cl。
(2)分子极性:H2O___________ CH4。
(3)硬度:Si___________ SiC。
(4)键角:SO2___________ SO3。
(5)最外层电子数:B___________ Mn。
(6)熔沸点:MgO___________ NaCl。
(7)单电子数:Cr___________ Co。
(8)酸性:H3AsO4___________ H3AsO3。
(9)与NaOH反应中和热:HAc___________ HCl。
(10)晶体中阳离子配位数:CaF2___________ NaCl。
(11)晶胞空间利用率:Na___________ K。
(12)中心原子孤电子对:SO2___________ XeF2。
(13)第一电离能:I1(S)___________ I1(P)。
(14)分解温度:MgCO3___________ BaCO3。
(15)配位数:Mg___________ Cu。
(1)键能:

(2)分子极性:H2O
(3)硬度:Si
(4)键角:SO2
(5)最外层电子数:B
(6)熔沸点:MgO
(7)单电子数:Cr
(8)酸性:H3AsO4
(9)与NaOH反应中和热:HAc
(10)晶体中阳离子配位数:CaF2
(11)晶胞空间利用率:Na
(12)中心原子孤电子对:SO2
(13)第一电离能:I1(S)
(14)分解温度:MgCO3
(15)配位数:Mg
您最近一年使用:0次



