名校
1 . 下列有关共价键的键参数的说法不正确的是
A. 、 、 、 、 分子中的键角依次增大 分子中的键角依次增大 |
B.HF、 、 、 分子中的键长依次增长 分子中的键长依次增长 |
C. 、 、 、 、 分子中的键能依次减小 分子中的键能依次减小 |
| D.分子中共价键的键能越大,分子的熔、沸点越高 |
您最近一年使用:0次
2022-08-28更新
|
1358次组卷
|
25卷引用:广西南宁市宾阳县宾阳中学2021-2022学年高二下学期3月月考化学试题
广西南宁市宾阳县宾阳中学2021-2022学年高二下学期3月月考化学试题福建省三明市四地四校2021-2022学年高二下学期期中联考化学试题(已下线)第39练 共价键-2023年高考化学一轮复习小题多维练(全国通用)第二章 本章达标检测2山西省太原市英才学校2021-2022学年高二下学期线上期中化学试题福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(2卷)试题广东省广州市第三中学2022-2023学年高二上学期期末测试化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 B素养拓展区(人教版2019)选择性必修2 第二章 分子结构与性质 第一节 共价键(已下线)2.1 共价键(C级检测练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)四川省成都市阳安中学2020-2021学年高二下学期3月月考化学试题福建省南平市浦城县2020-2021学年高二下学期第一次月考化学试题吉林省延边第二中学2020-2021学年高二下学期期中考试化学试题山东省泰安市宁阳一中2020-2021学年高二下学期期中考试化学试题(已下线)课时55 分子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)(已下线)2.1 共价键-同步学习必备知识江西省宜春市丰城市第九中学2022-2023学年高二下学期开学质量检测化学试题广东省惠州市博罗县2022-2023学年高二下学期期中学科质量检测化学试题(已下线)第3讲 化学键 共价键的类型及键参数(已下线)第03讲 共价键-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)山东省东营市利津县高级中学2023-2024学年高二12月月考化学试题(已下线)热点03 共价键河北省衡水市枣强中学2023-2024学年高二下学期第一次调研考试化学试题四川省南充市阆中中学校2023-2024学年高二下学期3月月考化学试卷(已下线)2.1.2 键参数——键能、键长与键角课堂例题
名校
2 .  、
、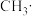 、
、 都是重要的有机反应中间体,有关它们的说法正确的是
都是重要的有机反应中间体,有关它们的说法正确的是
 、
、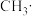 、
、 都是重要的有机反应中间体,有关它们的说法正确的是
都是重要的有机反应中间体,有关它们的说法正确的是A.碳原子均采取sp2杂化,且 中所有原子均共面 中所有原子均共面 |
B.CH 与NH3、H3O+互为等电子体,几何构型均为三角锥形 与NH3、H3O+互为等电子体,几何构型均为三角锥形 |
C. 与OH-形成离子化合物 与OH-形成离子化合物 |
| D.分子式为C5H8的链状烃分子结构中含有1个π键 |
您最近一年使用:0次
名校
3 . 下列说法中正确的是
| A.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 |
| B.P4和CH4都是正四面体型分子且键角都为109.5° |
C.NH 的电子式为 的电子式为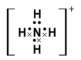 ,离子呈平面正方形结构 ,离子呈平面正方形结构 |
| D.NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构 |
您最近一年使用:0次
名校
4 . 捕获二氧化碳是碳中和技术之一,一种捕获二氧化碳在某催化剂表面制备甲酸的反应机理如图所示。下列说法不正确的是


A.CO2的电子式为 |
| B.催化剂可以降低该反应过程中的活化能 |
| C.1molN(C2H5)3中共含有18mol共价键 |
D.该反应的总反应方程式为CO2+H2 HCOOH HCOOH |
您最近一年使用:0次
2022-07-12更新
|
116次组卷
|
3卷引用:广西河池市2021-2022学年高二下学期期末考试化学试题
解题方法
5 . 完成下列问题。
(1)甲醇( )空气氧化法是生产工业甲醛(HCHO)的常用方法。发生的反应为:
)空气氧化法是生产工业甲醛(HCHO)的常用方法。发生的反应为: 2
2

①HCHO分子内σ键与π键个数之比为_______ ,HCHO的空间结构为_______ 。
② 和HCHO分子中碳原子的杂化轨道类型分别为
和HCHO分子中碳原子的杂化轨道类型分别为_______ 和_______ 。
③甲醇氧化生成HCHO时,会产生CO、 、
、 等副产物。相同条件下,
等副产物。相同条件下, 的沸点比
的沸点比 的高,主要原因为
的高,主要原因为_______ 。
(2)金属镍是电池制造过程中重要的原材料,未来十年新能源汽车领域镍需求增长将达8~16倍。一种制备金属镍的方法为 。回答下列问题:
。回答下列问题:
①已知 熔融状态时能导电,上述制备反应化学方程式中的6种物质所属的晶体类型有
熔融状态时能导电,上述制备反应化学方程式中的6种物质所属的晶体类型有____ 种。
②丁二酮肟( )是检验
)是检验 的灵敏试剂,可与
的灵敏试剂,可与 生成丁二酮肟镍亮红色沉淀。丁二酮肟镍分子(结构如图1所示)内不存在的作用力有
生成丁二酮肟镍亮红色沉淀。丁二酮肟镍分子(结构如图1所示)内不存在的作用力有_______ (填标号)。

A.金属键 B.氢键 C.π键 D.配位键 E.离子键
③镧镍合金是稀土系储氢合金的典型代表,其晶胞参数分别为apm、bpm、cpm,阿伏加德罗常数的值为 ,该合金储氢后的晶胞如图2所示。1mol镧形成的该合金能储存
,该合金储氢后的晶胞如图2所示。1mol镧形成的该合金能储存_______ mol氢气。储氢前,该合金的密度为_______  (列出含a、b、c和
(列出含a、b、c和 的计算式即可)。
的计算式即可)。

(1)甲醇(
 )空气氧化法是生产工业甲醛(HCHO)的常用方法。发生的反应为:
)空气氧化法是生产工业甲醛(HCHO)的常用方法。发生的反应为: 2
2

①HCHO分子内σ键与π键个数之比为
②
 和HCHO分子中碳原子的杂化轨道类型分别为
和HCHO分子中碳原子的杂化轨道类型分别为③甲醇氧化生成HCHO时,会产生CO、
 、
、 等副产物。相同条件下,
等副产物。相同条件下, 的沸点比
的沸点比 的高,主要原因为
的高,主要原因为(2)金属镍是电池制造过程中重要的原材料,未来十年新能源汽车领域镍需求增长将达8~16倍。一种制备金属镍的方法为
 。回答下列问题:
。回答下列问题:①已知
 熔融状态时能导电,上述制备反应化学方程式中的6种物质所属的晶体类型有
熔融状态时能导电,上述制备反应化学方程式中的6种物质所属的晶体类型有②丁二酮肟(
 )是检验
)是检验 的灵敏试剂,可与
的灵敏试剂,可与 生成丁二酮肟镍亮红色沉淀。丁二酮肟镍分子(结构如图1所示)内不存在的作用力有
生成丁二酮肟镍亮红色沉淀。丁二酮肟镍分子(结构如图1所示)内不存在的作用力有
A.金属键 B.氢键 C.π键 D.配位键 E.离子键
③镧镍合金是稀土系储氢合金的典型代表,其晶胞参数分别为apm、bpm、cpm,阿伏加德罗常数的值为
 ,该合金储氢后的晶胞如图2所示。1mol镧形成的该合金能储存
,该合金储氢后的晶胞如图2所示。1mol镧形成的该合金能储存 (列出含a、b、c和
(列出含a、b、c和 的计算式即可)。
的计算式即可)。
您最近一年使用:0次
解题方法
6 . 按要求回答下列问题。
(1)A是在地壳中含量最多的元素,该元素原子的电子排布图是_______ ,其原子核外有_______ 个未成对电子,能量最高的电子所在的轨道呈_______ 形。B为周期表中第29号元素,B的电子排布式为_______ 。
(2)汽车尾气含有CO和NO等有毒气体,净化有毒气体的反应方程式为: ,此反应中涉及元素的第一电离能大小关系为
,此反应中涉及元素的第一电离能大小关系为_______ ;此反应中涉及物质中互为等电子体的是_______ ; 的结构式为
的结构式为_______ 。
(3)元素周期表中除放射性元素外,电负性最小的元素与电负性最大的元素形成的化合物的电子式为:_______ 。
(1)A是在地壳中含量最多的元素,该元素原子的电子排布图是
(2)汽车尾气含有CO和NO等有毒气体,净化有毒气体的反应方程式为:
 ,此反应中涉及元素的第一电离能大小关系为
,此反应中涉及元素的第一电离能大小关系为 的结构式为
的结构式为(3)元素周期表中除放射性元素外,电负性最小的元素与电负性最大的元素形成的化合物的电子式为:
您最近一年使用:0次
解题方法
7 . 铜及其化合物是生活、生产中运用广泛的材料。
(1)铜元素在周期表中的位置是___________ ,基态 原子核外电子占据最高能层的符号是
原子核外电子占据最高能层的符号是___________ 。
(2)合成氨工业常用醋酸二氨合铜(I){ }溶液吸收对氨合成的催化剂有毒害作用的
}溶液吸收对氨合成的催化剂有毒害作用的 。
。
① 中存在的化学键类型有
中存在的化学键类型有___________ 。
② 的沸点比
的沸点比 的沸点
的沸点___________ ,原因是___________ 。 的键角小于
的键角小于 的键角,原因是
的键角,原因是___________ 。
(3)晶胞的两个基本要素。
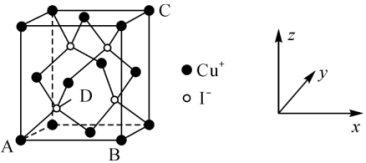
①原子坐标参数:晶胞内部各微粒的相对位置。 的晶胞结构如图所示,其中原子坐标参数:A
的晶胞结构如图所示,其中原子坐标参数:A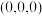 ;B
;B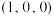 ;C
;C 。则
。则 处微粒的坐标参数为
处微粒的坐标参数为___________ 。
②晶胞参数:描述晶胞的大小和形状。若晶胞的边长为 ,则
,则 与
与 的最短距离为
的最短距离为___________  ,设
,设 为阿伏加德罗常数的值,该化合物的密度为
为阿伏加德罗常数的值,该化合物的密度为___________ (用含 、
、 的代数式表示)
的代数式表示) 。
。
(1)铜元素在周期表中的位置是
 原子核外电子占据最高能层的符号是
原子核外电子占据最高能层的符号是(2)合成氨工业常用醋酸二氨合铜(I){
 }溶液吸收对氨合成的催化剂有毒害作用的
}溶液吸收对氨合成的催化剂有毒害作用的 。
。①
 中存在的化学键类型有
中存在的化学键类型有②
 的沸点比
的沸点比 的沸点
的沸点 的键角小于
的键角小于 的键角,原因是
的键角,原因是(3)晶胞的两个基本要素。
①原子坐标参数:晶胞内部各微粒的相对位置。
 的晶胞结构如图所示,其中原子坐标参数:A
的晶胞结构如图所示,其中原子坐标参数:A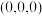 ;B
;B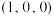 ;C
;C 。则
。则 处微粒的坐标参数为
处微粒的坐标参数为
②晶胞参数:描述晶胞的大小和形状。若晶胞的边长为
 ,则
,则 与
与 的最短距离为
的最短距离为 ,设
,设 为阿伏加德罗常数的值,该化合物的密度为
为阿伏加德罗常数的值,该化合物的密度为 、
、 的代数式表示)
的代数式表示) 。
。
您最近一年使用:0次
8 .  为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是
 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是A.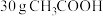 中 中 杂化的碳原子数为 杂化的碳原子数为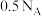 |
B.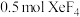 中氙的价层电子对数为 中氙的价层电子对数为 |
C.冰中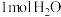 含有氢键的数目为 含有氢键的数目为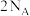 |
D.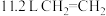 中 中 键的数目为 键的数目为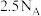 |
您最近一年使用:0次
解题方法
9 . 下列各组分子中,都属于含极性键的非极性分子的是
| A.C2H4、CH4 | B.NH3、HCl | C.P4、CCl4 | D.CO2、 H2 |
您最近一年使用:0次
10 . 碳族元素在生产生活中的应用极其广泛,请回答以下有关碳族元素的问题。
(1)Si位于周期表的_______ 区, 基态Si原子含有_______ 个未成对电子,其核外电子有_______ 种空间运动状态。
(2)甲醇重整制氢反应中,铜基催化剂(CuO/SiO2)具有重整温度低、催化选择性高等优点。Cu、Si、O三种元素的电负性由大到小的顺序是_______ 。
(3)锡(Sn)是人类最早使用的元素之一,化合物SnCl4常温下为无色液体,它的晶体类型是_______ ,属于_______ (填“极性分子”或“非极性分子”),与SnCl4互为等电子体的阴离子_______ (写一种)。
(4)C16S8是新型环烯类储氢材料,研究证明其分子呈平面结构(如图1所示)。
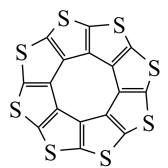
图1
①C16S8分子中C原子和S原子的杂化轨道类型分别为_______ 、_______ 。
②测得C16S8中碳硫键的键长介于C-S键和C=S键之间,其原因可能是_______ 。
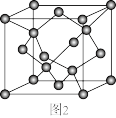
(5)锗(Ge)是典型的半导体材料,在电子、材料等领域应用广泛。锗单晶的晶胞结构如图2所示,其晶胞参数为apm,阿伏加德罗常数的值为NA,则晶体密度为_______ g·cm-3(列出计算式即可)。
(1)Si位于周期表的
(2)甲醇重整制氢反应中,铜基催化剂(CuO/SiO2)具有重整温度低、催化选择性高等优点。Cu、Si、O三种元素的电负性由大到小的顺序是
(3)锡(Sn)是人类最早使用的元素之一,化合物SnCl4常温下为无色液体,它的晶体类型是
(4)C16S8是新型环烯类储氢材料,研究证明其分子呈平面结构(如图1所示)。

图1
①C16S8分子中C原子和S原子的杂化轨道类型分别为
②测得C16S8中碳硫键的键长介于C-S键和C=S键之间,其原因可能是
(5)锗(Ge)是典型的半导体材料,在电子、材料等领域应用广泛。锗单晶的晶胞结构如图2所示,其晶胞参数为apm,阿伏加德罗常数的值为NA,则晶体密度为

您最近一年使用:0次



