名校
1 . 已知反应: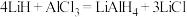 。下列说法正确的是
。下列说法正确的是
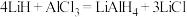 。下列说法正确的是
。下列说法正确的是A. 为共价化合物,属于极性分子 为共价化合物,属于极性分子 |
B. 和 和 中的Al均为 中的Al均为 杂化 杂化 |
| C.LiH和LiCl的晶体中微粒相互作用力相同 |
D.电负性: |
您最近一年使用:0次
2 . 氯化亚铜可用作有机合成的催化剂。以黄铜矿(主要成分为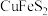 ,还含杂质
,还含杂质 )为主要原料制备
)为主要原料制备 的流程如下。已知:
的流程如下。已知: 可以溶解在氯离子浓度较大的溶液中,生成
可以溶解在氯离子浓度较大的溶液中,生成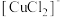 ,
,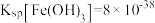 ,
,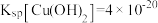 ,
, 。
。___________ (填“大于”或“小于”)锌的第二电离能,其主要原因是___________ 。
(2)“滤渣1”的主要成分为___________ 。
(3)用 溶液调节溶液的
溶液调节溶液的 的值应大于
的值应大于___________ 。
(4)“还原”过程中发生的主要反应的离子方程式为___________ ;该过程中若 的用量过多,造成的后果是
的用量过多,造成的后果是___________ 。
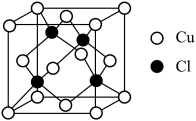
(5)氯化亚铜的立方晶胞如图所示,已知其密度为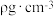 ,
, 为阿伏加德罗常数的值,晶胞中
为阿伏加德罗常数的值,晶胞中 的配位数为
的配位数为___________ ,该晶胞参数为___________  。
。
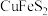 ,还含杂质
,还含杂质 )为主要原料制备
)为主要原料制备 的流程如下。已知:
的流程如下。已知: 可以溶解在氯离子浓度较大的溶液中,生成
可以溶解在氯离子浓度较大的溶液中,生成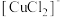 ,
,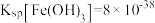 ,
,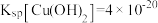 ,
, 。
。
(2)“滤渣1”的主要成分为
(3)用
 溶液调节溶液的
溶液调节溶液的 的值应大于
的值应大于(4)“还原”过程中发生的主要反应的离子方程式为
 的用量过多,造成的后果是
的用量过多,造成的后果是(5)氯化亚铜的立方晶胞如图所示,已知其密度为
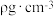 ,
, 为阿伏加德罗常数的值,晶胞中
为阿伏加德罗常数的值,晶胞中 的配位数为
的配位数为 。
。
您最近一年使用:0次
名校
解题方法
3 . 常温下,二氧化氯(ClO2)是一种黄绿色气体,具有强氧化性,其中心原子Cl为sp2杂化已被联合国卫生组织(WTO)列为Al级高效安全消毒剂,其中心原子Cl为sp2杂化。已知,工业上制备二氧化氯的方法之一是用甲醇在酸性条件下与氯酸钠反应,其反应的化学方程式:CH3OH+6NaClO3+3H2SO4=CO2↑+6ClO2↑+3Na2SO4+5H2O,则下列说法错误的是
| A.CO2是非极性分子 | B.键角: < <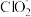 |
| C.CH3OH在反应中发生氧化反应 | D.ClO2分子空间构型为V形 |
您最近一年使用:0次
4 . 下表中A、B、C、D、E为原子序数依次增大的短周期主族元素,F、G为第四周期元素,其相关信息如下:
(1)E元素在周期表中的位置是___________ ,其基态原子最高能层的电子占据的原子轨道电子云为_____________ 形。
(2)F元素位于元素周期的_____________ 区,其基态原子的价层电子轨道表示式为______________ 。
(3)C元素单质的结构式为_____________ ,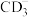 中心原子的杂化方式为
中心原子的杂化方式为___________ ,分子空间构型为_______________ 。
(4)B、C、D、E四种元素的原子半径由大到小的顺序:____________ (填元素符号)。
(5)气态F2+比气态G2+再失去一个电子难,原因是____________ 。
(6)下列关于B2A4的说法中正确的是____________(填序号)。
| A.元素原子是元素周期表中半径最小的原子 |
| B.基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| C.元素原子最高能级的不同轨道都有电子,且只有一种自旋方向 |
| D.原子核外s能级上的电子总数与p能级上的电子总数相等 |
| E.与D为同主族元素 |
| F.其+2价离子的3d轨道为半充满状态 |
| G.目前年产量最大、使用最广泛的金属 |
(2)F元素位于元素周期的
(3)C元素单质的结构式为
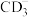 中心原子的杂化方式为
中心原子的杂化方式为(4)B、C、D、E四种元素的原子半径由大到小的顺序:
(5)气态F2+比气态G2+再失去一个电子难,原因是
(6)下列关于B2A4的说法中正确的是____________(填序号)。
| A.B2A4分子中中心原子的杂化类型为sp2 |
| B.B2A4是只由极性键形成的非极性分子 |
| C.B2A4中的所有原子都满足8电子稳定结构 |
| D.B2A4分子中σ键和π键数目比为5:1 |
您最近一年使用:0次
名校
5 . 物质世界缤纷多彩,物质的性质与分子的结构紧密关联。回答下列问题:
I.非金属氟化物在生产、生活和科研中应用广泛。
(1)基态F原子核外电子的空间运动状态有____________ 种。
(2)O、F、Cl电负性由大到小的顺序为______________ ;OF2的熔、沸点___________ (填“高于”或“低于”)Cl2O,原因是__________ 。
Ⅱ、过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应。
(3)对于基态Cr原子,下列叙述正确的是_________ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d44s2
B.从空间角度看,4s轨道比3s轨道大,其空间包含了3s轨道
C.电负性比钾高,原子对键合电子的吸引力比钾大
(4)三价铬离子能形成多种配位化合物。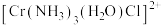 中提供孤电子对形成配位键的原子是
中提供孤电子对形成配位键的原子是___________ ,中心离子的配位数为___________ 。
(5)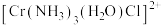 中配体分子NH3、H2O
中配体分子NH3、H2O
①键角:NH3___________ H2O(填“>”或“<”)。
②NH3极易溶于水,原因是____________ 。
(6)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是____________ 原子。设Cr和Al原子半径分别为 和
和 ,晶胞参数如图所示,已知:空间占有率=晶胞中原子总体积/晶胞体积,则金属原子空间占有率为
,晶胞参数如图所示,已知:空间占有率=晶胞中原子总体积/晶胞体积,则金属原子空间占有率为________ %(列出计算表达式)。
I.非金属氟化物在生产、生活和科研中应用广泛。
(1)基态F原子核外电子的空间运动状态有
(2)O、F、Cl电负性由大到小的顺序为
Ⅱ、过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应。
(3)对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d44s2
B.从空间角度看,4s轨道比3s轨道大,其空间包含了3s轨道
C.电负性比钾高,原子对键合电子的吸引力比钾大
(4)三价铬离子能形成多种配位化合物。
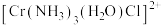 中提供孤电子对形成配位键的原子是
中提供孤电子对形成配位键的原子是(5)
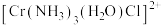 中配体分子NH3、H2O
中配体分子NH3、H2O①键角:NH3
②NH3极易溶于水,原因是
(6)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是
 和
和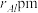 ,晶胞参数如图所示,已知:空间占有率=晶胞中原子总体积/晶胞体积,则金属原子空间占有率为
,晶胞参数如图所示,已知:空间占有率=晶胞中原子总体积/晶胞体积,则金属原子空间占有率为
您最近一年使用:0次
名校
解题方法
6 . 二氯化二硫(S2Cl2)可用于橡胶的低温硫化剂和黏接剂。其分子结构与H2O2相似,室温下稳定,100℃时分解为相应单质,与氯气反应能生成SO2。下列说法错误的是
| A.H2O2是含有极性键和非极性键的非极性分子 | B.Cl2中Cl-Cl是p-pσ键 |
| C.SO2中硫原子的杂化方式为sp2 | D.酸性:H2SO4<HClO4 |
您最近一年使用:0次
名校
解题方法
7 . 前四周期元素A、B、C、D、E的原子序数依次增大,A元素原子的核外电子只有一种运动状态;基态B原子s能级的电子总数比p能级的多1;基态C原子和基态E原子中成对电子数均是未成对电子数的3倍;D形成简单离子的半径在同周期元素形成的简单离子中最小。回答下列问题:
(1)E的元素名称为___________ 。
(2)元素A、B、C中,电负性最大的是___________ (填元素符号 ) 。
(3)BC 中B原子轨道的杂化类型为
中B原子轨道的杂化类型为___________ ,BC 的空间结构为
的空间结构为___________ 。
(4)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。若DB的晶胞参数为a pm,则晶体的密度为___________ g·cm-3(用NA表示阿伏加德罗常数的值)。
(1)E的元素名称为
(2)元素A、B、C中,电负性最大的是
(3)BC
 中B原子轨道的杂化类型为
中B原子轨道的杂化类型为 的空间结构为
的空间结构为(4)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。若DB的晶胞参数为a pm,则晶体的密度为
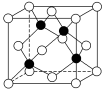
您最近一年使用:0次
名校
解题方法
8 . 下列各种说法中错误的是
| A.形成配位键的条件是一方有空轨道,一方有孤电子对 |
| B.配位键是一种特殊的共价键 |
| C.配位化合物中的配体可以是分子也可以是阴离子 |
| D.配位键具有饱和性,没有方向性 |
您最近一年使用:0次
9 . 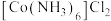 晶体的立方晶胞如下图所示,晶胞参数为apm,若A点原子坐标为
晶体的立方晶胞如下图所示,晶胞参数为apm,若A点原子坐标为 ,B点原子坐标为
,B点原子坐标为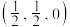 ,已知阿伏加德罗常数的值为
,已知阿伏加德罗常数的值为 ,
,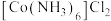 的摩尔质量为232g/mol。下列说法不正确的是
的摩尔质量为232g/mol。下列说法不正确的是
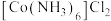 晶体的立方晶胞如下图所示,晶胞参数为apm,若A点原子坐标为
晶体的立方晶胞如下图所示,晶胞参数为apm,若A点原子坐标为 ,B点原子坐标为
,B点原子坐标为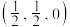 ,已知阿伏加德罗常数的值为
,已知阿伏加德罗常数的值为 ,
,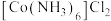 的摩尔质量为232g/mol。下列说法不正确的是
的摩尔质量为232g/mol。下列说法不正确的是
A.该晶体中与 等距且紧邻的 等距且紧邻的 有8个 有8个 |
B.C点原子坐标为 |
C.该晶体的密度为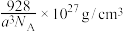 |
| D.该晶体属于离子晶体 |
您最近一年使用:0次
名校
10 . 超氧化钾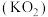 与
与 反应会生成
反应会生成 并放出
并放出 ,下列说法错误的是
,下列说法错误的是
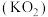 与
与 反应会生成
反应会生成 并放出
并放出 ,下列说法错误的是
,下列说法错误的是A. 的原子结构示意图为 的原子结构示意图为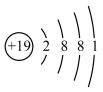 | B. 的空间结构为平面三角形 的空间结构为平面三角形 |
C. 的电子式为 的电子式为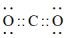 | D.核内有10个中子的氧原子表示为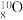 |
您最近一年使用:0次



