名校
解题方法
1 . 氮元素可形成丰富的化合物,在生产生活中具有广泛用途。
(1) 是一种重要的化工原料,以
是一种重要的化工原料,以 合成
合成 ,常用
,常用 作催化剂。基态
作催化剂。基态 原子和基态
原子和基态 中未成对电子数之比为
中未成对电子数之比为_____ ;从轨道重叠方式的角度分析 的成键,
的成键, 分子中氮原子的
分子中氮原子的_____ 轨道与氢原子的 轨道重叠形成
轨道重叠形成 键。
键。
(2) 是中学化学常见微粒,键角:
是中学化学常见微粒,键角:
_____ (填“>”或“<”) 。
。
(3) (氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
① 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是_____
②比较沸点:
_____ (填“>”或“<”,下同) ,水溶性:
,水溶性:
_____  。
。
(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
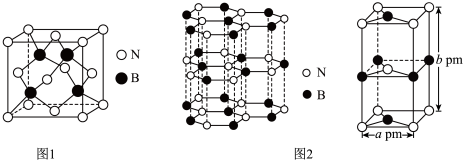
 —射线衍射实验测得立方氮化硼晶胞边长为
—射线衍射实验测得立方氮化硼晶胞边长为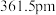 ,则立方氮化硼晶体中硼氮键的键长为
,则立方氮化硼晶体中硼氮键的键长为_____ (只列计算式) 。已知六方氮化硼密度为
。已知六方氮化硼密度为 ,底面角分别为
,底面角分别为 和
和 ,设
,设 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则
_____ (列含a、b、d的计算式即可)
(1)
 是一种重要的化工原料,以
是一种重要的化工原料,以 合成
合成 ,常用
,常用 作催化剂。基态
作催化剂。基态 原子和基态
原子和基态 中未成对电子数之比为
中未成对电子数之比为 的成键,
的成键, 分子中氮原子的
分子中氮原子的 轨道重叠形成
轨道重叠形成 键。
键。(2)
 是中学化学常见微粒,键角:
是中学化学常见微粒,键角:
 。
。(3)
 (氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。①
 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是②比较沸点:

 ,水溶性:
,水溶性:
 。
。(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

 —射线衍射实验测得立方氮化硼晶胞边长为
—射线衍射实验测得立方氮化硼晶胞边长为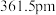 ,则立方氮化硼晶体中硼氮键的键长为
,则立方氮化硼晶体中硼氮键的键长为 。已知六方氮化硼密度为
。已知六方氮化硼密度为 ,底面角分别为
,底面角分别为 和
和 ,设
,设 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则
您最近一年使用:0次
2024-04-02更新
|
444次组卷
|
3卷引用:辽宁省沈阳市东北育才学校高中部2023-2024学年高二下学期第1次月考化学试题
名校
2 . 依据物质结构知识,回答下列问题。
I.硒是一种非金属,可以用作光敏材料、电解锰行业的催化剂。
(1)Se是元素周期表中第34号元素,其基态原子的核外电子简化电子排布式为___________ 。
(2)根据价层电子对互斥理论,可以推知 的空间构型为
的空间构型为___________ ,其中Se原子采用的轨道杂化方式为___________ 。
(3)已知 与
与 结构相似,①
结构相似,①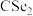 分子内的键角
分子内的键角 、②
、② 分子内的键角
分子内的键角 、③
、③ 分子内的键角
分子内的键角 ,三种键角由大到小的顺序为
,三种键角由大到小的顺序为___________ (填序号)。
Ⅱ.碳是一种重要元素,可形成多种单质及化合物。
(4) 分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子稳定结构,则一个
分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子稳定结构,则一个 分子中
分子中 键的数目为
键的数目为___________ ,含五边形数目是___________ 。
(5)已知 与
与 结构相似,推算HCN分子中
结构相似,推算HCN分子中 键与
键与 键数目之比为
键数目之比为___________ 。氨基氰( )为原料可制得类石墨相氮化碳(
)为原料可制得类石墨相氮化碳( ),氨基氰(
),氨基氰( )分子中碳、氮原子均满足8电子稳定结构,则该分子的结构式为
)分子中碳、氮原子均满足8电子稳定结构,则该分子的结构式为___________ 。
(6)铁触媒是以铁为主体的多成分催化剂,还含有MgO、Cr2O3等氧化物。Cr原子的价电子排布图为___________ ,处于元素周期表中___________ 区。
I.硒是一种非金属,可以用作光敏材料、电解锰行业的催化剂。
(1)Se是元素周期表中第34号元素,其基态原子的核外电子简化电子排布式为
(2)根据价层电子对互斥理论,可以推知
 的空间构型为
的空间构型为(3)已知
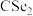 与
与 结构相似,①
结构相似,①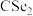 分子内的键角
分子内的键角 、②
、② 分子内的键角
分子内的键角 、③
、③ 分子内的键角
分子内的键角 ,三种键角由大到小的顺序为
,三种键角由大到小的顺序为Ⅱ.碳是一种重要元素,可形成多种单质及化合物。
(4)
 分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子稳定结构,则一个
分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子稳定结构,则一个 分子中
分子中 键的数目为
键的数目为(5)已知
 与
与 结构相似,推算HCN分子中
结构相似,推算HCN分子中 键与
键与 键数目之比为
键数目之比为 )为原料可制得类石墨相氮化碳(
)为原料可制得类石墨相氮化碳( ),氨基氰(
),氨基氰( )分子中碳、氮原子均满足8电子稳定结构,则该分子的结构式为
)分子中碳、氮原子均满足8电子稳定结构,则该分子的结构式为(6)铁触媒是以铁为主体的多成分催化剂,还含有MgO、Cr2O3等氧化物。Cr原子的价电子排布图为
您最近一年使用:0次
名校
3 . “嫦娥五号”首次实现了我国地外天体采样返回,它的成功发射标志着我国航天技术向前迈出了一大步,其制作材料中包含了Cu、Ti、 Cr、Ni、Mo、N、O等多种元素。请回答下列问题:
(1)Mo位于Cr同一副族的相邻下一周期,则基态Mo原子的外围电子排布式为___________ 。
(2)Cu催化烯烃硝化反应过程中会产生NO 。键角: NO
。键角: NO
___________ NO (填“>”或“<”),其原因是
(填“>”或“<”),其原因是___________ 。
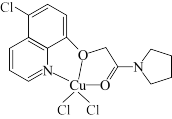
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。CuCl2可与某有机物形成具有较强荧光性能的配合物,其结构如图所示,1mol该配合物中通过螯合作用形成的配位键有___________ mol。
(4)五水合硫酸铜(化学式CuSO4·5H2O)俗称蓝矾或胆矾,结构如图所示,其中存在的化学键有______ 填选项字母)。

A.离子键 B.共价键 C. 金属键 D.配位键 E.氢键
(5)过渡金属与CO形成羰基配合物时,每个CO分子向中心原子提供2个电子,最终使中心原子的电子总数与同周期的稀有气体原子相同,称为有效原子序数规则。根据此规则推断,镍与CO形成的羰基配合物Ni(CO)X中,x=______ 。
(1)Mo位于Cr同一副族的相邻下一周期,则基态Mo原子的外围电子排布式为
(2)Cu催化烯烃硝化反应过程中会产生NO
 。键角: NO
。键角: NO
 (填“>”或“<”),其原因是
(填“>”或“<”),其原因是(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。CuCl2可与某有机物形成具有较强荧光性能的配合物,其结构如图所示,1mol该配合物中通过螯合作用形成的配位键有

(4)五水合硫酸铜(化学式CuSO4·5H2O)俗称蓝矾或胆矾,结构如图所示,其中存在的化学键有

A.离子键 B.共价键 C. 金属键 D.配位键 E.氢键
(5)过渡金属与CO形成羰基配合物时,每个CO分子向中心原子提供2个电子,最终使中心原子的电子总数与同周期的稀有气体原子相同,称为有效原子序数规则。根据此规则推断,镍与CO形成的羰基配合物Ni(CO)X中,x=
您最近一年使用:0次
名校
解题方法
4 . 我国已经形成对全球稀土产业链的统治力,在稀土开采技术方面,我国遥遥领先。同时也是最早研究稀土—钴化合物结构的国家。请回答下列问题:
(1)钴原子的价层电子排布图为___________ ,其M层上有___________ 种不同的空间运动状态,Fe和Co的第四电离能I4(Fe)___________ I4(Co)(填“>”、“<”或“=”)。
(2)为某含钴配合物的组成为CoCl3·5NH3·H2O,是该配合物中钴离子的配位数是6,1mol该配合物可以与足量的硝酸银反应生成3molAgCl沉淀,则该配合物的配体是___________ ,试判断NH3分子与钴离子形成配合物后,H—N—H键角会___________ (填“变大”、“变小”或“不变”)。
(3)具有双钙钛矿型结构的晶体通过掺杂改性可用作固体电解质材料。双钙钛矿型晶体的一种典型结构单元如图所示:

①该晶体的一个完整晶胞中含有___________ 个 原子。
原子。
②真实的晶体中存在5%的O原子缺陷,从而能让 在其中传导,已知
在其中传导,已知 为
为 价,
价, 为
为 价,则
价,则 价
价 与
与 价
价 的原子个数比为
的原子个数比为___________ 。
II.下图为石墨和石墨烯的结构示意图,石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体。

(4)下列关于石墨与石墨烯的说法正确的是___________ 。
A.从石墨中剥离石墨烯需要破坏化学键
B.石墨中的碳原子采取 杂化
杂化
C.石墨属于混合型晶体,层与层之间存在分子间作用力
D.层内碳原子间存在共价键
E.石墨烯中平均每个六元碳环含有3个碳原子
(1)钴原子的价层电子排布图为
(2)为某含钴配合物的组成为CoCl3·5NH3·H2O,是该配合物中钴离子的配位数是6,1mol该配合物可以与足量的硝酸银反应生成3molAgCl沉淀,则该配合物的配体是
(3)具有双钙钛矿型结构的晶体通过掺杂改性可用作固体电解质材料。双钙钛矿型晶体的一种典型结构单元如图所示:

①该晶体的一个完整晶胞中含有
 原子。
原子。②真实的晶体中存在5%的O原子缺陷,从而能让
 在其中传导,已知
在其中传导,已知 为
为 价,
价, 为
为 价,则
价,则 价
价 与
与 价
价 的原子个数比为
的原子个数比为II.下图为石墨和石墨烯的结构示意图,石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体。

(4)下列关于石墨与石墨烯的说法正确的是
A.从石墨中剥离石墨烯需要破坏化学键
B.石墨中的碳原子采取
 杂化
杂化C.石墨属于混合型晶体,层与层之间存在分子间作用力
D.层内碳原子间存在共价键
E.石墨烯中平均每个六元碳环含有3个碳原子
您最近一年使用:0次
名校
解题方法
5 . 我国国产洲际战略导弹的制作材料中包含了Cu、Se、Ti、Fe、Cr、Ni、C等多种元素,这些元素化合物在生产、生活中应用广泛。回答下列问题:
(1) 可以与胺形成配合物,如[
可以与胺形成配合物,如[ ]、[
]、[ ]等具有相同配位数。
]等具有相同配位数。
①[ ]中Ti的配位数是
]中Ti的配位数是___________ 。
②1mol [ ]中含有的σ键数目为
]中含有的σ键数目为___________ ( 表示阿伏伽德罗常数)。
表示阿伏伽德罗常数)。
③配合物[ ]与游离的
]与游离的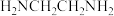 分子相比,其H-N-H键角
分子相比,其H-N-H键角___________ (填“较大”,“较小”或“相同”),原因是___________ 。
(2)研究表明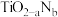 是光学活性物质,它可由
是光学活性物质,它可由 通过N掺杂反应(如下图)生成,则
通过N掺杂反应(如下图)生成,则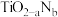 晶体中a=
晶体中a=___________ ,b=___________ 。

(3)如图是含Cu、Zn、Sn及S的四元半导体化合物的四方晶胞。

以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原子的坐标为 ,则B原子的坐标为
,则B原子的坐标为___________ 。
(1)
 可以与胺形成配合物,如[
可以与胺形成配合物,如[ ]、[
]、[ ]等具有相同配位数。
]等具有相同配位数。①[
 ]中Ti的配位数是
]中Ti的配位数是②1mol [
 ]中含有的σ键数目为
]中含有的σ键数目为 表示阿伏伽德罗常数)。
表示阿伏伽德罗常数)。③配合物[
 ]与游离的
]与游离的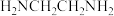 分子相比,其H-N-H键角
分子相比,其H-N-H键角(2)研究表明
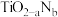 是光学活性物质,它可由
是光学活性物质,它可由 通过N掺杂反应(如下图)生成,则
通过N掺杂反应(如下图)生成,则 晶体中a=
晶体中a=
(3)如图是含Cu、Zn、Sn及S的四元半导体化合物的四方晶胞。

以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原子的坐标为
 ,则B原子的坐标为
,则B原子的坐标为
您最近一年使用:0次
解题方法
6 . 钛合金是以钛元素为基础加入其他元素组成的合金,因具有强度高、耐蚀性好、耐热性高等特点而被广泛用于各个领域。回答下列问题:
(1)已知 在通常情况下是无色液体,熔点为-37℃,沸点为136℃,结构与
在通常情况下是无色液体,熔点为-37℃,沸点为136℃,结构与 相似。
相似。 的晶体类型是
的晶体类型是__________ 。 稳定性比
稳定性比 差,试从化学键角度分析原因
差,试从化学键角度分析原因__________ 。
(2)纳米 是一种应用广泛的催化剂,其催化作用的一个实例如下所示:
是一种应用广泛的催化剂,其催化作用的一个实例如下所示:

化合物乙的沸点明显高于化合物甲,主要原因是______________________________ 。
(3)配离子 中Ti的化合价为
中Ti的化合价为__________ ,配体为__________ 。
(4)金属钛(Ti)与氮形成的某种化合物常被用作高温结构材料和超导材料。研究表明,用Al代替其中部分的Ti可提升耐磨性5倍以上,掺杂Al后的晶胞结构如图所示。已知该晶体属立方晶系,阿佛加德罗常数的值为 。回答下列问题:
。回答下列问题:

①b点原子的分数坐标为__________ 。
②掺杂Al后,晶体中
__________ 。
③已知最近的两个N原子之间的距离为cnm,则氮化钛晶体的密度为__________ 
(1)已知
 在通常情况下是无色液体,熔点为-37℃,沸点为136℃,结构与
在通常情况下是无色液体,熔点为-37℃,沸点为136℃,结构与 相似。
相似。 的晶体类型是
的晶体类型是 稳定性比
稳定性比 差,试从化学键角度分析原因
差,试从化学键角度分析原因(2)纳米
 是一种应用广泛的催化剂,其催化作用的一个实例如下所示:
是一种应用广泛的催化剂,其催化作用的一个实例如下所示:
化合物乙的沸点明显高于化合物甲,主要原因是
(3)配离子
 中Ti的化合价为
中Ti的化合价为(4)金属钛(Ti)与氮形成的某种化合物常被用作高温结构材料和超导材料。研究表明,用Al代替其中部分的Ti可提升耐磨性5倍以上,掺杂Al后的晶胞结构如图所示。已知该晶体属立方晶系,阿佛加德罗常数的值为
 。回答下列问题:
。回答下列问题:
①b点原子的分数坐标为
②掺杂Al后,晶体中

③已知最近的两个N原子之间的距离为cnm,则氮化钛晶体的密度为

您最近一年使用:0次
解题方法
7 . 硫代硫酸钠(Na2S2O3)是常见的分析试剂和还原剂,常温下为无色晶体,易溶于水,遇酸反应。某学习小组在实验室制备Na2S2O3并探究其性质。回答下列问题:
实验I:利用高温加热绿矾(FeSO4•7H2O)生成的SO2气体制备Na2S2O3的实验装置如图所示。

已知:i.2FeSO4•7H2O Fe2O3+SO2↑+SO3↑+14H2O↑;
Fe2O3+SO2↑+SO3↑+14H2O↑;
ii.2Na2S+2Na2CO3+4SO2+H2O=3Na2S2O3+2NaHCO3;
iii.Na2S和Na2CO3的混合溶液用煮沸过的蒸馏水配制。

(1)依据FeSO4•7H2O的结构示意图
①比较键角H2O_____ SO (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②FeSO4•7H2O晶体中含有的化学键为_____ (填标号)。
a.离子键 b.共价键 c.氢键 d.配位键
(2)实验过程的操作步骤包括:
a.检查装置气密性,加入药品
b.在m处连接盛有NaOH溶液的容器,关闭活塞K3,打开活塞K1、K2通入一段时间N2
c.打开活塞K1、K2,关闭活塞K3,通入一段时间N2
d.C装置溶液pH约为8时停止加热
e.关闭活塞K1、K2,打开活塞K3,加热绿矾
f.将锥形瓶中溶液进行一系列操作,得到纯净的Na2S2O3晶体
①以上步骤按先后顺序的正确排序为a→______ →f(填标号)。
②B装置中使用冰水浴的作用是_____ 。
③C装置溶液pH约为8时停止加热的原因是_____ 。
实验Ⅱ:探究Na2S2O3的性质
小组同学查阅资料获得信息:Na2S2O3中硫元素的化合价分别为-2价和+6价。
实验步骤:用实验I获得的Na2S2O3晶体配制0.2mol/LNa2S2O3溶液,取出4mL,向溶液中加入1mL饱和氯水(pH=2.4),溶液立即出现浑浊,对溶液出现浑浊的原因提出假设。
假设1:氯水中Cl2氧化了Na2S2O3中的-2价硫生成S单质
假设2:Na2S2O3在酸性(H+)条件下反应生成S单质
(3)实验验证:a、b试管均盛有4mL0.2mol/LNa2S2O3溶液,操作如图所示。

①向试管b中滴加的试剂应为______ 。
②依据现象分析,出现浑浊的主要原因是_____ (用离子方程式表示)。
实验I:利用高温加热绿矾(FeSO4•7H2O)生成的SO2气体制备Na2S2O3的实验装置如图所示。

已知:i.2FeSO4•7H2O
 Fe2O3+SO2↑+SO3↑+14H2O↑;
Fe2O3+SO2↑+SO3↑+14H2O↑;ii.2Na2S+2Na2CO3+4SO2+H2O=3Na2S2O3+2NaHCO3;
iii.Na2S和Na2CO3的混合溶液用煮沸过的蒸馏水配制。

(1)依据FeSO4•7H2O的结构示意图
①比较键角H2O
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②FeSO4•7H2O晶体中含有的化学键为
a.离子键 b.共价键 c.氢键 d.配位键
(2)实验过程的操作步骤包括:
a.检查装置气密性,加入药品
b.在m处连接盛有NaOH溶液的容器,关闭活塞K3,打开活塞K1、K2通入一段时间N2
c.打开活塞K1、K2,关闭活塞K3,通入一段时间N2
d.C装置溶液pH约为8时停止加热
e.关闭活塞K1、K2,打开活塞K3,加热绿矾
f.将锥形瓶中溶液进行一系列操作,得到纯净的Na2S2O3晶体
①以上步骤按先后顺序的正确排序为a→
②B装置中使用冰水浴的作用是
③C装置溶液pH约为8时停止加热的原因是
实验Ⅱ:探究Na2S2O3的性质
小组同学查阅资料获得信息:Na2S2O3中硫元素的化合价分别为-2价和+6价。
实验步骤:用实验I获得的Na2S2O3晶体配制0.2mol/LNa2S2O3溶液,取出4mL,向溶液中加入1mL饱和氯水(pH=2.4),溶液立即出现浑浊,对溶液出现浑浊的原因提出假设。
假设1:氯水中Cl2氧化了Na2S2O3中的-2价硫生成S单质
假设2:Na2S2O3在酸性(H+)条件下反应生成S单质
(3)实验验证:a、b试管均盛有4mL0.2mol/LNa2S2O3溶液,操作如图所示。

①向试管b中滴加的试剂应为
②依据现象分析,出现浑浊的主要原因是
您最近一年使用:0次
解题方法
8 . 硅和碳及其化合物多是新型无机非金属材料。
(1)金刚石属于_______ 晶体, 属于
属于_______ 晶体,石墨属于_______ 晶体,它们都是碳元素的_______ 。
(2)石墨烯是只由一层碳原子所构成的平面薄膜,富勒烯以 为代表,结构如下图。
为代表,结构如下图。
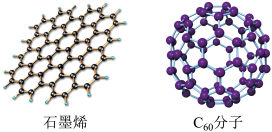
从石墨中剥离得到石墨烯需克服的作用是_______ ;在石墨烯中,每个六元环占有_______ 个C原子。1mol  分子中σ键数为
分子中σ键数为_______ (用 表示)。
表示)。
(3)碳化硅(化学式:SiC)与晶体硅(化学式:Si)和金刚石(化学式:C)相比较,三者熔点从高到低的顺序(用化学式和“>”表示):_______ 。
(4)氮化硅是一种高温陶瓷材料,已知氮化硅的晶体结构中,原子间都以单键相连,且N原子和N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子稳定结构,请写出氮化硅的化学式:_______ 。
(5)已知化学键的键能数据如下表:
已知反应热:△H=反应物的总键能之和-生成物的总键能之和。则反应 )的△H=
)的△H=_______ kJ/mol。
(1)金刚石属于
 属于
属于(2)石墨烯是只由一层碳原子所构成的平面薄膜,富勒烯以
 为代表,结构如下图。
为代表,结构如下图。
从石墨中剥离得到石墨烯需克服的作用是
 分子中σ键数为
分子中σ键数为 表示)。
表示)。(3)碳化硅(化学式:SiC)与晶体硅(化学式:Si)和金刚石(化学式:C)相比较,三者熔点从高到低的顺序(用化学式和“>”表示):
(4)氮化硅是一种高温陶瓷材料,已知氮化硅的晶体结构中,原子间都以单键相连,且N原子和N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子稳定结构,请写出氮化硅的化学式:
(5)已知化学键的键能数据如下表:
| 化学键 | Si-Cl | H-H | H-Cl | Si-Si |
| 键能kJ/mol | 360 | 436 | 431 | 176 |
 )的△H=
)的△H=
您最近一年使用:0次
名校
解题方法
9 . X、Y、Z、M、Q、R是元素周期表前四周期的元素,且原子序数依次增大,其相关信息如表所示:
(1)写出元素Q的基态原子的外围电子轨道表示式是 _______ 。
(2)X、Y、Z三种元素的电负性小到大的顺序是_______ (用元素符号表示)。
(3)M元素基态原子中能量最高的电子的电子云在空间有_______ 个伸展方向,原子轨道呈_______ 形。
(4)小范同学写了某基态原子的两个价电子的表达式,分析其分别违背了什么原理:
① :
:_______ ;
②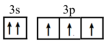 :
:_______ 。
(5)在XH3及ZH3两种分子中,键角XH3_______ MH3(添“>”或“<”) 原因是_______ 。
| 元素 | 相关信息 |
| X | 原子核外有7种不同运动状态的电子 |
| Y | 基态原子中最高能级上有两个未成对电子 |
| Z | 形成的气态氢化物空间构型为三角锥形 |
| M | 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反 |
| Q | 前4周期元素原子核外电子排布中未成对电子数最多的元素 |
| R | 基态原子核外有7个能级上有电子且能量最高的能级上有6个电子 |
(2)X、Y、Z三种元素的电负性小到大的顺序是
(3)M元素基态原子中能量最高的电子的电子云在空间有
(4)小范同学写了某基态原子的两个价电子的表达式,分析其分别违背了什么原理:
①
 :
:②
 :
:(5)在XH3及ZH3两种分子中,键角XH3
您最近一年使用:0次
10 . 含氮、磷的化合物在生活和生产中有许多重要用途,如 、磷化硼
、磷化硼 、磷青铜
、磷青铜 等.回答下列问题:
等.回答下列问题:
(1)铜 是第四周期元素,基态铜原子的价层电子轨道表示式为
是第四周期元素,基态铜原子的价层电子轨道表示式为_______ ;第四周期元素的基态原子中价层电子未成对最多的是_______ (填元素符号)
(2)键角
_______  (填“>、<、=”);化合物
(填“>、<、=”);化合物 能溶于水,其原因
能溶于水,其原因_______
(3)磷化硼是一种耐磨涂料,它可用作金属的表面保护层.磷化硼晶体晶胞如图所示:

①磷原子的配位数(与磷原子距离最近且相等的硼原子数)为_______
②已知原子坐标: 为
为 ,
, 为
为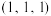 ,则图中B原子的坐标是
,则图中B原子的坐标是_______
③已知晶胞的密度为 ,阿伏加德罗常数的数值用
,阿伏加德罗常数的数值用 表示。则磷化硼晶体的晶胞边长为
表示。则磷化硼晶体的晶胞边长为_______ pm(列出计算式)
 、磷化硼
、磷化硼 、磷青铜
、磷青铜 等.回答下列问题:
等.回答下列问题:(1)铜
 是第四周期元素,基态铜原子的价层电子轨道表示式为
是第四周期元素,基态铜原子的价层电子轨道表示式为(2)键角

 (填“>、<、=”);化合物
(填“>、<、=”);化合物 能溶于水,其原因
能溶于水,其原因(3)磷化硼是一种耐磨涂料,它可用作金属的表面保护层.磷化硼晶体晶胞如图所示:

①磷原子的配位数(与磷原子距离最近且相等的硼原子数)为
②已知原子坐标:
 为
为 ,
, 为
为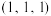 ,则图中B原子的坐标是
,则图中B原子的坐标是③已知晶胞的密度为
 ,阿伏加德罗常数的数值用
,阿伏加德罗常数的数值用 表示。则磷化硼晶体的晶胞边长为
表示。则磷化硼晶体的晶胞边长为
您最近一年使用:0次



