名校
解题方法
1 . Ⅰ.8−羟基喹啉( )被广泛用作
)被广泛用作 等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
(1)8−羟基喹啉的熔点明显低于7−羟基喹啉(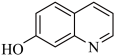 )、6−羟基喹啉(
)、6−羟基喹啉(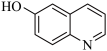 )的熔点的原因是
)的熔点的原因是___________ 。
(2) 不能形成类似
不能形成类似 分子中的
分子中的 键,原因是
键,原因是___________ 。
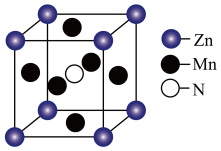
(3)某种含 特殊材料的晶胞结构如图所示,若该晶体的密度为
特殊材料的晶胞结构如图所示,若该晶体的密度为 ,则晶体中相邻N之间的最短距离为
,则晶体中相邻N之间的最短距离为___________  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
Ⅱ. 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。

(4)与 距离最近且相等的
距离最近且相等的 有
有___________ 个,与 距离最近且相等的F-有
距离最近且相等的F-有___________ 个。
(5) 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积
___________  。(
。( )
)
(6)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。
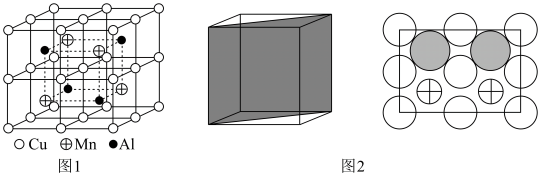
将Cu-Mn-Al合金晶胞沿棱投影于垂直面的是___________。(填字母序号)
(7)一种类石墨的聚合物g﹣C3N4可由三聚氰胺制得。三聚氰胺分子不溶于冷水,溶于热水,主要原因是___________ 。
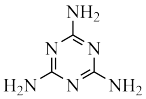
 )被广泛用作
)被广泛用作 等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:(1)8−羟基喹啉的熔点明显低于7−羟基喹啉(
 )、6−羟基喹啉(
)、6−羟基喹啉( )的熔点的原因是
)的熔点的原因是(2)
 不能形成类似
不能形成类似 分子中的
分子中的 键,原因是
键,原因是(3)某种含
 特殊材料的晶胞结构如图所示,若该晶体的密度为
特殊材料的晶胞结构如图所示,若该晶体的密度为 ,则晶体中相邻N之间的最短距离为
,则晶体中相邻N之间的最短距离为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
Ⅱ.
 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。
(4)与
 距离最近且相等的
距离最近且相等的 有
有 距离最近且相等的F-有
距离最近且相等的F-有(5)
 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积
 。(
。( )
)(6)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。

将Cu-Mn-Al合金晶胞沿棱投影于垂直面的是___________。(填字母序号)
A.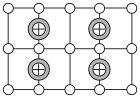 | B.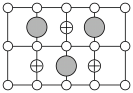 |
C. | D.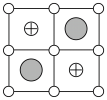 |
(7)一种类石墨的聚合物g﹣C3N4可由三聚氰胺制得。三聚氰胺分子不溶于冷水,溶于热水,主要原因是

您最近一年使用:0次
名校
解题方法
2 . 氮元素可形成丰富的化合物,在生产生活中具有广泛用途。
(1) 是一种重要的化工原料,以
是一种重要的化工原料,以 合成
合成 ,常用
,常用 作催化剂。基态
作催化剂。基态 原子和基态
原子和基态 中未成对电子数之比为
中未成对电子数之比为_____ ;从轨道重叠方式的角度分析 的成键,
的成键, 分子中氮原子的
分子中氮原子的_____ 轨道与氢原子的 轨道重叠形成
轨道重叠形成 键。
键。
(2) 是中学化学常见微粒,键角:
是中学化学常见微粒,键角:
_____ (填“>”或“<”) 。
。
(3) (氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
① 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是_____
②比较沸点:
_____ (填“>”或“<”,下同) ,水溶性:
,水溶性:
_____  。
。
(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
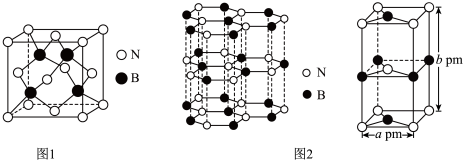
 —射线衍射实验测得立方氮化硼晶胞边长为
—射线衍射实验测得立方氮化硼晶胞边长为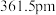 ,则立方氮化硼晶体中硼氮键的键长为
,则立方氮化硼晶体中硼氮键的键长为_____ (只列计算式) 。已知六方氮化硼密度为
。已知六方氮化硼密度为 ,底面角分别为
,底面角分别为 和
和 ,设
,设 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则
_____ (列含a、b、d的计算式即可)
(1)
 是一种重要的化工原料,以
是一种重要的化工原料,以 合成
合成 ,常用
,常用 作催化剂。基态
作催化剂。基态 原子和基态
原子和基态 中未成对电子数之比为
中未成对电子数之比为 的成键,
的成键, 分子中氮原子的
分子中氮原子的 轨道重叠形成
轨道重叠形成 键。
键。(2)
 是中学化学常见微粒,键角:
是中学化学常见微粒,键角:
 。
。(3)
 (氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。①
 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是②比较沸点:

 ,水溶性:
,水溶性:
 。
。(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

 —射线衍射实验测得立方氮化硼晶胞边长为
—射线衍射实验测得立方氮化硼晶胞边长为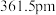 ,则立方氮化硼晶体中硼氮键的键长为
,则立方氮化硼晶体中硼氮键的键长为 。已知六方氮化硼密度为
。已知六方氮化硼密度为 ,底面角分别为
,底面角分别为 和
和 ,设
,设 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则
您最近一年使用:0次
2024-04-02更新
|
444次组卷
|
3卷引用:辽宁省沈阳市东北育才学校高中部2023-2024学年高二下学期第1次月考化学试题
名校
解题方法
3 . 锂离子电池的开发与应用是新能源汽车走向实用的关键。
(1)LiFePO4是新型锂离子电池的正极材料,基态铁原子的价层电子排布图为___________ 。LiFePO4的结构如图A所示,锂离子电池充放电过程伴随A和B相互转化,则A→B为___________ 过程(填“充电”或“放电”)。 )。
)。
① 的键角
的键角___________ (填“等于”大于”或“小于”) 的键角。
的键角。 的VSEPR模型为
的VSEPR模型为___________ 。
②Htrz分子为平面结构,N原子的杂化轨道类型为___________ ,连接氢原子的氮原子在形成Htrz分子中的大π键时提供的电子数是___________ 。
(3)Be和B的第一电离能I1(Be)>I1(B)的原因是___________ 。
(4)LiAsF6、LiPF6、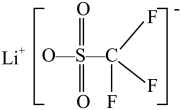 等物质常用作电池电解液的溶质,HOSO2CF3和HOSO2CH3在水溶液中酸性较强的是HOSO2CF3,理由是
等物质常用作电池电解液的溶质,HOSO2CF3和HOSO2CH3在水溶液中酸性较强的是HOSO2CF3,理由是___________ 。
(1)LiFePO4是新型锂离子电池的正极材料,基态铁原子的价层电子排布图为
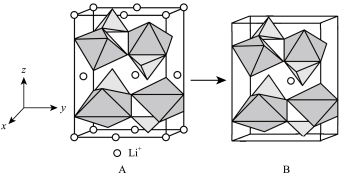
 )。
)。①
 的键角
的键角 的键角。
的键角。 的VSEPR模型为
的VSEPR模型为②Htrz分子为平面结构,N原子的杂化轨道类型为
(3)Be和B的第一电离能I1(Be)>I1(B)的原因是
(4)LiAsF6、LiPF6、
 等物质常用作电池电解液的溶质,HOSO2CF3和HOSO2CH3在水溶液中酸性较强的是HOSO2CF3,理由是
等物质常用作电池电解液的溶质,HOSO2CF3和HOSO2CH3在水溶液中酸性较强的是HOSO2CF3,理由是
您最近一年使用:0次
2024-03-16更新
|
295次组卷
|
2卷引用:河北省石家庄二中教育集团2023-2024学年高二年级上学期期末考试化学试题
23-24高二下·全国·课前预习
解题方法
4 . 苯的分子结构
(1)分子式为_______ ,结构简式为 和
和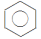 ,为
,为_______ 结构。
(2)化学键形成
苯分子中的6个碳原子均采取_______ 杂化,分别与氢原子及相邻碳原子以_______ 键结合,键间夹角均为120°,连接成六元环。每个碳碳键的键长相等,都是139 pm,介于______ 和______ 的键长之间。每个碳原子余下的_______ 轨道垂直于碳、氢原子构成的平面,相互平行重叠形成大_______ 键,均匀地对称分布在苯环平面的上下两侧。
(1)分子式为
 和
和 ,为
,为(2)化学键形成
苯分子中的6个碳原子均采取
您最近一年使用:0次
名校
解题方法
5 . I.分子人工光合作用的光捕获原理如图所示,WOC1是水氧化催化剂WOC在水氧化过程中产生的中间体,HEC1是析氢催化剂HEC在析氢过程中产生的中间体。
(1)下列状态的铁中,电离最外层一个电子所需能量最大的是______ (填标号)。_____ mol。
(3)NO 的VSEPR模型为
的VSEPR模型为_______ ,比较NO 、NO
、NO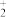 键角的大小:NO
键角的大小:NO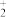
_______  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。_____ molSi-O键。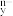 ,其可能结构如图所示,则该硅酸根化学式为
,其可能结构如图所示,则该硅酸根化学式为_______ 。
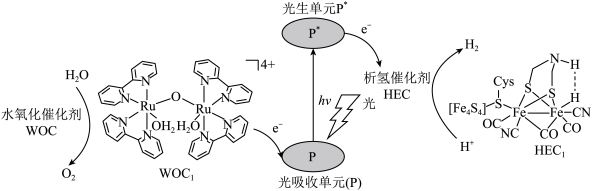
(1)下列状态的铁中,电离最外层一个电子所需能量最大的是
a.[Ar]  b.[Ar]
b.[Ar] 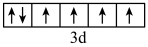
c.[Ar]  d.[Ar]
d.[Ar] 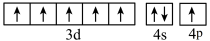
(3)NO
 的VSEPR模型为
的VSEPR模型为 、NO
、NO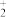 键角的大小:NO
键角的大小:NO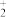
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。Ⅱ.硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元,硅氧四面体可以表示成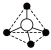 ,其中
,其中 表示氧原子,中心
表示氧原子,中心 表示硅原子,其俯视图为
表示硅原子,其俯视图为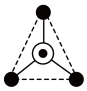 。
。

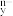 ,其可能结构如图所示,则该硅酸根化学式为
,其可能结构如图所示,则该硅酸根化学式为 
您最近一年使用:0次
2024-02-27更新
|
221次组卷
|
2卷引用:河北省石家庄市第二十四中学2023-2024高二上学期期末考试化学试题
名校
解题方法
6 . 物质的组成和结构决定了物质的性质和变化。HClO4-NaClO4介质中,K5[Co3+O4W12O36](简记为Co3+W)催化氧化NH2OH的过程如下:
(1)Co3+基态核外电子排布式为___________ ;ClO 的空间构型的名称为
的空间构型的名称为___________ 。
(2)NH2OH分子中氮原子轨道的杂化类型是___________ 。
(3)N、H、O三种元素的电负性由小到大 的顺序为___________ 。
(4)H2O中O-H键角比H3O+中的小,说明孤电子对的排斥力比σ键电子对___________ ;O3和H2O的空间构型相似,正电荷中心与负电荷中心不重合,推测在H2O中的溶解度,O3比O2___________ 。(以上均选填“大”或“小”)
(5)Fe和Mn的气态基态原子逐级电离能(kJ·mol-1)数据如下:
造成I3(Mn)>I3(Fe)可能的原因是___________ 。

(1)Co3+基态核外电子排布式为
 的空间构型的名称为
的空间构型的名称为(2)NH2OH分子中氮原子轨道的杂化类型是
(3)N、H、O三种元素的电负性由
(4)H2O中O-H键角比H3O+中的小,说明孤电子对的排斥力比σ键电子对
(5)Fe和Mn的气态基态原子逐级电离能(kJ·mol-1)数据如下:
| I1 | I2 | I3 | I4 | I5 | |
| Fe | 762 | 1562 | 2957 | 5290 | 7240 |
| Mn | 717 | 1509 | 3248 | 4940 | 6990 |
您最近一年使用:0次
2023-12-26更新
|
219次组卷
|
3卷引用:四川省泸州市泸县第一中学2023-2024学年高二上学期1月期末化学试题
7 . 卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1)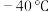 时,
时, 与冰反应生成
与冰反应生成 和
和 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为_____ , 水解反应的产物为
水解反应的产物为_____ (填化学式)。
(2) 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键
键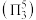 。
。 中
中 原子的轨道杂化方式
原子的轨道杂化方式_____ ;为 键角
键角_____  键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因_____ 。
(3)一定条件下, 和
和 反应生成
反应生成 和化合物
和化合物 。已知
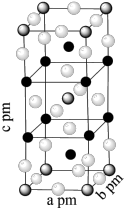
。已知 属于四方晶系,晶胞结构如图所示(晶胞参数
属于四方晶系,晶胞结构如图所示(晶胞参数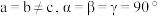 ),其中
),其中 化合价为
化合价为 。上述反应的化学方程式为
。上述反应的化学方程式为_____ 。若阿伏伽德罗常数的值为 ,化合物
,化合物 的密度
的密度
_____  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)
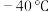 时,
时, 与冰反应生成
与冰反应生成 和
和 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为 水解反应的产物为
水解反应的产物为(2)
 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键
键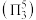 。
。 中
中 原子的轨道杂化方式
原子的轨道杂化方式 键角
键角 键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因(3)一定条件下,
 和
和 反应生成
反应生成 和化合物
和化合物 。已知
。已知 属于四方晶系,晶胞结构如图所示(晶胞参数
属于四方晶系,晶胞结构如图所示(晶胞参数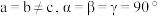 ),其中
),其中 化合价为
化合价为 。上述反应的化学方程式为
。上述反应的化学方程式为 ,化合物
,化合物 的密度
的密度
 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2023-06-19更新
|
10413次组卷
|
10卷引用:专题20 结构与性质
(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)第11讲 氯气和卤族元素(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)(已下线)第20讲化学键(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用) 河南省南阳市第一中学校2024届高三上学期阶段检测化学试题(12月)2023年高考山东卷化学真题(已下线)2023年高考山东卷化学真题变式题(结构与性质)
8 . 超纯 是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯
是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯 方面取得了显著成果,工业上以粗镓为原料,制备超纯
方面取得了显著成果,工业上以粗镓为原料,制备超纯 的工艺流程如下:
的工艺流程如下: 的化学性质和
的化学性质和 相似,
相似, 的熔点为
的熔点为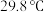 ;
;
② (乙醚)和
(乙醚)和 (三正辛胺)在上述流程中可作为配体;
(三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
回答下列问题:
(1)晶体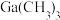 的晶体类型是
的晶体类型是_______ ;
(2)“电解精炼”装置如图所示,电解池温度控制在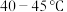 的原因是
的原因是_______ ,阴极的电极反应式为_______ ;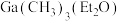 ”工序中的产物还包括
”工序中的产物还包括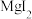 和
和 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_______ ;
(4)“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是_______ ;
(5)下列说法错误的是_______;
(6)直接分解 不能制备超纯
不能制备超纯 ,而本流程采用“配体交换”工艺制备超纯
,而本流程采用“配体交换”工艺制备超纯 的理由是
的理由是_______ ;
(7)比较分子中的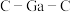 键角大小:
键角大小:
_______  (填“>”“<”或“=”),其原因是
(填“>”“<”或“=”),其原因是_______ 。
 是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯
是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯 方面取得了显著成果,工业上以粗镓为原料,制备超纯
方面取得了显著成果,工业上以粗镓为原料,制备超纯 的工艺流程如下:
的工艺流程如下: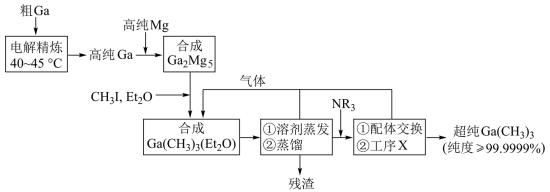
 的化学性质和
的化学性质和 相似,
相似, 的熔点为
的熔点为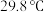 ;
;②
 (乙醚)和
(乙醚)和 (三正辛胺)在上述流程中可作为配体;
(三正辛胺)在上述流程中可作为配体;③相关物质的沸点:
| 物质 | 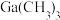 |  | 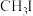 | 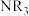 |
沸点/ | 55.7 | 34.6 | 42.4 | 365.8 |
(1)晶体
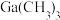 的晶体类型是
的晶体类型是(2)“电解精炼”装置如图所示,电解池温度控制在
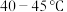 的原因是
的原因是
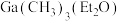 ”工序中的产物还包括
”工序中的产物还包括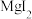 和
和 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(4)“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是
(5)下列说法错误的是_______;
A.流程中 得到了循环利用 得到了循环利用 |
B.流程中,“合成 ”至“工序X”需在无水无氧的条件下进行 ”至“工序X”需在无水无氧的条件下进行 |
C.“工序X”的作用是解配 ,并蒸出 ,并蒸出 |
D.用核磁共振氢谱不能区分 和 和 |
 不能制备超纯
不能制备超纯 ,而本流程采用“配体交换”工艺制备超纯
,而本流程采用“配体交换”工艺制备超纯 的理由是
的理由是(7)比较分子中的
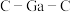 键角大小:
键角大小:
 (填“>”“<”或“=”),其原因是
(填“>”“<”或“=”),其原因是
您最近一年使用:0次
2023-06-16更新
|
10008次组卷
|
11卷引用:专题18 工艺流程题
(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)题型四 无机化工流程题解题策略-备战2024年高考化学答题技巧与模板构建2023年高考湖南卷化学真题(已下线)2023年湖南卷高考真题变式题(工业流程题)福建省厦门市 第一中学2023-2024上学期高三上学期12月考化学试题福建省漳州市华安县第一中学2023-2024学年高三上学期12月月考化学试题
9 . 聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。
Ⅰ.苯乙烯的制备
(1)已知下列反应的热化学方程式:
①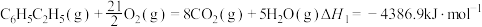
②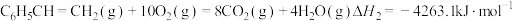
③
计算反应④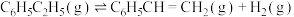 的
的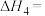
_______  ;
;
(2)在某温度、 下,向反应器中充入
下,向反应器中充入 气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入
气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入_______  水蒸气作为稀释气(计算时忽略副反应);
水蒸气作为稀释气(计算时忽略副反应);
(3)在 、
、 下,以水蒸气作稀释气。
下,以水蒸气作稀释气。 作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
⑤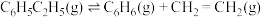
⑥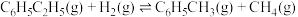
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S( )随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是
)随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是_______ ,理由是_______ ; 的描述错误的是_______;
的描述错误的是_______;
Ⅱ.苯乙烯的聚合
苯乙烯聚合有多种方法,其中一种方法的关键步骤是某 (Ⅰ)的配合物促进
(Ⅰ)的配合物促进 (引发剂,X表示卤素)生成自由基
(引发剂,X表示卤素)生成自由基 ,实现苯乙烯可控聚合。
,实现苯乙烯可控聚合。
(5)引发剂 中活性最高的是
中活性最高的是_______ ;
(6)室温下,① 在配体L的水溶液中形成
在配体L的水溶液中形成 ,其反应平衡常数为K;②
,其反应平衡常数为K;② 在水中的溶度积常数为
在水中的溶度积常数为 。由此可知,
。由此可知, 在配体L的水溶液中溶解反应的平衡常数为
在配体L的水溶液中溶解反应的平衡常数为_______ (所有方程式中计量系数关系均为最简整数比)。
Ⅰ.苯乙烯的制备
(1)已知下列反应的热化学方程式:
①
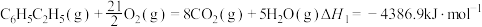
②
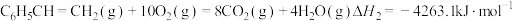
③

计算反应④
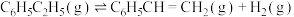 的
的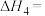
 ;
;(2)在某温度、
 下,向反应器中充入
下,向反应器中充入 气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入
气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入 水蒸气作为稀释气(计算时忽略副反应);
水蒸气作为稀释气(计算时忽略副反应);(3)在
 、
、 下,以水蒸气作稀释气。
下,以水蒸气作稀释气。 作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:⑤
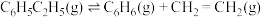
⑥
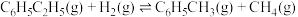
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S(
 )随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是
)随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是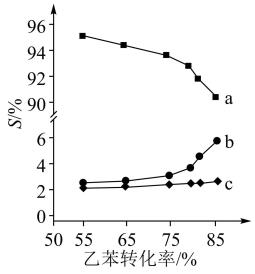
 的描述错误的是_______;
的描述错误的是_______;A.X射线衍射技术可测定 晶体结构 晶体结构 |
B. 可改变乙苯平衡转化率 可改变乙苯平衡转化率 |
C. 降低了乙苯脱氢反应的活化能 降低了乙苯脱氢反应的活化能 |
D.改变 颗粒大小不影响反应速率 颗粒大小不影响反应速率 |
Ⅱ.苯乙烯的聚合
苯乙烯聚合有多种方法,其中一种方法的关键步骤是某
 (Ⅰ)的配合物促进
(Ⅰ)的配合物促进 (引发剂,X表示卤素)生成自由基
(引发剂,X表示卤素)生成自由基 ,实现苯乙烯可控聚合。
,实现苯乙烯可控聚合。(5)引发剂
 中活性最高的是
中活性最高的是(6)室温下,①
 在配体L的水溶液中形成
在配体L的水溶液中形成 ,其反应平衡常数为K;②
,其反应平衡常数为K;② 在水中的溶度积常数为
在水中的溶度积常数为 。由此可知,
。由此可知, 在配体L的水溶液中溶解反应的平衡常数为
在配体L的水溶液中溶解反应的平衡常数为
您最近一年使用:0次
2023-06-16更新
|
7558次组卷
|
9卷引用:专题17 原理综合题
(已下线)专题17 原理综合题(已下线)专题14 化学反应原理综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题15 化学反应原理综合题-2023年高考化学真题题源解密(全国通用)湖南省长沙市麓山国际实验学校2023-2024学年高三上学期第一次月考化学试题2023年高考湖南卷化学真题(已下线)2023年湖南卷高考真题变式题(原理综合题) 浙江省义乌中学2024届高三上学期首考适应性考试化学试题湖北省沙市中学2023-2024学年高三下学期3月月考化学试题(已下线)压轴题13 化学反应原理综合题(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
名校
解题方法
10 . 硒-钴-镧(La)三元整流剂在导电玻璃中应用广泛。回答下列问题:
(1)元素硒的两种微粒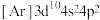 电离1个电子所需最低能量
电离1个电子所需最低能量___________ (填“>”“<”或“=”,下同)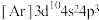 ,
, 的键角
的键角___________  的键角;硒的两种酸的酸性强弱为
的键角;硒的两种酸的酸性强弱为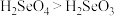 ,原因是
,原因是___________ ;硒的某种氧化物为如图所示的链状聚合结构,该氧化物的化学式为___________ 。
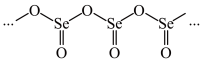
(2)二硒键和二硫键是重要的光响应动态共价键,其光响应原理可用图表示。
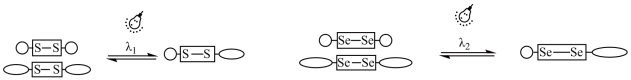
已知光的波长与键能成反比,则图中实现光响应的波长: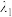
___________  (填“>”“<”或“=”),其原因是
(填“>”“<”或“=”),其原因是___________ 。
(3)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为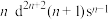 ,则Q为
,则Q为___________ (填元素符号)。该合金的晶胞结构和z轴方向的投影如图。
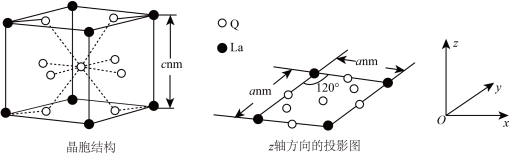
若阿伏加德罗常数的值为 ,则该合金的密度
,则该合金的密度
___________  (Q的相对原子质量用M表示,用含a、c、
(Q的相对原子质量用M表示,用含a、c、 、M的代数式表示,列出计算式即可)。
、M的代数式表示,列出计算式即可)。
(1)元素硒的两种微粒
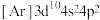 电离1个电子所需最低能量
电离1个电子所需最低能量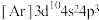 ,
, 的键角
的键角 的键角;硒的两种酸的酸性强弱为
的键角;硒的两种酸的酸性强弱为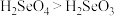 ,原因是
,原因是
(2)二硒键和二硫键是重要的光响应动态共价键,其光响应原理可用图表示。

已知光的波长与键能成反比,则图中实现光响应的波长:
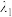
 (填“>”“<”或“=”),其原因是
(填“>”“<”或“=”),其原因是(3)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为
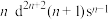 ,则Q为
,则Q为
若阿伏加德罗常数的值为
 ,则该合金的密度
,则该合金的密度
 (Q的相对原子质量用M表示,用含a、c、
(Q的相对原子质量用M表示,用含a、c、 、M的代数式表示,列出计算式即可)。
、M的代数式表示,列出计算式即可)。
您最近一年使用:0次



