解题方法
1 . 油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:
(1)已知下列反应的热化学方程式:
反应Ⅰ:
反应Ⅱ:
①反应Ⅲ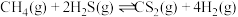 的
的
___________ 。
②反应Ⅱ自发的条件是___________ (填“低温”“高温”或“任何温度”)。
③ 和
和 三种分子的键角大小顺序为
三种分子的键角大小顺序为___________ 。
(2)投料比 ,并用
,并用 稀释:在
稀释:在 ,不同温度条件下反应相同时间后,测得
,不同温度条件下反应相同时间后,测得 和
和 体积分数如下表:
体积分数如下表:
①下列说法一定正确的是___________ (填标号)。
A.其他条件不变时,用 替代
替代 对实验结果几乎无影响
对实验结果几乎无影响
B.恒温恒压下,增加 的体积分数,
的体积分数, 的浓度升高
的浓度升高
C.由实验数据推出 中
中 键弱于
键弱于 中的
中的 键
键
D.由实验数据推出,温度越高, 的平衡转化率越高
的平衡转化率越高
②在 ,
, 下,保持通入
下,保持通入 的体积分数不变,提高投料比
的体积分数不变,提高投料比 的转化率不变,原因是
的转化率不变,原因是___________ 。
③已知反应过程中存在副反应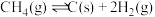 。研究发现,温度高于
。研究发现,温度高于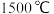 时继续升温,
时继续升温, 的转化率不会增大反而会降低的可能原因是
的转化率不会增大反而会降低的可能原因是___________ 。
(3)在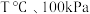 反应条件下,将
反应条件下,将 的混合气进行反应Ⅲ,达到平衡时,
的混合气进行反应Ⅲ,达到平衡时, 分压与
分压与 的分压相同。则反应Ⅲ的标准压强平衡常数
的分压相同。则反应Ⅲ的标准压强平衡常数
___________ 。(已知:分压=总压×该组分物质的量分数,对于反应 ,
, ,其中
,其中 ,
,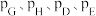 为各组分的平衡分压)。
为各组分的平衡分压)。
(1)已知下列反应的热化学方程式:
反应Ⅰ:

反应Ⅱ:

①反应Ⅲ
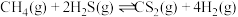 的
的
②反应Ⅱ自发的条件是
③
 和
和 三种分子的键角大小顺序为
三种分子的键角大小顺序为(2)投料比
 ,并用
,并用 稀释:在
稀释:在 ,不同温度条件下反应相同时间后,测得
,不同温度条件下反应相同时间后,测得 和
和 体积分数如下表:
体积分数如下表:| 温度/℃ | 950 | 1000 | 1050 | 1100 | 1150 |
 的体积分数/% 的体积分数/% | 0.5 | 1.5 | 3.6 | 5.5 | 8.5 |
 的体积分数/% 的体积分数/% | 0.0 | 0.0 | 0.1 | 0.4 | 1.8 |
A.其他条件不变时,用
 替代
替代 对实验结果几乎无影响
对实验结果几乎无影响B.恒温恒压下,增加
 的体积分数,
的体积分数, 的浓度升高
的浓度升高C.由实验数据推出
 中
中 键弱于
键弱于 中的
中的 键
键D.由实验数据推出,温度越高,
 的平衡转化率越高
的平衡转化率越高②在
 ,
, 下,保持通入
下,保持通入 的体积分数不变,提高投料比
的体积分数不变,提高投料比 的转化率不变,原因是
的转化率不变,原因是③已知反应过程中存在副反应
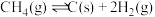 。研究发现,温度高于
。研究发现,温度高于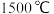 时继续升温,
时继续升温, 的转化率不会增大反而会降低的可能原因是
的转化率不会增大反而会降低的可能原因是(3)在
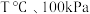 反应条件下,将
反应条件下,将 的混合气进行反应Ⅲ,达到平衡时,
的混合气进行反应Ⅲ,达到平衡时, 分压与
分压与 的分压相同。则反应Ⅲ的标准压强平衡常数
的分压相同。则反应Ⅲ的标准压强平衡常数
 ,
, ,其中
,其中 ,
,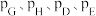 为各组分的平衡分压)。
为各组分的平衡分压)。
您最近一年使用:0次
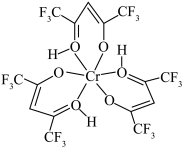
2 . 铬元素是哺乳类代谢过程中必须的微量元素,目前六氟代乙酰丙酮铬(Ⅲ)螯合物(其结构如图)的检出极限已达到3×10-12 g。回答下列问题:___________ ,H、C、O、F的电负性由大到小的顺序为___________ 。
(2)Cr3+的未成对电子数有______ 个,与Cr3+的未成对电子数相同且处于同周期的主族元素在周期表中的位置是____________ 。
(3)六氟代乙酰丙酮铬(Ⅲ)螯合物中含有的化学键有___________ 。
a.极性共价键 b.非极性共价键 c.离子键
(4)六氟代乙酰丙酮(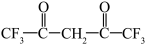 )中
)中 键有
键有______ 个。
(5)分子H2O、NH3、CH4中键角由大到小的顺序是_____________ 。
(2)Cr3+的未成对电子数有
(3)六氟代乙酰丙酮铬(Ⅲ)螯合物中含有的化学键有
a.极性共价键 b.非极性共价键 c.离子键
(4)六氟代乙酰丙酮(
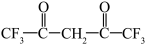 )中
)中 键有
键有(5)分子H2O、NH3、CH4中键角由大到小的顺序是
您最近一年使用:0次
名校
解题方法
3 . 物质的组成和结构决定了物质的性质和变化。HClO4-NaClO4介质中,K5[Co3+O4W12O36](简记为Co3+W)催化氧化NH2OH的过程如下:
(1)Co3+基态核外电子排布式为___________ ;ClO 的空间构型的名称为
的空间构型的名称为___________ 。
(2)NH2OH分子中氮原子轨道的杂化类型是___________ 。
(3)N、H、O三种元素的电负性由小到大 的顺序为___________ 。
(4)H2O中O-H键角比H3O+中的小,说明孤电子对的排斥力比σ键电子对___________ ;O3和H2O的空间构型相似,正电荷中心与负电荷中心不重合,推测在H2O中的溶解度,O3比O2___________ 。(以上均选填“大”或“小”)
(5)Fe和Mn的气态基态原子逐级电离能(kJ·mol-1)数据如下:
造成I3(Mn)>I3(Fe)可能的原因是___________ 。

(1)Co3+基态核外电子排布式为
 的空间构型的名称为
的空间构型的名称为(2)NH2OH分子中氮原子轨道的杂化类型是
(3)N、H、O三种元素的电负性由
(4)H2O中O-H键角比H3O+中的小,说明孤电子对的排斥力比σ键电子对
(5)Fe和Mn的气态基态原子逐级电离能(kJ·mol-1)数据如下:
| I1 | I2 | I3 | I4 | I5 | |
| Fe | 762 | 1562 | 2957 | 5290 | 7240 |
| Mn | 717 | 1509 | 3248 | 4940 | 6990 |
您最近一年使用:0次
2023-12-26更新
|
219次组卷
|
3卷引用:江苏省马坝高级中学2023-2024学年高三上学期期中考试化学试卷
解题方法
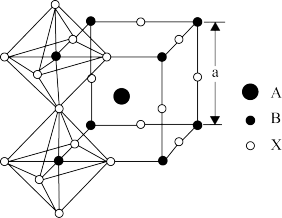
4 . 过渡金属( 等)在工业生产中有重要的作用,是化学工作者研究的对象。
等)在工业生产中有重要的作用,是化学工作者研究的对象。
(1)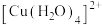 的结构示意图如图-1所示。
的结构示意图如图-1所示。

①基态 的核外电子排布式为
的核外电子排布式为___________ 。
②图中 与
与 之间形成的化学键称为
之间形成的化学键称为___________ 。
③ 能与
能与 结合成
结合成 ,
, 中的键角
中的键角_______  中的键角(填“>”、“<”或“=”)
中的键角(填“>”、“<”或“=”)
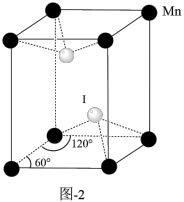
(2)锰元素能形成很多重要的化合物。
①锰与碘形成的某种化合物的晶胞结构如图-2所示,该化合物的化学式为___________ 。
② 能形成配合物
能形成配合物 ,其配离子的结构如图-3所示(配体位于顶点)。若
,其配离子的结构如图-3所示(配体位于顶点)。若 该配合物与足量
该配合物与足量 反应生成
反应生成 沉淀,则化学式中的n为
沉淀,则化学式中的n为___________ 。

③三醋酸锰由硝酸锰晶体和乙酸酐反应制得。乙酸酐[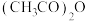 ]可由
]可由 在一定条件下脱水形成,其结构如图-4所示,
在一定条件下脱水形成,其结构如图-4所示, 乙酸酐中所含的
乙酸酐中所含的 键数目为
键数目为___________ 。已知羧酸是一大类含羧基( )的有机酸,其酸性强弱由羧基中的羟基的极性大小决定。请解释
)的有机酸,其酸性强弱由羧基中的羟基的极性大小决定。请解释 的酸性大于
的酸性大于 的原因:
的原因:___________ 。

 等)在工业生产中有重要的作用,是化学工作者研究的对象。
等)在工业生产中有重要的作用,是化学工作者研究的对象。(1)
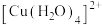 的结构示意图如图-1所示。
的结构示意图如图-1所示。
①基态
 的核外电子排布式为
的核外电子排布式为②图中
 与
与 之间形成的化学键称为
之间形成的化学键称为③
 能与
能与 结合成
结合成 ,
, 中的键角
中的键角 中的键角(填“>”、“<”或“=”)
中的键角(填“>”、“<”或“=”)(2)锰元素能形成很多重要的化合物。
①锰与碘形成的某种化合物的晶胞结构如图-2所示,该化合物的化学式为

②
 能形成配合物
能形成配合物 ,其配离子的结构如图-3所示(配体位于顶点)。若
,其配离子的结构如图-3所示(配体位于顶点)。若 该配合物与足量
该配合物与足量 反应生成
反应生成 沉淀,则化学式中的n为
沉淀,则化学式中的n为
③三醋酸锰由硝酸锰晶体和乙酸酐反应制得。乙酸酐[
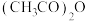 ]可由
]可由 在一定条件下脱水形成,其结构如图-4所示,
在一定条件下脱水形成,其结构如图-4所示, 乙酸酐中所含的
乙酸酐中所含的 键数目为
键数目为 )的有机酸,其酸性强弱由羧基中的羟基的极性大小决定。请解释
)的有机酸,其酸性强弱由羧基中的羟基的极性大小决定。请解释 的酸性大于
的酸性大于 的原因:
的原因:
您最近一年使用:0次
名校
解题方法
5 . 铜是人类最早使用的金属之一,铜的化合物丰富多彩。
(1)Cu在周期表中位于___________ 区,Cu2+价电子排布式为___________ 。
(2)邻氨基吡啶(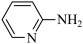 )的铜配合物在有机合成中有重要作用。C、N、O的第一电离能由大到小的顺序为
)的铜配合物在有机合成中有重要作用。C、N、O的第一电离能由大到小的顺序为___________ ;1mol 中σ键的数目为
中σ键的数目为___________ 。邻氨基吡啶的铜配合物结构简式如下图所示,C原子轨道杂化类型为___________ 。
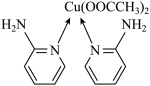
(3)向CuSO4溶液中加入过量氨水再加少许乙醇可以析出蓝色晶体[Cu(NH3)4]SO4∙H2O。
①NH3分子中H-N-H键角为107°,在[Cu(NH3)4]2+中H-N-H键角近似109.5°,键角变大的原因是___________ 。
②NF3与NH3均为三角锥形分子,NF3分子中的氮原子不易与Cu2+形成配离子,请从电负性角度分析其原因是___________ 。
(1)Cu在周期表中位于
(2)邻氨基吡啶(
 )的铜配合物在有机合成中有重要作用。C、N、O的第一电离能由大到小的顺序为
)的铜配合物在有机合成中有重要作用。C、N、O的第一电离能由大到小的顺序为 中σ键的数目为
中σ键的数目为
(3)向CuSO4溶液中加入过量氨水再加少许乙醇可以析出蓝色晶体[Cu(NH3)4]SO4∙H2O。
①NH3分子中H-N-H键角为107°,在[Cu(NH3)4]2+中H-N-H键角近似109.5°,键角变大的原因是
②NF3与NH3均为三角锥形分子,NF3分子中的氮原子不易与Cu2+形成配离子,请从电负性角度分析其原因是
您最近一年使用:0次
2023-07-05更新
|
186次组卷
|
2卷引用:江苏省泰州中学2022-2023学年高一下学期期末考试化学试题
解题方法
6 . 利用绿矾 和硫铁矿
和硫铁矿 可联合制备铁精粉
可联合制备铁精粉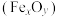 和硫酸。
和硫酸。
(1) 的结构示意图如图所示。
的结构示意图如图所示。

①基态O原子的价电子中,两种自旋状态的电子数之比为_____ 。
② 中O原子和
中O原子和 中S原子均为
中S原子均为 杂化。
杂化。
 分子中的
分子中的 键角
键角_____ (填“大于”、“等于”或“小于”)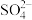 离子中
离子中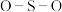 键角,其原因是
键角,其原因是_____ 。
③ 属于配位化合物。由结构示意图可知,
属于配位化合物。由结构示意图可知, 中
中 的配位数为
的配位数为_____ 。
(2) 晶体的晶胞形状为立方体,边长为
晶体的晶胞形状为立方体,边长为 ,结构如图所示。
,结构如图所示。

① 的电子式为
的电子式为_____ 。
② 晶体中
晶体中 位于
位于 形成的
形成的_____ (填“正四面体”或“正八面体”)空隙中。
③ 的摩尔质量为
的摩尔质量为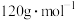 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。该晶体的密度为
。该晶体的密度为_____  。(列出算式即可,无需化简。
。(列出算式即可,无需化简。 )
)
(3) 加热脱水后生成
加热脱水后生成 ,再与
,再与 在氧气中掺烧可联合制备铁精粉和硫酸。
在氧气中掺烧可联合制备铁精粉和硫酸。 分解和
分解和 在氧气中燃烧的能量示意图如题图所示。从能源与资源综合利用角度分析,利用
在氧气中燃烧的能量示意图如题图所示。从能源与资源综合利用角度分析,利用 和
和 联合制备铁精粉和硫酸的优点是
联合制备铁精粉和硫酸的优点是_____ 。

 和硫铁矿
和硫铁矿 可联合制备铁精粉
可联合制备铁精粉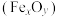 和硫酸。
和硫酸。(1)
 的结构示意图如图所示。
的结构示意图如图所示。
①基态O原子的价电子中,两种自旋状态的电子数之比为
②
 中O原子和
中O原子和 中S原子均为
中S原子均为 杂化。
杂化。 分子中的
分子中的 键角
键角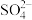 离子中
离子中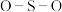 键角,其原因是
键角,其原因是③
 属于配位化合物。由结构示意图可知,
属于配位化合物。由结构示意图可知, 中
中 的配位数为
的配位数为(2)
 晶体的晶胞形状为立方体,边长为
晶体的晶胞形状为立方体,边长为 ,结构如图所示。
,结构如图所示。
①
 的电子式为
的电子式为②
 晶体中
晶体中 位于
位于 形成的
形成的③
 的摩尔质量为
的摩尔质量为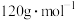 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。该晶体的密度为
。该晶体的密度为 。(列出算式即可,无需化简。
。(列出算式即可,无需化简。 )
)(3)
 加热脱水后生成
加热脱水后生成 ,再与
,再与 在氧气中掺烧可联合制备铁精粉和硫酸。
在氧气中掺烧可联合制备铁精粉和硫酸。 分解和
分解和 在氧气中燃烧的能量示意图如题图所示。从能源与资源综合利用角度分析,利用
在氧气中燃烧的能量示意图如题图所示。从能源与资源综合利用角度分析,利用 和
和 联合制备铁精粉和硫酸的优点是
联合制备铁精粉和硫酸的优点是
您最近一年使用:0次
名校
解题方法
7 . 钛由于其稳定的化学性质和良好的机械、物理性能被美誉为“未来钢铁”、“战略金属”,二氧化钛是性能很好的一种美白、防晒化妆品原料。回答下列问题:
(1)基态钛原子核外共有_______ 种运动状态不相同的电子;下列Ti原子价电子排布图中,因违背“洪特规则”而不可能存在的是_______ (填标号,下同);可能存在的基态或激发态原子中能量最高的是_______ 。
A.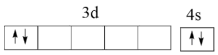 B.
B.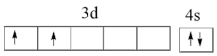
C.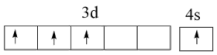 D.
D.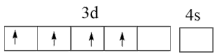
(2)从物质结构角度解释钛比铝硬度大、强度高的原因_______ 。
(3)常温下TiCl4是一种无色液体,分子结构与CCl4相同。TiCl4极易水解生成Ti(OH)4,再使Ti(OH)4受热分解制备TiO2。
①TiCl4晶体类型是_______ 。
②TiCl4稳定性比CCl4差,试从物质结构角度分析其原因_______ 。
③焙烧Ti(OH)4后会有少量的TiO2残留在容器内壁不易去除,我们可以用NaOH溶液将残留的TiO2洗干净。请用化学方程式表示该洗涤原理_______ 。
(4)钙钛矿材料具备了吸光性、电催化性等很多独特的理化性质,CaTiO3晶体结构如图所示。其中A代表_______ (写离子符号),它的配位数是_______ 。CaTiO3晶体密度约为4.0 g/cm3,阿伏加德罗常数用NA表示,则该立方晶胞参数a=_______ nm(写出计算式即可)。
(1)基态钛原子核外共有
A.
 B.
B.
C.
 D.
D.
(2)从物质结构角度解释钛比铝硬度大、强度高的原因
(3)常温下TiCl4是一种无色液体,分子结构与CCl4相同。TiCl4极易水解生成Ti(OH)4,再使Ti(OH)4受热分解制备TiO2。
①TiCl4晶体类型是
②TiCl4稳定性比CCl4差,试从物质结构角度分析其原因
③焙烧Ti(OH)4后会有少量的TiO2残留在容器内壁不易去除,我们可以用NaOH溶液将残留的TiO2洗干净。请用化学方程式表示该洗涤原理
(4)钙钛矿材料具备了吸光性、电催化性等很多独特的理化性质,CaTiO3晶体结构如图所示。其中A代表

您最近一年使用:0次
8 . 20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构。其要点可以概括为:
Ⅰ、用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数。分子中的价层电子对总是互相排斥 ,均匀的分布在中心原子周围的空间 ;
Ⅱ、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;
Ⅲ、分子中价层电子对之间的斥力主要顺序为:i、孤对电子之间的斥力>孤对电子对
与共用电子对之间的斥力>共用电子对之间的斥力;ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;iii、X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强。 请仔细阅读上述材料,回答下列问题:
(1)指出下面物质分子或离子的空间构型:PO43-_____________________________ ; PCl5_____________________ 。
(2) 有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:

__________________ ;
__________________ 。
(3) 按要求写出第二周期非金属元素构成的中性分子的化学式:平面三角形分子___________ ,三角锥形分子___________ ,四面体形分子_____________ 。
(4) 下列一组微粒中键角由大到小顺序排列为____________________ (用编号填写)
①HCN ②SiF4③SCl2④CO32- ⑤H3O+
Ⅰ、用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数。
Ⅱ、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;
Ⅲ、分子中价层电子对之间的斥力主要顺序为:i、孤对电子之间的斥力>孤对电子对
与共用电子对之间的斥力>共用电子对之间的斥力;ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;iii、X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强。 请仔细阅读上述材料,回答下列问题:
(1)指出下面物质分子或离子的空间构型:PO43-
(2) 有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:


(3) 按要求写出第二周期非金属元素构成的中性分子的化学式:平面三角形分子
(4) 下列一组微粒中键角由大到小顺序排列为
①HCN ②SiF4③SCl2④CO32- ⑤H3O+
您最近一年使用:0次
10-11高二下·江苏南通·期末
解题方法
9 . 氮是地球上极为丰富的元素。
(1)N2是大气的主要成分之一,由于分子中键能很大,所以性质稳定。已知N≡N的键能为946 kJ·mol-1,N-N单键的键能为193 kJ·mol-1。
计算:N2分子中“π”键的键能约为_______ ;
结论:N2分子中“σ”和“π”键的稳定性_______ 。
(2)氮的氧化物是大气污染物之一、为了消除污染,科研人员设计了同时消除二氧化硫和氮的氧化物的方法,其工艺流程如下:

其中清除室、分解室发生的反应如下:
清除室:NO + NO2 = N2O3 N2O3 + 2H2SO4 = 2NOHSO4 + H2O
分解室:4NOHSO4 + O2 + 2H2O = 4H2SO4 + 4NO2
回答下列问题:
I.①和②分别为(写化学式)_______ 、_______ ;
Ⅱ.氧化室发生的反应是_______ ;
(3)金属氮化物是一类重要的化学物质,有着特殊的用途。某金属离子(M+)与N3-形成的晶体结构如右图所示。其中M+中所有电子正好充满K、L、M三个电子层,它M+的符号是_______ ,与同一个N3-相连的M+有_______ 个。

(4)NH3既是重要的工业产品,又是主要的工业原料。以NH3为原料生产硝酸铵的过
程如下:

其中反应②为:4NO+3O2+2H2O=4HNO3原料气为氨气和空气的混合物,假设空气中氧气的体积分数为0.2。
I.写出反应①的化学方程式_______ 。若不考虑副反应且各步反应均完全,生产过程中原料气中的氨气(不包含第③步被硝酸吸收的氨气)和空气中氧气恰好全部转化为硝酸,则原料气中制备硝酸的氨气和氧气的体积比为_______ 。
Ⅱ.若实际生产中,反应①中氨的转化率(或利用率)为70%,反应②中NO的转化率为90%,反应③中氨和硝酸均完全转化。则生产硝酸的氨气占所用氨气总量的体积分数为________ (写出计算过程)
(1)N2是大气的主要成分之一,由于分子中键能很大,所以性质稳定。已知N≡N的键能为946 kJ·mol-1,N-N单键的键能为193 kJ·mol-1。
计算:N2分子中“π”键的键能约为
结论:N2分子中“σ”和“π”键的稳定性
(2)氮的氧化物是大气污染物之一、为了消除污染,科研人员设计了同时消除二氧化硫和氮的氧化物的方法,其工艺流程如下:

其中清除室、分解室发生的反应如下:
清除室:NO + NO2 = N2O3 N2O3 + 2H2SO4 = 2NOHSO4 + H2O
分解室:4NOHSO4 + O2 + 2H2O = 4H2SO4 + 4NO2
回答下列问题:
I.①和②分别为(写化学式)
Ⅱ.氧化室发生的反应是
(3)金属氮化物是一类重要的化学物质,有着特殊的用途。某金属离子(M+)与N3-形成的晶体结构如右图所示。其中M+中所有电子正好充满K、L、M三个电子层,它M+的符号是

(4)NH3既是重要的工业产品,又是主要的工业原料。以NH3为原料生产硝酸铵的过
程如下:

其中反应②为:4NO+3O2+2H2O=4HNO3原料气为氨气和空气的混合物,假设空气中氧气的体积分数为0.2。
I.写出反应①的化学方程式
Ⅱ.若实际生产中,反应①中氨的转化率(或利用率)为70%,反应②中NO的转化率为90%,反应③中氨和硝酸均完全转化。则生产硝酸的氨气占所用氨气总量的体积分数为
您最近一年使用:0次



