1 .  是周期表中
是周期表中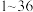 号的元素,它们的原子序数递增,对它们的性质及结构的描述如下:A的基态原子只有一种形状的电子云,并容易形成共价键;B的基态原子有3个不同的能级,各能级中电子数相等;C与B同周期,其第一电离能高于周期表中与之相邻的所有元素;D在周期表中位于C的下一周期,其电负性在同周期主族元素中最大;E的基态原子在前四周期中未成对电子数最多.
号的元素,它们的原子序数递增,对它们的性质及结构的描述如下:A的基态原子只有一种形状的电子云,并容易形成共价键;B的基态原子有3个不同的能级,各能级中电子数相等;C与B同周期,其第一电离能高于周期表中与之相邻的所有元素;D在周期表中位于C的下一周期,其电负性在同周期主族元素中最大;E的基态原子在前四周期中未成对电子数最多.
(1) 的电子式为
的电子式为______________ , 中含有的化学键类型为
中含有的化学键类型为______________ .
(2)B、C两种元素的第三电离能由大到小的顺序为______________ (填元素符号)
(3)E在元素周期表中位置为______________ ,位于元素周期表的______________ 区.
(4)比较:①键角大小: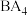
______________  ;②在水中的溶解性大小
;②在水中的溶解性大小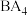
______________  ;
;
 是周期表中
是周期表中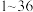 号的元素,它们的原子序数递增,对它们的性质及结构的描述如下:A的基态原子只有一种形状的电子云,并容易形成共价键;B的基态原子有3个不同的能级,各能级中电子数相等;C与B同周期,其第一电离能高于周期表中与之相邻的所有元素;D在周期表中位于C的下一周期,其电负性在同周期主族元素中最大;E的基态原子在前四周期中未成对电子数最多.
号的元素,它们的原子序数递增,对它们的性质及结构的描述如下:A的基态原子只有一种形状的电子云,并容易形成共价键;B的基态原子有3个不同的能级,各能级中电子数相等;C与B同周期,其第一电离能高于周期表中与之相邻的所有元素;D在周期表中位于C的下一周期,其电负性在同周期主族元素中最大;E的基态原子在前四周期中未成对电子数最多.(1)
 的电子式为
的电子式为 中含有的化学键类型为
中含有的化学键类型为(2)B、C两种元素的第三电离能由大到小的顺序为
(3)E在元素周期表中位置为
(4)比较:①键角大小:
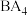
 ;②在水中的溶解性大小
;②在水中的溶解性大小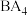
 ;
;
您最近一年使用:0次
2 . 聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。
Ⅰ.苯乙烯的制备
(1)已知下列反应的热化学方程式:
①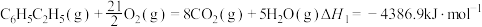
②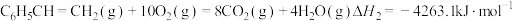
③
计算反应④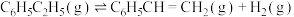 的
的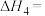
_______  ;
;
(2)在某温度、 下,向反应器中充入
下,向反应器中充入 气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入
气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入_______  水蒸气作为稀释气(计算时忽略副反应);
水蒸气作为稀释气(计算时忽略副反应);
(3)在 、
、 下,以水蒸气作稀释气。
下,以水蒸气作稀释气。 作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
⑤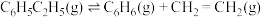
⑥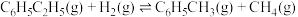
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S( )随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是
)随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是_______ ,理由是_______ ; 的描述错误的是_______;
的描述错误的是_______;
Ⅱ.苯乙烯的聚合
苯乙烯聚合有多种方法,其中一种方法的关键步骤是某 (Ⅰ)的配合物促进
(Ⅰ)的配合物促进 (引发剂,X表示卤素)生成自由基
(引发剂,X表示卤素)生成自由基 ,实现苯乙烯可控聚合。
,实现苯乙烯可控聚合。
(5)引发剂 中活性最高的是
中活性最高的是_______ ;
(6)室温下,① 在配体L的水溶液中形成
在配体L的水溶液中形成 ,其反应平衡常数为K;②
,其反应平衡常数为K;② 在水中的溶度积常数为
在水中的溶度积常数为 。由此可知,
。由此可知, 在配体L的水溶液中溶解反应的平衡常数为
在配体L的水溶液中溶解反应的平衡常数为_______ (所有方程式中计量系数关系均为最简整数比)。
Ⅰ.苯乙烯的制备
(1)已知下列反应的热化学方程式:
①
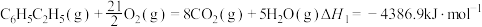
②
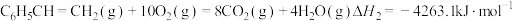
③

计算反应④
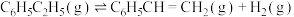 的
的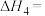
 ;
;(2)在某温度、
 下,向反应器中充入
下,向反应器中充入 气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入
气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入 水蒸气作为稀释气(计算时忽略副反应);
水蒸气作为稀释气(计算时忽略副反应);(3)在
 、
、 下,以水蒸气作稀释气。
下,以水蒸气作稀释气。 作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:⑤
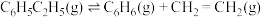
⑥
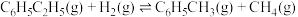
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S(
 )随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是
)随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是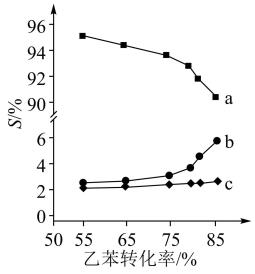
 的描述错误的是_______;
的描述错误的是_______;A.X射线衍射技术可测定 晶体结构 晶体结构 |
B. 可改变乙苯平衡转化率 可改变乙苯平衡转化率 |
C. 降低了乙苯脱氢反应的活化能 降低了乙苯脱氢反应的活化能 |
D.改变 颗粒大小不影响反应速率 颗粒大小不影响反应速率 |
Ⅱ.苯乙烯的聚合
苯乙烯聚合有多种方法,其中一种方法的关键步骤是某
 (Ⅰ)的配合物促进
(Ⅰ)的配合物促进 (引发剂,X表示卤素)生成自由基
(引发剂,X表示卤素)生成自由基 ,实现苯乙烯可控聚合。
,实现苯乙烯可控聚合。(5)引发剂
 中活性最高的是
中活性最高的是(6)室温下,①
 在配体L的水溶液中形成
在配体L的水溶液中形成 ,其反应平衡常数为K;②
,其反应平衡常数为K;② 在水中的溶度积常数为
在水中的溶度积常数为 。由此可知,
。由此可知, 在配体L的水溶液中溶解反应的平衡常数为
在配体L的水溶液中溶解反应的平衡常数为
您最近一年使用:0次
2023-06-16更新
|
7558次组卷
|
9卷引用:湖北省沙市中学2023-2024学年高三下学期3月月考化学试题
湖北省沙市中学2023-2024学年高三下学期3月月考化学试题2023年高考湖南卷化学真题(已下线)专题17 原理综合题(已下线)2023年湖南卷高考真题变式题(原理综合题)(已下线)专题14 化学反应原理综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题15 化学反应原理综合题-2023年高考化学真题题源解密(全国通用)湖南省长沙市麓山国际实验学校2023-2024学年高三上学期第一次月考化学试题 浙江省义乌中学2024届高三上学期首考适应性考试化学试题(已下线)压轴题13 化学反应原理综合题(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
名校
3 . 依据相关知识回答下列问题:
Ⅰ.键能是指在25 ℃、101 kPa,将1 mol理想气体分子AB拆开为中性气态原子A和B时所需要的能量。显然键能越大,化学键越牢固,含有该键的分子越稳定。
(1)已知键能:H-H键为436 kJ•mol-1;H-F键为565 kJ•mol-1;H-Cl键为431 kJ•mol-1;H-Br键为366 kJ•mol-1。则下列分子受热时最稳定的是_______。
(2)能用键能大小解释的是_______。
(3)已知:H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成lmol NH3过程中放出46kJ的热量。则N≡N的键能为_______ kJ/mol。
Ⅱ.CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构示意图如下。
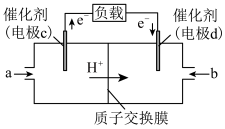
(4)电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是_______ (填“正极”或“负极”),c电极的电极反应式为_______ 。若外电路中转移2 mol电子,则上述燃料电池所消耗的O2在标准状况下的体积为_______ L。
(5)下列反应中,属于吸热反应的是_______ (填序号)
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥Ba(OH)2•8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
Ⅰ.键能是指在25 ℃、101 kPa,将1 mol理想气体分子AB拆开为中性气态原子A和B时所需要的能量。显然键能越大,化学键越牢固,含有该键的分子越稳定。
(1)已知键能:H-H键为436 kJ•mol-1;H-F键为565 kJ•mol-1;H-Cl键为431 kJ•mol-1;H-Br键为366 kJ•mol-1。则下列分子受热时最稳定的是_______。
| A.HF | B.HCl | C.HBr | D.H2 |
| A.氮气的化学性质比氧气稳定 | B.常温常压下溴呈液态,碘呈固态 |
| C.稀有气体一般很难发生化学反应 | D.硝酸易挥发而硫酸难挥发 |
Ⅱ.CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构示意图如下。

(4)电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是
(5)下列反应中,属于吸热反应的是
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥Ba(OH)2•8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
您最近一年使用:0次
名校
解题方法
4 . 二氯异氰尿酸钠(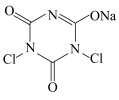 ,简称DCCNa)是一种高效、安全的消毒剂,常温下性质稳定,受热易分解,难溶于冷水。实验室通过以下原理和装置(夹持仪器已略去)可以制取DCCNa。
,简称DCCNa)是一种高效、安全的消毒剂,常温下性质稳定,受热易分解,难溶于冷水。实验室通过以下原理和装置(夹持仪器已略去)可以制取DCCNa。
已知:实验室常用高浓度的NaClO溶液和氰尿酸溶液在10℃时反应制备DCCNa,主要发生反应: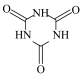 (氰尿酸)
(氰尿酸)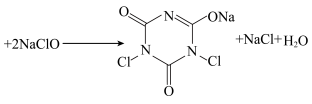
(1) 和
和 中
中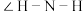 大小:
大小:
___________ -NH2(填“>”“<”或“=”)。
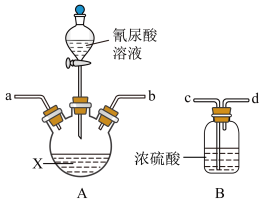
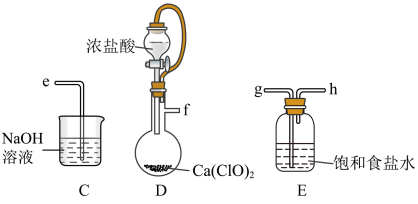
(2)A装置中盛装X试剂的仪器名称是___________ ;D中软导管的作用是___________ 。
(3)请选择合适的装置,按气流从左至右方向组装,则导管连接顺序为___________ (填小写字母)。
(4)X试剂为饱和氢氧化钠溶液。当装置A内出现___________ 现象时,打开装置A的活塞加入 (氰尿酸)溶液,在反应过程中仍不断通入
(氰尿酸)溶液,在反应过程中仍不断通入 的目的是
的目的是___________ 。
(5)实验过程中A的温度必须保持为7℃~12℃,pH值控制在6.5~8.5的范围,则该实验的控温方式是___________ 。若温度过高,pH过低,会生成 和
和 等,写出该反应的化学方程式
等,写出该反应的化学方程式___________ 。
 ,简称DCCNa)是一种高效、安全的消毒剂,常温下性质稳定,受热易分解,难溶于冷水。实验室通过以下原理和装置(夹持仪器已略去)可以制取DCCNa。
,简称DCCNa)是一种高效、安全的消毒剂,常温下性质稳定,受热易分解,难溶于冷水。实验室通过以下原理和装置(夹持仪器已略去)可以制取DCCNa。

已知:实验室常用高浓度的NaClO溶液和氰尿酸溶液在10℃时反应制备DCCNa,主要发生反应:
 (氰尿酸)
(氰尿酸)
(1)
 和
和 中
中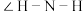 大小:
大小:
(2)A装置中盛装X试剂的仪器名称是
(3)请选择合适的装置,按气流从左至右方向组装,则导管连接顺序为
(4)X试剂为饱和氢氧化钠溶液。当装置A内出现
 (氰尿酸)溶液,在反应过程中仍不断通入
(氰尿酸)溶液,在反应过程中仍不断通入 的目的是
的目的是(5)实验过程中A的温度必须保持为7℃~12℃,pH值控制在6.5~8.5的范围,则该实验的控温方式是
 和
和 等,写出该反应的化学方程式
等,写出该反应的化学方程式
您最近一年使用:0次
解题方法
5 . 氟在已知元素中电负性最大,被同学们称为“最牛”非金属元素。回答下列问题:
(1)基态F原子的核外电子排布式是________ ,其电子在原子核外的空间运动状态是______ 种。
(2)氟氧化物O2F2、OF2的结构已经确定。
①O2F2是___________ (填“极性”或“非极性”)分子。
②依据下表数据推测O—O键的稳定性:O2F2___________ H2O2(填“>”或“<”)。
③OF2中F-O-F的键角___________ (填“>”或“<”)H2O中H-O-H的键角。
(3)HF是一种有特殊性质的氢化物。
①已知:氢键(X—H…Y)中三原子在一条直线上时,作用力最强。测定结果表明, 固体中HF分子排列成锯齿形。画出含3个HF的重复单元结构:
固体中HF分子排列成锯齿形。画出含3个HF的重复单元结构:___________ 。
②HF中加入BF3可以解离出H2F+和具有正四面体形结构的阴离子,写出解离过程的离子方程式:___________ 。
(1)基态F原子的核外电子排布式是
(2)氟氧化物O2F2、OF2的结构已经确定。
①O2F2是
②依据下表数据推测O—O键的稳定性:O2F2
| O2F2 | H2O2 | |
| O—O键长/pm | 121 | 148 |
(3)HF是一种有特殊性质的氢化物。
①已知:氢键(X—H…Y)中三原子在一条直线上时,作用力最强。测定结果表明,
 固体中HF分子排列成锯齿形。画出含3个HF的重复单元结构:
固体中HF分子排列成锯齿形。画出含3个HF的重复单元结构:②HF中加入BF3可以解离出H2F+和具有正四面体形结构的阴离子,写出解离过程的离子方程式:
您最近一年使用:0次
解题方法
6 . S元素是动植物生长所必需的元素,在生活中应用广泛。
(1)基态S原子的价电子排布式为______ 。
(2)N2O、H2S、H2Se的键角由大到小的顺序为______ (填化学式)。
(3)已知无机含氧酸分子中非羟基氧数目越多,一般酸性越强,试从结构的角度解释H2SO4的酸性比H2SO3强的原因_____ 。
(4)PbS晶胞如图所示,已知晶胞中S2-与Pb2+最近的距离为 anm,设阿伏加德罗常数的值为NA,则晶体密度为
anm,设阿伏加德罗常数的值为NA,则晶体密度为______ g•cm-3。

(5)铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图所示。

晶体中每个铁原子周围距离最近的镁原子有______ 个,原子坐标参数可以表示晶胞内部原子的相对位置,其中原子坐标参数A为(0,0,0),B为( ,
, ,
, ),C为(
),C为( ,
, ,0),则D点坐标参数为
,0),则D点坐标参数为_____ 。
(1)基态S原子的价电子排布式为
(2)N2O、H2S、H2Se的键角由大到小的顺序为
(3)已知无机含氧酸分子中非羟基氧数目越多,一般酸性越强,试从结构的角度解释H2SO4的酸性比H2SO3强的原因
(4)PbS晶胞如图所示,已知晶胞中S2-与Pb2+最近的距离为
 anm,设阿伏加德罗常数的值为NA,则晶体密度为
anm,设阿伏加德罗常数的值为NA,则晶体密度为
(5)铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图所示。

晶体中每个铁原子周围距离最近的镁原子有
 ,
, ,
, ),C为(
),C为( ,
, ,0),则D点坐标参数为
,0),则D点坐标参数为
您最近一年使用:0次
名校
解题方法
7 . 我国磷、锌、铬等矿产资源储量丰富。回答下列问题:
(1)基态Zn原子核外电子共有_______ 种空间运动状态;基态铬原子的价电子轨道表示式(电子排布图)为_______ 。
(2)磷酸为磷的最高价含氧酸,其空间结构如下图所示:

①键能大小比较:磷氧双键_______ (填“大于”“等于”或“小于”)磷氧单键。
②键角大小比较:
_______  (填“大于”“等于”或“小于”)。
(填“大于”“等于”或“小于”)。
③纯净的磷酸黏度极大,随温度升高黏度迅速下降,原因是_______ 。
(3)磷化硼(BP)是一种超硬耐磨涂层材料,其立方晶胞如图所示(其晶胞参数或边长为apm);

①固态磷化硼属于_______ (填“分子”“离子”或“共价”)晶体。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。已知原子分数坐标:M点为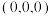 、G点为
、G点为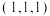 ,则Q点的原子分数坐标为
,则Q点的原子分数坐标为____ 。
③磷化硼晶体的密度为______  (列出计算式)。
(列出计算式)。
(1)基态Zn原子核外电子共有
(2)磷酸为磷的最高价含氧酸,其空间结构如下图所示:

①键能大小比较:磷氧双键
②键角大小比较:

 (填“大于”“等于”或“小于”)。
(填“大于”“等于”或“小于”)。③纯净的磷酸黏度极大,随温度升高黏度迅速下降,原因是
(3)磷化硼(BP)是一种超硬耐磨涂层材料,其立方晶胞如图所示(其晶胞参数或边长为apm);

①固态磷化硼属于
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。已知原子分数坐标:M点为
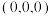 、G点为
、G点为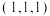 ,则Q点的原子分数坐标为
,则Q点的原子分数坐标为③磷化硼晶体的密度为
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2023-03-21更新
|
337次组卷
|
3卷引用:湖北省新高考协作体2022-2023学年高二下学期3月联考化学试题
解题方法
8 . 碱金属元素形成的单质及其化合物有广泛的应用。回答下列问题:
(1)K与 反应可形成离子晶体
反应可形成离子晶体 ,其离子键形成的
,其离子键形成的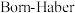 循环如图所示。可知,K原子的第一电离能为
循环如图所示。可知,K原子的第一电离能为______  ,
,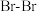 键键能为
键键能为_____  。
。

(2)K与 属于同一周期,且核外最外层电子构型相同,但单质K的熔点较低,其原因为
属于同一周期,且核外最外层电子构型相同,但单质K的熔点较低,其原因为________ 。
(3) 与
与 在高压下可以形成组成和结构均不相同的晶体。下图是其中一种晶体的晶胞。则该晶体的化学式为
在高压下可以形成组成和结构均不相同的晶体。下图是其中一种晶体的晶胞。则该晶体的化学式为__________ 。

(1)K与
 反应可形成离子晶体
反应可形成离子晶体 ,其离子键形成的
,其离子键形成的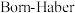 循环如图所示。可知,K原子的第一电离能为
循环如图所示。可知,K原子的第一电离能为 ,
,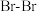 键键能为
键键能为 。
。
(2)K与
 属于同一周期,且核外最外层电子构型相同,但单质K的熔点较低,其原因为
属于同一周期,且核外最外层电子构型相同,但单质K的熔点较低,其原因为(3)
 与
与 在高压下可以形成组成和结构均不相同的晶体。下图是其中一种晶体的晶胞。则该晶体的化学式为
在高压下可以形成组成和结构均不相同的晶体。下图是其中一种晶体的晶胞。则该晶体的化学式为
您最近一年使用:0次
名校
解题方法
9 . 锌、氮元素形成的化合物在各领域有着重要的作用。
(1)基态Zn2+的价电子排布式为_______________ ;
(2)独立的NH3分子中,H-N-H键键角为107°18’。如图是[Zn(NH3)6]2+的部分结构以及其中H-N-H键键角。
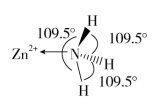
请解释[Zn(NH3)6]2+离子中H-N-H键角变为109.5°的原因是_____________ 。
(3)离子液体具有很高的应用价值,其中EMIM+离子由H、C、N三种元素组成,其结构如图所示:
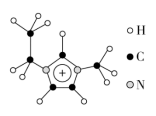
大π键可用符号Π 表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为
表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为___________________ 。化合物[EMIM][AlCl4]具有很高的应用价值,其熔点只有7 ℃,该物质晶体的类型是________ 。
(4)过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律,已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:____________________ 。
(5)Zn与S形成某种化合物的晶胞如图所示。
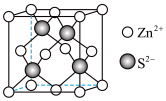
①Zn2+填入S2-组成的________________ 空隙中;
②由①能否判断出S2-、Zn2+相切?_________ (填“能”或“否”);已知晶体密度为dg/cm3,S2-半径为a pm,若要使S2-、Zn2+相切,则Zn2+半径为____________________ pm(写计算表达式)。
(1)基态Zn2+的价电子排布式为
(2)独立的NH3分子中,H-N-H键键角为107°18’。如图是[Zn(NH3)6]2+的部分结构以及其中H-N-H键键角。

请解释[Zn(NH3)6]2+离子中H-N-H键角变为109.5°的原因是
(3)离子液体具有很高的应用价值,其中EMIM+离子由H、C、N三种元素组成,其结构如图所示:

大π键可用符号Π
 表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为
表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为(4)过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律,已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
| 离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
| 水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:
(5)Zn与S形成某种化合物的晶胞如图所示。

①Zn2+填入S2-组成的
②由①能否判断出S2-、Zn2+相切?
您最近一年使用:0次



