名校
解题方法
1 . 前四周期原子序数依次增大的元素 、
、 、
、 、
、 、
、 、
、 ,
, 中,
中, 的核外电子只有一个;
的核外电子只有一个; 的价电子层中未成对电子只有2个,且
的价电子层中未成对电子只有2个,且 紧邻
紧邻 ;
; 和
和 的价电子层中未成对电子均只有1个,并且
的价电子层中未成对电子均只有1个,并且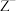 和
和 的电子数相差8;与
的电子数相差8;与 位于同一周期的
位于同一周期的 和
和 ,它们价电子层中的未成对电子数分别为4和2,且原子序数相差2.回答下列问题:
,它们价电子层中的未成对电子数分别为4和2,且原子序数相差2.回答下列问题:
(1)实验室常用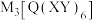 检验
检验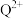 ,反应的离子方程式为
,反应的离子方程式为 。
。
①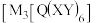 中
中 离子的配位数为
离子的配位数为_______ 。
②形成配位键时, 中提供孤电子对的原子为
中提供孤电子对的原子为_______ (填元素符号)。
③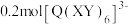 中含
中含_______  键。
键。
(2)金属 化物是应用广泛的还原剂。
化物是应用广泛的还原剂。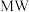 的还原性比
的还原性比 的强,原因为
的强,原因为_______ 。
(3)由 、
、 组成的化合物
组成的化合物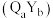 在磁记录材料领域有着广阔的应用前景。某
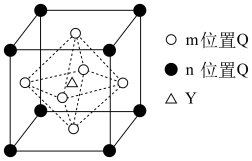
在磁记录材料领域有着广阔的应用前景。某 的晶胞结构如图所示(
的晶胞结构如图所示( 、
、 位置均有
位置均有 ),若立方晶胞的参数为
),若立方晶胞的参数为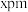 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体密度为
,则该晶体密度为_______ (用含 、
、 的代数式表示)
的代数式表示) 。
。
由表中数据可得知: 和
和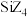 熔点相差较小,
熔点相差较小,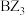 和
和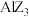 熔点相差较大。请简述
熔点相差较大。请简述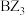 和
和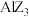 熔点相差较大的原因:
熔点相差较大的原因:_______ 。
(5) 能形成多种配合物,如
能形成多种配合物,如 :
:
① 中
中 键角比独立存在的
键角比独立存在的 分子中键角略大,原因为
分子中键角略大,原因为_______ 。
②一定条件下,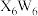 与
与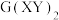 在氨水中可生成一种淡紫色
在氨水中可生成一种淡紫色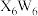 包合沉淀物。该沉淀物晶体属四方晶系,晶胞结构和晶胞参数如图所示,晶胞棱边夹角为
包合沉淀物。该沉淀物晶体属四方晶系,晶胞结构和晶胞参数如图所示,晶胞棱边夹角为 。
。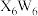 分子位于晶胞的体心且2个
分子位于晶胞的体心且2个 键平行于
键平行于 轴。已知
轴。已知 键长为
键长为 ,
, 键长为
键长为 ,则该晶体中,
,则该晶体中, 与
与 的个数之比为
的个数之比为_______ ,晶胞中 与
与 间的距离为
间的距离为_______  。
。
 、
、 、
、 、
、 、
、 、
、 ,
, 中,
中, 的核外电子只有一个;
的核外电子只有一个; 的价电子层中未成对电子只有2个,且
的价电子层中未成对电子只有2个,且 紧邻
紧邻 ;
; 和
和 的价电子层中未成对电子均只有1个,并且
的价电子层中未成对电子均只有1个,并且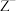 和
和 的电子数相差8;与
的电子数相差8;与 位于同一周期的
位于同一周期的 和
和 ,它们价电子层中的未成对电子数分别为4和2,且原子序数相差2.回答下列问题:
,它们价电子层中的未成对电子数分别为4和2,且原子序数相差2.回答下列问题:(1)实验室常用
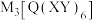 检验
检验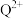 ,反应的离子方程式为
,反应的离子方程式为 。
。①
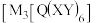 中
中 离子的配位数为
离子的配位数为②形成配位键时,
 中提供孤电子对的原子为
中提供孤电子对的原子为③
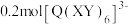 中含
中含 键。
键。(2)金属
 化物是应用广泛的还原剂。
化物是应用广泛的还原剂。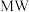 的还原性比
的还原性比 的强,原因为
的强,原因为(3)由
 、
、 组成的化合物
组成的化合物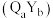 在磁记录材料领域有着广阔的应用前景。某
在磁记录材料领域有着广阔的应用前景。某 的晶胞结构如图所示(
的晶胞结构如图所示( 、
、 位置均有
位置均有 ),若立方晶胞的参数为
),若立方晶胞的参数为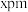 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体密度为
,则该晶体密度为 、
、 的代数式表示)
的代数式表示) 。
。
| 物质 |  | 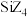 | 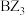 | 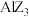 |
熔点/ |  | 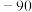 |  | 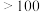 |
 和
和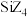 熔点相差较小,
熔点相差较小,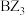 和
和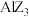 熔点相差较大。请简述
熔点相差较大。请简述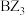 和
和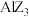 熔点相差较大的原因:
熔点相差较大的原因:(5)
 能形成多种配合物,如
能形成多种配合物,如 :
:①
 中
中 键角比独立存在的
键角比独立存在的 分子中键角略大,原因为
分子中键角略大,原因为②一定条件下,
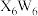 与
与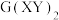 在氨水中可生成一种淡紫色
在氨水中可生成一种淡紫色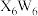 包合沉淀物。该沉淀物晶体属四方晶系,晶胞结构和晶胞参数如图所示,晶胞棱边夹角为
包合沉淀物。该沉淀物晶体属四方晶系,晶胞结构和晶胞参数如图所示,晶胞棱边夹角为 。
。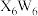 分子位于晶胞的体心且2个
分子位于晶胞的体心且2个 键平行于
键平行于 轴。已知
轴。已知 键长为
键长为 ,
, 键长为
键长为 ,则该晶体中,
,则该晶体中, 与
与 的个数之比为
的个数之比为 与
与 间的距离为
间的距离为 。
。
您最近一年使用:0次
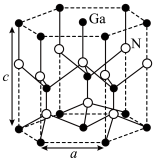
2 . GaN材料的研究与应用是目前全球半导体研究的前沿和热点,是研制微电子器件、光电子器件的新型半导体材料,GaN属于第三代半导体材料。
(1)GaN、GaP、GaAs都是良好的半导体材料,晶体结构相似。熔点分别为:1700℃(GaN)、1480℃(GaP)、1238℃(GaAs),其熔点变化的原因为_______ 。
(2)GaN的晶胞结构如图所示,每个Ga原子周围距离最近的N原子个数为_______ 个。
Ⅰ.为生成GaN,首先要得到有机镓源,即有机镓。
(3)有机镓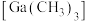 的制取实验原理及反应的装置如下图。在充满惰性气体、含有乙醚(
的制取实验原理及反应的装置如下图。在充满惰性气体、含有乙醚( )溶剂的容器内加入镓镁(
)溶剂的容器内加入镓镁(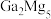 )合金,在持续搅拌、温度为30~80℃的条件下,加入引发剂碘甲烷,引发反应后通入一氯甲烷至反应结束。将溶剂蒸出,再减压蒸馏得到
)合金,在持续搅拌、温度为30~80℃的条件下,加入引发剂碘甲烷,引发反应后通入一氯甲烷至反应结束。将溶剂蒸出,再减压蒸馏得到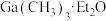 的配合物。将配合物加入高沸点有机胺
的配合物。将配合物加入高沸点有机胺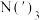 中,蒸馏去除醚类溶剂,再在减压条件下进一步去除醚类和低沸点杂质,最后解配得到无氧的三甲基镓粗品。进一步提纯得到高纯度
中,蒸馏去除醚类溶剂,再在减压条件下进一步去除醚类和低沸点杂质,最后解配得到无氧的三甲基镓粗品。进一步提纯得到高纯度 。
。
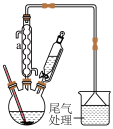
①反应仪器a的名称为____ 。三颈烧瓶中除生成 外,还有
外,还有 和
和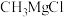 生成,该反应的化学方程式为
生成,该反应的化学方程式为______ 。
②工业上不采用直接分解 ,而采用先将
,而采用先将 加入高沸点有机胺
加入高沸点有机胺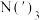 ,中,再在真空条件下分解
,中,再在真空条件下分解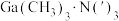 的原因为
的原因为_______ 。
已知相关物质的沸点信息如下表:
Ⅱ.MOCVD生产GaN的示意图如下:
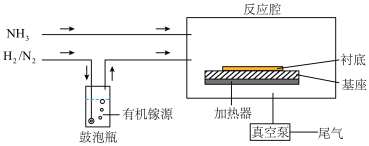
(4)采用多孔球泡的原因是_______ ,制取GaN的化学反应方程式为_______ 。
(5)工业上采用真空泵抽取尾气的原因为_______ 。
(1)GaN、GaP、GaAs都是良好的半导体材料,晶体结构相似。熔点分别为:1700℃(GaN)、1480℃(GaP)、1238℃(GaAs),其熔点变化的原因为
(2)GaN的晶胞结构如图所示,每个Ga原子周围距离最近的N原子个数为

Ⅰ.为生成GaN,首先要得到有机镓源,即有机镓。
(3)有机镓
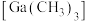 的制取实验原理及反应的装置如下图。在充满惰性气体、含有乙醚(
的制取实验原理及反应的装置如下图。在充满惰性气体、含有乙醚( )溶剂的容器内加入镓镁(
)溶剂的容器内加入镓镁(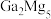 )合金,在持续搅拌、温度为30~80℃的条件下,加入引发剂碘甲烷,引发反应后通入一氯甲烷至反应结束。将溶剂蒸出,再减压蒸馏得到
)合金,在持续搅拌、温度为30~80℃的条件下,加入引发剂碘甲烷,引发反应后通入一氯甲烷至反应结束。将溶剂蒸出,再减压蒸馏得到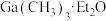 的配合物。将配合物加入高沸点有机胺
的配合物。将配合物加入高沸点有机胺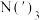 中,蒸馏去除醚类溶剂,再在减压条件下进一步去除醚类和低沸点杂质,最后解配得到无氧的三甲基镓粗品。进一步提纯得到高纯度
中,蒸馏去除醚类溶剂,再在减压条件下进一步去除醚类和低沸点杂质,最后解配得到无氧的三甲基镓粗品。进一步提纯得到高纯度 。
。
①反应仪器a的名称为
 外,还有
外,还有 和
和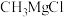 生成,该反应的化学方程式为
生成,该反应的化学方程式为②工业上不采用直接分解
 ,而采用先将
,而采用先将 加入高沸点有机胺
加入高沸点有机胺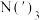 ,中,再在真空条件下分解
,中,再在真空条件下分解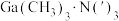 的原因为
的原因为已知相关物质的沸点信息如下表:
| 物质 |  |  |  |
| 沸点/℃ | 55.8 | 34.5 | 365.8 |
Ⅱ.MOCVD生产GaN的示意图如下:

(4)采用多孔球泡的原因是
(5)工业上采用真空泵抽取尾气的原因为
您最近一年使用:0次
名校
解题方法
3 . 很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。
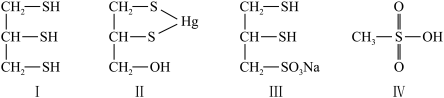
(1)基态硫原子价电子排布式为___________ 。
(2)H2S、H2O气态氢化物的稳定性顺序为:___________ ,沸点由高到低顺序为___________ 。
(3)价层电子排布为5s25p5,位于元素周期表位置为___________ ,所处的区为___________ 。
(4)化合物Ⅲ也是一种汞解毒剂,化合物Ⅳ是一种强酸,下列说法正确的有___________ 。
A.在I中S原子采取sp3杂化 B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180° D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相同

(1)基态硫原子价电子排布式为
(2)H2S、H2O气态氢化物的稳定性顺序为:
(3)价层电子排布为5s25p5,位于元素周期表位置为
(4)化合物Ⅲ也是一种汞解毒剂,化合物Ⅳ是一种强酸,下列说法正确的有
A.在I中S原子采取sp3杂化 B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180° D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相同
您最近一年使用:0次
4 . 超纯 是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯
是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯 方面取得了显著成果,工业上以粗镓为原料,制备超纯
方面取得了显著成果,工业上以粗镓为原料,制备超纯 的工艺流程如下:
的工艺流程如下: 的化学性质和
的化学性质和 相似,
相似, 的熔点为
的熔点为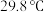 ;
;
② (乙醚)和
(乙醚)和 (三正辛胺)在上述流程中可作为配体;
(三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
回答下列问题:
(1)晶体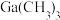 的晶体类型是
的晶体类型是_______ ;
(2)“电解精炼”装置如图所示,电解池温度控制在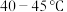 的原因是
的原因是_______ ,阴极的电极反应式为_______ ;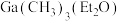 ”工序中的产物还包括
”工序中的产物还包括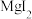 和
和 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_______ ;
(4)“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是_______ ;
(5)下列说法错误的是_______;
(6)直接分解 不能制备超纯
不能制备超纯 ,而本流程采用“配体交换”工艺制备超纯
,而本流程采用“配体交换”工艺制备超纯 的理由是
的理由是_______ ;
(7)比较分子中的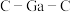 键角大小:
键角大小:
_______  (填“>”“<”或“=”),其原因是
(填“>”“<”或“=”),其原因是_______ 。
 是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯
是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯 方面取得了显著成果,工业上以粗镓为原料,制备超纯
方面取得了显著成果,工业上以粗镓为原料,制备超纯 的工艺流程如下:
的工艺流程如下: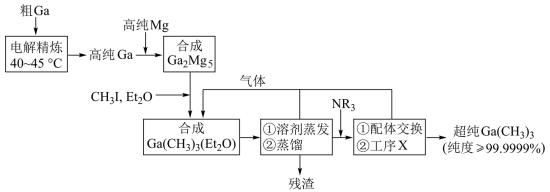
 的化学性质和
的化学性质和 相似,
相似, 的熔点为
的熔点为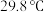 ;
;②
 (乙醚)和
(乙醚)和 (三正辛胺)在上述流程中可作为配体;
(三正辛胺)在上述流程中可作为配体;③相关物质的沸点:
| 物质 | 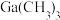 |  | 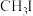 | 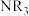 |
沸点/ | 55.7 | 34.6 | 42.4 | 365.8 |
(1)晶体
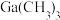 的晶体类型是
的晶体类型是(2)“电解精炼”装置如图所示,电解池温度控制在
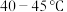 的原因是
的原因是
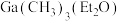 ”工序中的产物还包括
”工序中的产物还包括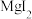 和
和 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(4)“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是
(5)下列说法错误的是_______;
A.流程中 得到了循环利用 得到了循环利用 |
B.流程中,“合成 ”至“工序X”需在无水无氧的条件下进行 ”至“工序X”需在无水无氧的条件下进行 |
C.“工序X”的作用是解配 ,并蒸出 ,并蒸出 |
D.用核磁共振氢谱不能区分 和 和 |
 不能制备超纯
不能制备超纯 ,而本流程采用“配体交换”工艺制备超纯
,而本流程采用“配体交换”工艺制备超纯 的理由是
的理由是(7)比较分子中的
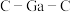 键角大小:
键角大小:
 (填“>”“<”或“=”),其原因是
(填“>”“<”或“=”),其原因是
您最近一年使用:0次
2023-06-16更新
|
10014次组卷
|
11卷引用:2023年高考湖南卷化学真题
2023年高考湖南卷化学真题(已下线)2023年湖南卷高考真题变式题(工业流程题)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)福建省厦门市 第一中学2023-2024上学期高三上学期12月考化学试题福建省漳州市华安县第一中学2023-2024学年高三上学期12月月考化学试题(已下线)题型四 无机化工流程题解题策略-备战2024年高考化学答题技巧与模板构建
5 . 聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。
Ⅰ.苯乙烯的制备
(1)已知下列反应的热化学方程式:
①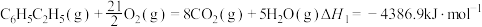
②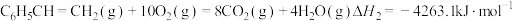
③
计算反应④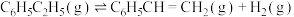 的
的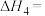
_______  ;
;
(2)在某温度、 下,向反应器中充入
下,向反应器中充入 气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入
气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入_______  水蒸气作为稀释气(计算时忽略副反应);
水蒸气作为稀释气(计算时忽略副反应);
(3)在 、
、 下,以水蒸气作稀释气。
下,以水蒸气作稀释气。 作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
⑤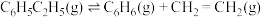
⑥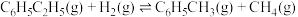
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S( )随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是
)随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是_______ ,理由是_______ ; 的描述错误的是_______;
的描述错误的是_______;
Ⅱ.苯乙烯的聚合
苯乙烯聚合有多种方法,其中一种方法的关键步骤是某 (Ⅰ)的配合物促进
(Ⅰ)的配合物促进 (引发剂,X表示卤素)生成自由基
(引发剂,X表示卤素)生成自由基 ,实现苯乙烯可控聚合。
,实现苯乙烯可控聚合。
(5)引发剂 中活性最高的是
中活性最高的是_______ ;
(6)室温下,① 在配体L的水溶液中形成
在配体L的水溶液中形成 ,其反应平衡常数为K;②
,其反应平衡常数为K;② 在水中的溶度积常数为
在水中的溶度积常数为 。由此可知,
。由此可知, 在配体L的水溶液中溶解反应的平衡常数为
在配体L的水溶液中溶解反应的平衡常数为_______ (所有方程式中计量系数关系均为最简整数比)。
Ⅰ.苯乙烯的制备
(1)已知下列反应的热化学方程式:
①
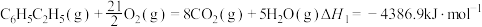
②
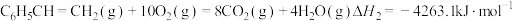
③

计算反应④
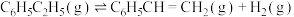 的
的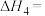
 ;
;(2)在某温度、
 下,向反应器中充入
下,向反应器中充入 气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入
气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入 水蒸气作为稀释气(计算时忽略副反应);
水蒸气作为稀释气(计算时忽略副反应);(3)在
 、
、 下,以水蒸气作稀释气。
下,以水蒸气作稀释气。 作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:⑤
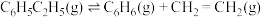
⑥
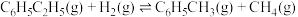
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S(
 )随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是
)随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是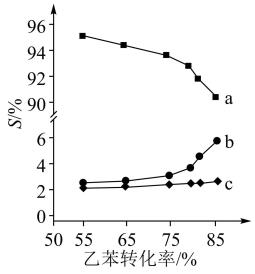
 的描述错误的是_______;
的描述错误的是_______;A.X射线衍射技术可测定 晶体结构 晶体结构 |
B. 可改变乙苯平衡转化率 可改变乙苯平衡转化率 |
C. 降低了乙苯脱氢反应的活化能 降低了乙苯脱氢反应的活化能 |
D.改变 颗粒大小不影响反应速率 颗粒大小不影响反应速率 |
Ⅱ.苯乙烯的聚合
苯乙烯聚合有多种方法,其中一种方法的关键步骤是某
 (Ⅰ)的配合物促进
(Ⅰ)的配合物促进 (引发剂,X表示卤素)生成自由基
(引发剂,X表示卤素)生成自由基 ,实现苯乙烯可控聚合。
,实现苯乙烯可控聚合。(5)引发剂
 中活性最高的是
中活性最高的是(6)室温下,①
 在配体L的水溶液中形成
在配体L的水溶液中形成 ,其反应平衡常数为K;②
,其反应平衡常数为K;② 在水中的溶度积常数为
在水中的溶度积常数为 。由此可知,
。由此可知, 在配体L的水溶液中溶解反应的平衡常数为
在配体L的水溶液中溶解反应的平衡常数为
您最近一年使用:0次
2023-06-16更新
|
7564次组卷
|
9卷引用:2023年高考湖南卷化学真题
2023年高考湖南卷化学真题(已下线)2023年湖南卷高考真题变式题(原理综合题)湖南省长沙市麓山国际实验学校2023-2024学年高三上学期第一次月考化学试题(已下线)专题17 原理综合题(已下线)专题14 化学反应原理综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题15 化学反应原理综合题-2023年高考化学真题题源解密(全国通用) 浙江省义乌中学2024届高三上学期首考适应性考试化学试题湖北省沙市中学2023-2024学年高三下学期3月月考化学试题(已下线)压轴题13 化学反应原理综合题(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
解题方法
6 . 重铬酸钾( ),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为
),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为 ,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备
,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备 的步骤如下:
的步骤如下:
步骤I.熔融氧化
将6g铬铁矿与4g氯酸钾在研钵中混合均匀,取碳酸钠和氢氧化钠各4.5g于仪器A中混匀后,小火熔融,再将矿粉分批加入坩埚中并不断搅拌。用煤气灯强热,灼烧30~35min,稍冷几分钟,加水,过滤,得滤液i,滤渣中含红棕色固体。
步骤Ⅱ.中和除杂
将滤液i用稀硫酸调pH为7~8,加热煮沸3min后,趁热过滤,用少量蒸馏水洗涤残渣,得滤液ii。
步骤Ⅲ.结晶
将滤液ii转移至蒸发皿中,用6 硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。
硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。
步骤Ⅳ.纯度测定
利用库仑滴定法测定 固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算
固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算 的浓度公式为
的浓度公式为 (F为96500
(F为96500 ,N为1个
,N为1个 转化为
转化为 时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度
时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度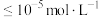 ,则认为该微粒已除尽。
,则认为该微粒已除尽。

回答下列问题:
(1)仪器A为_______(填标号)。
(2)若用 代替
代替 ,则理论上转化1mol
,则理论上转化1mol  所需
所需 的体积(标准状况,单位为L)是所消耗
的体积(标准状况,单位为L)是所消耗 物质的量的
物质的量的_______ 倍。
(3)步骤I中“分批加入”的目的是_______ 。
(4)若步骤Ⅱ中“调pH至3~4”的不良后果是_______ 。
(5)进一步提纯步骤Ⅲ所得晶体的方法是_______ 。
(6)探究pH对 溶液的氧化性强弱的影响。
溶液的氧化性强弱的影响。
(7) 与浓盐酸反应可制得
与浓盐酸反应可制得 ,已知部分卤素单质的键能如下表:
,已知部分卤素单质的键能如下表:
试解释键能 的原因
的原因_______ 。
(8) 固体样品的纯度为
固体样品的纯度为_______ (用含m的式子表示)。
 ),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为
),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为 ,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备
,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备 的步骤如下:
的步骤如下:步骤I.熔融氧化
将6g铬铁矿与4g氯酸钾在研钵中混合均匀,取碳酸钠和氢氧化钠各4.5g于仪器A中混匀后,小火熔融,再将矿粉分批加入坩埚中并不断搅拌。用煤气灯强热,灼烧30~35min,稍冷几分钟,加水,过滤,得滤液i,滤渣中含红棕色固体。
步骤Ⅱ.中和除杂
将滤液i用稀硫酸调pH为7~8,加热煮沸3min后,趁热过滤,用少量蒸馏水洗涤残渣,得滤液ii。
步骤Ⅲ.结晶
将滤液ii转移至蒸发皿中,用6
 硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。
硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。步骤Ⅳ.纯度测定
利用库仑滴定法测定
 固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算
固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算 的浓度公式为
的浓度公式为 (F为96500
(F为96500 ,N为1个
,N为1个 转化为
转化为 时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度
时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度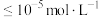 ,则认为该微粒已除尽。
,则认为该微粒已除尽。
回答下列问题:
(1)仪器A为_______(填标号)。
| A.普通坩埚 | B. 坩埚 坩埚 | C.氮化硅坩埚 | D.石英坩埚 |
 代替
代替 ,则理论上转化1mol
,则理论上转化1mol  所需
所需 的体积(标准状况,单位为L)是所消耗
的体积(标准状况,单位为L)是所消耗 物质的量的
物质的量的(3)步骤I中“分批加入”的目的是
(4)若步骤Ⅱ中“调pH至3~4”的不良后果是
(5)进一步提纯步骤Ⅲ所得晶体的方法是
(6)探究pH对
 溶液的氧化性强弱的影响。
溶液的氧化性强弱的影响。| 实验操作 | 实验现象 | 实验结论 |
向酸化的 溶液中加入一定量甲醇 溶液中加入一定量甲醇 | 溶液形成蓝紫色溶液,并产生无色无味的气体 | |
向碱化的 溶液中加入相同量甲醇 溶液中加入相同量甲醇 | 酸性条件下 溶液的氧化性更强 溶液的氧化性更强 |
 与浓盐酸反应可制得
与浓盐酸反应可制得 ,已知部分卤素单质的键能如下表:
,已知部分卤素单质的键能如下表:| 化学键 | F-F | C1-Cl | Br-Br |
键能/( ) ) | 157 | 242.7 | 193.7 |
 的原因
的原因(8)
 固体样品的纯度为
固体样品的纯度为
您最近一年使用:0次
名校
解题方法
7 . 磷、硫、氯是重要的非金属元素。回答下列问题:
(1)基态氯原子的核外电子排布式为_______ ;第三周期中第一电离能均大于同周期相邻元素的是_______ (填元素符号)
(2)氮和磷氢化物性质的比较:热稳定性:
_______  (填“>”或“<”)。沸点:
(填“>”或“<”)。沸点:
_______ 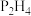 (填“>”或“<”),其沸点大小的判断依据是
(填“>”或“<”),其沸点大小的判断依据是_______ 。
(3)分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),已知
),已知 分子中共含有5对孤电子对,则
分子中共含有5对孤电子对,则 中的大
中的大 键应表示为
键应表示为_______ 。 分子中键角
分子中键角
_______  分子中键角
分子中键角 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
(1)基态氯原子的核外电子排布式为
(2)氮和磷氢化物性质的比较:热稳定性:

 (填“>”或“<”)。沸点:
(填“>”或“<”)。沸点:
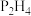 (填“>”或“<”),其沸点大小的判断依据是
(填“>”或“<”),其沸点大小的判断依据是(3)分子中的大
 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),已知
),已知 分子中共含有5对孤电子对,则
分子中共含有5对孤电子对,则 中的大
中的大 键应表示为
键应表示为 分子中键角
分子中键角
 分子中键角
分子中键角 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
您最近一年使用:0次
2023-02-09更新
|
315次组卷
|
2卷引用:湖南省长沙市雅礼中学2022-2023学年高二上学期期末考试化学试题
名校
8 . 氮、磷、砷等元素及其化合物在现代农业、科技、国防建设中有着许多独特的用途。
(1)基态氮原子电子占据最高能级的电子云轮廓图为___________ 形,下列有关表示基态氮原子的排布图中,仅违背洪特规则的是___________ 。
A.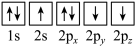 B.
B.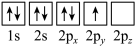
C.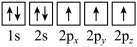 D.
D.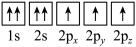
(2)肼是一种良好的火箭发射燃料,传统制备肼的方法是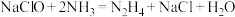 ,又知肼的熔点、沸点分别为1.4℃、113.5℃,氨气的熔点、沸点分别为-77.7℃、-33.5℃。
,又知肼的熔点、沸点分别为1.4℃、113.5℃,氨气的熔点、沸点分别为-77.7℃、-33.5℃。
①氮、氧、钠三种元素的第一电离能由大到小的顺序为___________ 。
② 中氮原子的杂化轨道类型为
中氮原子的杂化轨道类型为___________ , 的分子构型为
的分子构型为___________ 。
⑤水分子中键角___________  中的键角(填“>”、“<”或“=”)
中的键角(填“>”、“<”或“=”)
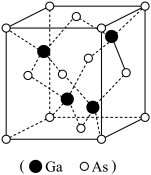
(3)有“半导体贵族”之称的砷化镓晶体中,As、Ga原子最外电子层均达到8电子稳定结构,其晶胞如图所示,则该化合物的化学式为___________ 。该晶体中的化学键的类型有___________ 。
A.离子键 B.极性键 C.配位键 D.氢键
(1)基态氮原子电子占据最高能级的电子云轮廓图为
A.
 B.
B.
C.
 D.
D.
(2)肼是一种良好的火箭发射燃料,传统制备肼的方法是
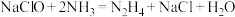 ,又知肼的熔点、沸点分别为1.4℃、113.5℃,氨气的熔点、沸点分别为-77.7℃、-33.5℃。
,又知肼的熔点、沸点分别为1.4℃、113.5℃,氨气的熔点、沸点分别为-77.7℃、-33.5℃。①氮、氧、钠三种元素的第一电离能由大到小的顺序为
②
 中氮原子的杂化轨道类型为
中氮原子的杂化轨道类型为 的分子构型为
的分子构型为⑤水分子中键角
 中的键角(填“>”、“<”或“=”)
中的键角(填“>”、“<”或“=”) (3)有“半导体贵族”之称的砷化镓晶体中,As、Ga原子最外电子层均达到8电子稳定结构,其晶胞如图所示,则该化合物的化学式为

A.离子键 B.极性键 C.配位键 D.氢键
您最近一年使用:0次
名校
解题方法
9 . 铁是一种重要的材料金属,与氨形成的化合物可用于制备催化剂、磁流体、吸波剂等,与镧、锑形成的合金具有热电效应。回答下列问题:
(1)Sb是与N同主族的第五周期元素,基态Sb原子的价电子排布图为_______ ;基态 核外占据最高能级电子的电子云有
核外占据最高能级电子的电子云有_______ 个伸展方向。
(2)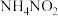 能为制备氮化铁提供氨源。
能为制备氮化铁提供氨源。
①1 molNH4NO2中含有配位键的数目为_______ 。
② 的立体构型为
的立体构型为_______ ,其中氮原子的杂化方式为_______ 。
③氮及其同周期相邻元素原子的第一电离能由大到小的顺序为_______ (用元素符号表示),其原因为_______ 。
④分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数,则
键的电子数,则 中的大
中的大 键可表示为
键可表示为_______ 。
(3)La、Sb、Fe形成合金的立方晶胞中,Fe原子填入Sb原子形成的正八面体空隙;La和Fe的位置如图1所示;沿x、y、z轴的投影图中Sb的位置相同,如图2所示。
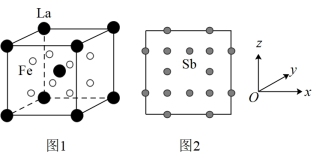
①La原子周围距离最近的Sb原子数目为_______ 。
②若晶胞参数为a pm,阿伏加德罗常数的值为NA,则晶体密度为_______  (用含a、NA的代数式表示)。
(用含a、NA的代数式表示)。
(1)Sb是与N同主族的第五周期元素,基态Sb原子的价电子排布图为
 核外占据最高能级电子的电子云有
核外占据最高能级电子的电子云有(2)
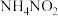 能为制备氮化铁提供氨源。
能为制备氮化铁提供氨源。①1 molNH4NO2中含有配位键的数目为
②
 的立体构型为
的立体构型为③氮及其同周期相邻元素原子的第一电离能由大到小的顺序为
④分子中的大
 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数,则
键的电子数,则 中的大
中的大 键可表示为
键可表示为(3)La、Sb、Fe形成合金的立方晶胞中,Fe原子填入Sb原子形成的正八面体空隙;La和Fe的位置如图1所示;沿x、y、z轴的投影图中Sb的位置相同,如图2所示。

①La原子周围距离最近的Sb原子数目为
②若晶胞参数为a pm,阿伏加德罗常数的值为NA,则晶体密度为
 (用含a、NA的代数式表示)。
(用含a、NA的代数式表示)。
您最近一年使用:0次
10 . 湖南是我国矿产资源大省,磷、锌储量丰富。回答下列问题:
(1)基态Zn原子核外电子共有_______ 种空间运动状态;锌在反应中易失去2个电子,则基态 的价电子轨道表示式(电子排布图)为
的价电子轨道表示式(电子排布图)为_______ 。
(2)含有多个配位原子的配体与同一中心离子(或原子)通过整合配位成环而形成的配合物为整合物。 与EDTA形成的螯合物的结构如图所示:
与EDTA形成的螯合物的结构如图所示:

①该配合物的组成元素中电负性最大的是_______ (填元素符号)。
②1个该配合物分子中通过螯合作用形成的配位键有_______ 个,该配合物中碳原子的杂化方式为_______ 。
(3)磷酸为磷的最高价含氧酸,其空间结构如下:
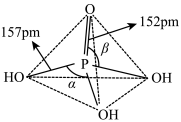
①键能大小比较:磷氧双键_______ (填“大于”“等于”或“小于”)磷氧单键。
②键角大小比较:
_______  (填“大于”“等于”或“小于”)。
(填“大于”“等于”或“小于”)。
③纯净的磷酸黏度极大,随温度升高黏度迅速下降,原因是_______ 。
(4)磷化硼(BP)是一种超硬耐磨涂层材料,其立方晶胞如图所示(其晶胞参数为a pm);

①固态磷化硼属于_______ (填“分子”“离子”或“原子”)晶体。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。已知原子分数坐标:M点为(0,0,0)、G点为(1,1,1),则Q点的原子分数坐标为_______ 。
③磷化硼晶体的密度为_______  (列出计算式)。
(列出计算式)。
(1)基态Zn原子核外电子共有
 的价电子轨道表示式(电子排布图)为
的价电子轨道表示式(电子排布图)为(2)含有多个配位原子的配体与同一中心离子(或原子)通过整合配位成环而形成的配合物为整合物。
 与EDTA形成的螯合物的结构如图所示:
与EDTA形成的螯合物的结构如图所示:
①该配合物的组成元素中电负性最大的是
②1个该配合物分子中通过螯合作用形成的配位键有
(3)磷酸为磷的最高价含氧酸,其空间结构如下:

①键能大小比较:磷氧双键
②键角大小比较:

 (填“大于”“等于”或“小于”)。
(填“大于”“等于”或“小于”)。③纯净的磷酸黏度极大,随温度升高黏度迅速下降,原因是
(4)磷化硼(BP)是一种超硬耐磨涂层材料,其立方晶胞如图所示(其晶胞参数为a pm);

①固态磷化硼属于
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。已知原子分数坐标:M点为(0,0,0)、G点为(1,1,1),则Q点的原子分数坐标为
③磷化硼晶体的密度为
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次



