名校
解题方法
1 . Ⅰ.8−羟基喹啉( )被广泛用作
)被广泛用作 等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
(1)8−羟基喹啉的熔点明显低于7−羟基喹啉(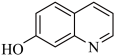 )、6−羟基喹啉(
)、6−羟基喹啉(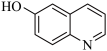 )的熔点的原因是
)的熔点的原因是___________ 。
(2) 不能形成类似
不能形成类似 分子中的
分子中的 键,原因是
键,原因是___________ 。
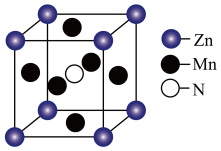
(3)某种含 特殊材料的晶胞结构如图所示,若该晶体的密度为
特殊材料的晶胞结构如图所示,若该晶体的密度为 ,则晶体中相邻N之间的最短距离为
,则晶体中相邻N之间的最短距离为___________  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
Ⅱ. 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。

(4)与 距离最近且相等的
距离最近且相等的 有
有___________ 个,与 距离最近且相等的F-有
距离最近且相等的F-有___________ 个。
(5) 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积
___________  。(
。( )
)
(6)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。
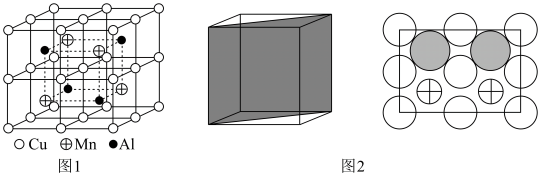
将Cu-Mn-Al合金晶胞沿棱投影于垂直面的是___________。(填字母序号)
(7)一种类石墨的聚合物g﹣C3N4可由三聚氰胺制得。三聚氰胺分子不溶于冷水,溶于热水,主要原因是___________ 。
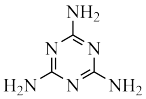
 )被广泛用作
)被广泛用作 等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:(1)8−羟基喹啉的熔点明显低于7−羟基喹啉(
 )、6−羟基喹啉(
)、6−羟基喹啉( )的熔点的原因是
)的熔点的原因是(2)
 不能形成类似
不能形成类似 分子中的
分子中的 键,原因是
键,原因是(3)某种含
 特殊材料的晶胞结构如图所示,若该晶体的密度为
特殊材料的晶胞结构如图所示,若该晶体的密度为 ,则晶体中相邻N之间的最短距离为
,则晶体中相邻N之间的最短距离为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
Ⅱ.
 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。
(4)与
 距离最近且相等的
距离最近且相等的 有
有 距离最近且相等的F-有
距离最近且相等的F-有(5)
 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积
 。(
。( )
)(6)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。

将Cu-Mn-Al合金晶胞沿棱投影于垂直面的是___________。(填字母序号)
A.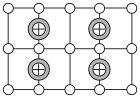 | B.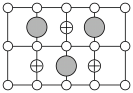 |
C. | D.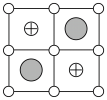 |
(7)一种类石墨的聚合物g﹣C3N4可由三聚氰胺制得。三聚氰胺分子不溶于冷水,溶于热水,主要原因是

您最近一年使用:0次
名校
解题方法
2 . 氯苯吡脲是一种常用的膨大剂,其结构简式如图,它是经国家批准使用的植物生长调节剂。
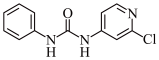
(1)氯元素基态原子核外电子的未成对电子数为_______ 。
(2)氯苯吡脲晶体中,氮原子的杂化轨道类型为_______ ,羰基碳原子的杂化轨道类型为_______ 。
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯苯吡脲,其反应方程式为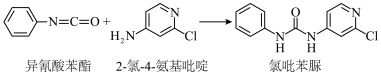
反应过程中,每生成1mol氯苯吡脲,断裂_______ 个σ键,断裂_______ 个π键。
(4)膨大剂能在动物体内代制,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为_______ 。
②NH3分子的空间结构是_______ ,H2O分子中心原子的杂化类型是_______ 。

(1)氯元素基态原子核外电子的未成对电子数为
(2)氯苯吡脲晶体中,氮原子的杂化轨道类型为
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯苯吡脲,其反应方程式为

反应过程中,每生成1mol氯苯吡脲,断裂
(4)膨大剂能在动物体内代制,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为
②NH3分子的空间结构是
您最近一年使用:0次
解题方法
3 . 回答下列问题
(1) 为IVA族元素,单质
为IVA族元素,单质 与干燥
与干燥 反应生成
反应生成 ,常温常压下
,常温常压下 为无色液体,
为无色液体, 空间构型为
空间构型为________ 。
(2)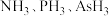 的沸点由高到低的顺序为
的沸点由高到低的顺序为________ (填化学式,下同),还原性由强到弱的顺序为________ ,键角由大到小的顺序为________ 。
(3) 是离子化合物,各原子均满足8电子稳定结构,写出
是离子化合物,各原子均满足8电子稳定结构,写出 的电子式:
的电子式:________ 。
(4)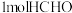 分子中含有
分子中含有 键的数目为
键的数目为________ ,一个 分子中,存在
分子中,存在________ 个 键和
键和________ 个 键。
键。
(1)
 为IVA族元素,单质
为IVA族元素,单质 与干燥
与干燥 反应生成
反应生成 ,常温常压下
,常温常压下 为无色液体,
为无色液体, 空间构型为
空间构型为(2)
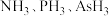 的沸点由高到低的顺序为
的沸点由高到低的顺序为(3)
 是离子化合物,各原子均满足8电子稳定结构,写出
是离子化合物,各原子均满足8电子稳定结构,写出 的电子式:
的电子式:(4)
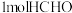 分子中含有
分子中含有 键的数目为
键的数目为 分子中,存在
分子中,存在 键和
键和 键。
键。
您最近一年使用:0次
名校
解题方法
4 . 铜及其化合物是生活、生产中运用广泛的材料。
(1)铜元素在周期表中的位置是___________ ,基态Cu原子核外电子占据最高能层的符号是___________ 。
(2)合成氨工业常用醋酸二氨合铜(Ⅰ){[Cu(NH3)2]Ac}溶液吸收对氨合成的催化剂有毒害作用的CO。NH3的沸点比PH3的沸点___________ ,原因是___________ 。H2O的键角小于NH3的键角,原因是___________ 。
(3)晶胞的两个基本要素。
①原子坐标参数:晶胞内部各微粒的相对位置,CuI的晶胞结构如图所示,其中原子坐标参数:A(0,0,0);B(1,0,0);C(1,1,1)。则D处微粒的坐标参数为___________ 。
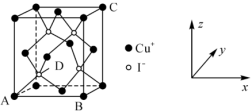
②晶胞参数:描述晶胞的大小和形状。若晶胞的边长为anm,则Cu+与I-的最短距离为___________ nm,设NA为阿伏加德罗常数的值,该化合物的密度为___________ (用含a、NA的代数式表示)g/cm3。
(4)三氟乙酸的酸性大于三氯乙酸,请解释原因___________ 。
(5)甲酸的酸性大于乙酸,原因是___________ 。
(1)铜元素在周期表中的位置是
(2)合成氨工业常用醋酸二氨合铜(Ⅰ){[Cu(NH3)2]Ac}溶液吸收对氨合成的催化剂有毒害作用的CO。NH3的沸点比PH3的沸点
(3)晶胞的两个基本要素。
①原子坐标参数:晶胞内部各微粒的相对位置,CuI的晶胞结构如图所示,其中原子坐标参数:A(0,0,0);B(1,0,0);C(1,1,1)。则D处微粒的坐标参数为

②晶胞参数:描述晶胞的大小和形状。若晶胞的边长为anm,则Cu+与I-的最短距离为
(4)三氟乙酸的酸性大于三氯乙酸,请解释原因
(5)甲酸的酸性大于乙酸,原因是
您最近一年使用:0次
5 . C、N、O、Ca、Ba、Cu、Hg等元素及其化合物在工农业生产和生活中有重要用途。请回答下列问题:
(1)基态Cu原子价层电子的轨道表示式为_______ 。
(2)基态气态原子获得一个电子变为气态一价负离子放出的能量称为第一电子亲和能。C、N、O三种元素的第一电子亲和能分别为-121 kJ·mol-1、7 kJ·mol-1、-141kJ·mol-1。请解释N元素第一电子亲和能异常的原因:_______ 。
(3)氨水的主要成分为NH3·H2O,农业上经稀释后可作化肥。
①氨水的施用原则是“一不离土,二不离水”。不离土就是要深施覆土,不离水就是加水稀释,这样做的目的是_______ 。
②NH3和H2O相比,键角较大的是_______ (填化学式),原因是_______ 。
(4)O、Ca、Ba 、Cu、Hg可以形成超导材料HBCO,晶胞结构如图所示。

①晶胞中Ba与Ca均位于体内,晶胞中与Ca距离最近的O原子 有_______ 个 ,Ca原子与Cu原子之间的最短距离为_______ pm。
②设阿伏加德罗常数的值为NA,则晶胞的密度为_______ g·cm-3。
(1)基态Cu原子价层电子的轨道表示式为
(2)基态气态原子获得一个电子变为气态一价负离子放出的能量称为第一电子亲和能。C、N、O三种元素的第一电子亲和能分别为-121 kJ·mol-1、7 kJ·mol-1、-141kJ·mol-1。请解释N元素第一电子亲和能异常的原因:
(3)氨水的主要成分为NH3·H2O,农业上经稀释后可作化肥。
①氨水的施用原则是“一不离土,二不离水”。不离土就是要深施覆土,不离水就是加水稀释,这样做的目的是
②NH3和H2O相比,键角较大的是
(4)O、Ca、Ba 、Cu、Hg可以形成超导材料HBCO,晶胞结构如图所示。

①晶胞中Ba与Ca均位于体内,晶胞中与Ca距离最近的O原子 有
②设阿伏加德罗常数的值为NA,则晶胞的密度为
您最近一年使用:0次
6 . O、S、Cl、Fe、Cu、五种元素的单质及其化合物在工农业生产和生活中有着广泛的应用。请回答下列问题:
(1)Fe元素有_______ 种不同运动状态的电子,基态Fe原子价电子的轨道表示式为_______ 。
(2)O、S、Cl的电负性由大到小的顺序是_______ (填元素符号)。
(3)O、S的最简单氢化物中键角较大的是_______ (填化学式),原因是_______ 。
(4) 的空间结构为
的空间结构为_______ 。
(5)O、Cu组成的一种化合物的晶胞结构示意图如下。
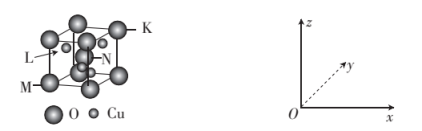
①该化合物的化学式为_______ 。
②原子坐标参数表示了晶胞内部各微粒的相对位置。若原子M、N、K的原子坐标参数分别为(0,0,0)、( ,
, ,
, )、(1,1,1),则L坐标参数为
)、(1,1,1),则L坐标参数为_______ 。
③晶胞边长:描述晶胞的大小和形状。若晶胞边长为anm,设NA为阿伏加德罗常数的值,该化合物的密度为_______ (用含a、NA的代数式表示) 。
。
(1)Fe元素有
(2)O、S、Cl的电负性由大到小的顺序是
(3)O、S的最简单氢化物中键角较大的是
(4)
 的空间结构为
的空间结构为(5)O、Cu组成的一种化合物的晶胞结构示意图如下。
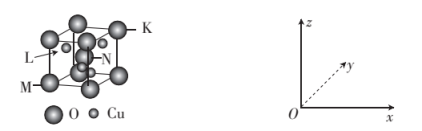
①该化合物的化学式为
②原子坐标参数表示了晶胞内部各微粒的相对位置。若原子M、N、K的原子坐标参数分别为(0,0,0)、(
 ,
, ,
, )、(1,1,1),则L坐标参数为
)、(1,1,1),则L坐标参数为③晶胞边长:描述晶胞的大小和形状。若晶胞边长为anm,设NA为阿伏加德罗常数的值,该化合物的密度为
 。
。
您最近一年使用:0次
名校
7 . 近日,南开大学化学院先进能源材料实验室发布:在缬氨酸做表面配体时制备出了一种可广泛用于电学和光学领域的新型钙钛矿型材料(CsPbBr3),该研究成果大大推进了材料化学的发展。
回答下列问题:
(1)基态Ti原子的外围电子排布式为__ ,基态Ti原子核外电子的空间运动状态有__ 种。
(2)标准大气压下,液态溴获得能量后,能发生如图所示的变化。
Br2(l)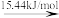 Br2(g)
Br2(g)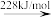 2Br(g)
2Br(g)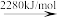 2Br+(g)
2Br+(g)
Br—Br键的键能为___ kJ/mol,Br的第一电离能为__ kJ/mol。
(3)缬氨酸的结构简式为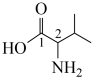 ,其中碳原子的杂化方式为
,其中碳原子的杂化方式为__ ,键角1__ 键角2(填“>”“<”或“=”)。
(4)金属钙的熔点为850℃,金属钛的熔点为1720℃,金属钛的熔点更高的原因为__ 。
(5)CsPbBr3晶胞结构如图a所示,Cs+沿晶胞体对角线的投影图如图b所示。

①Pb2+的配位数为__ ,若A原子的坐标参数为(0,0,0),B原子的坐标参数为(0,0, ),则C原子的坐标参数为
),则C原子的坐标参数为__ 。
②请在图b中画出图a晶胞中所有Br-的投影位置___ 。
③若晶胞参数为apm,NA为阿伏加德罗常数的值,则CsPbBr3晶体的密度为__ g•cm-3(用含a、NA的代数式表示,列出计算式即可)。
回答下列问题:
(1)基态Ti原子的外围电子排布式为
(2)标准大气压下,液态溴获得能量后,能发生如图所示的变化。
Br2(l)
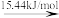 Br2(g)
Br2(g)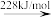 2Br(g)
2Br(g)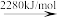 2Br+(g)
2Br+(g)Br—Br键的键能为
(3)缬氨酸的结构简式为
 ,其中碳原子的杂化方式为
,其中碳原子的杂化方式为(4)金属钙的熔点为850℃,金属钛的熔点为1720℃,金属钛的熔点更高的原因为
(5)CsPbBr3晶胞结构如图a所示,Cs+沿晶胞体对角线的投影图如图b所示。

①Pb2+的配位数为
 ),则C原子的坐标参数为
),则C原子的坐标参数为②请在图b中画出图a晶胞中所有Br-的投影位置
③若晶胞参数为apm,NA为阿伏加德罗常数的值,则CsPbBr3晶体的密度为
您最近一年使用:0次
解题方法
8 . 钴常见的化合价为+2、+3,钴及其化合物在工业上具有重要的用途。请回答下列问题:
(1)钴在元素周期表中属于___________ 区元素,与钴同周期且基态原子与基态钴原子具有相同未成对电子数的元素是___________ (填元素符号)。
(2)基态Co3+和基态Fe2+分别失去一个电子所需能量较高的是___________ (填离子符号),原因为___________ 。
(3)三氯化六氨合钴(III)是橙黄色单斜晶体,其可以通过如下反应制备:2CoCl2+10NH3+2NH4Cl+H2O2=2[Co(NH3)6]Cl3+2H2O
①H2O2中O原子的杂化方式为___________ 。
②NH3中的H-N-H的键角___________ (填“大于”或“小于”)NH 中H-N-H的键角
中H-N-H的键角
③[Co(NH3)6]Cl3中存在的作用力类型有___________ (填字母)。
A.配位键 B.极性键 C.离子键 D.非极性键 E.金属键
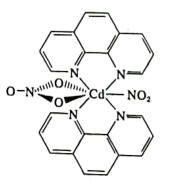
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有___________ mol,该螯合物中N的杂化方式有___________ 种。
(1)钴在元素周期表中属于
(2)基态Co3+和基态Fe2+分别失去一个电子所需能量较高的是
(3)三氯化六氨合钴(III)是橙黄色单斜晶体,其可以通过如下反应制备:2CoCl2+10NH3+2NH4Cl+H2O2=2[Co(NH3)6]Cl3+2H2O
①H2O2中O原子的杂化方式为
②NH3中的H-N-H的键角
 中H-N-H的键角
中H-N-H的键角③[Co(NH3)6]Cl3中存在的作用力类型有
A.配位键 B.极性键 C.离子键 D.非极性键 E.金属键
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有

您最近一年使用:0次
名校
解题方法
9 . [化学-选修3:物质结构与性质]
(1)丙酮(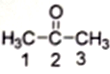 )分子中2号碳原子的杂化方式为
)分子中2号碳原子的杂化方式为__________ ;
(2)写出镍原子的电子排布式_____________ ;
(3)H2O分子的键角比NH3分子的键角小,原因是_____________________________________ ;
(4)N、P、As属于同族元素,它们的简单氢化物沸点由大到小的顺序为_________________ (用化学式表示),其原因是 ____________________________________ ;
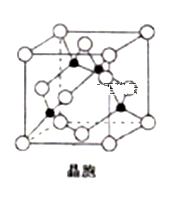
(5)由铜与氯形成的一种化合物的晶胞结构如图所示(黑点代表铜原子)。
①将晶胞内的4个黑点相互连接所形成的立体构型是______________ ;
②晶体中与一个氯原子距离最近的氯原子有___________ 个;
③已知该晶体的密度为ρg.cm-3,阿伏伽德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为____________ pm(列出计算式即可);
(1)丙酮(
 )分子中2号碳原子的杂化方式为
)分子中2号碳原子的杂化方式为(2)写出镍原子的电子排布式
(3)H2O分子的键角比NH3分子的键角小,原因是
(4)N、P、As属于同族元素,它们的简单氢化物沸点由大到小的顺序为

(5)由铜与氯形成的一种化合物的晶胞结构如图所示(黑点代表铜原子)。
①将晶胞内的4个黑点相互连接所形成的立体构型是
②晶体中与一个氯原子距离最近的氯原子有
③已知该晶体的密度为ρg.cm-3,阿伏伽德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为
您最近一年使用:0次
2018-12-17更新
|
193次组卷
|
2卷引用:【全国百强校】河北省武邑中学2019届高三上学期12月月考化学试题



