1 . 下列说法正确的是
A. 和 和 的空间结构均为平面三角形 的空间结构均为平面三角形 |
B. 、 、 都是含有极性键的非极性分子 都是含有极性键的非极性分子 |
| C.卤素氢化物的沸点随相对分子质量增大而升高 |
D.丙烯腈( )中 )中 键与 键与 键的个数比为3∶1 键的个数比为3∶1 |
您最近一年使用:0次
名校
2 . 联合国将2019年定为“国际化学元素周期表年”。元素周期表前四周期的元素a、b、c、d、e、f的原子序数依次增大。a、b、d的价电子层中未成对电子均只有1个,a的基态原子核外有3种不同能量的电子,b、d的单质均能与水剧烈反应,b-和d+核外电子数相差8,c的最外层电子数为其电子层数的2倍,补充维生素D可促进人体对元素e的吸收,f的价电子层中的未成对电子数为4.回答下列问题:
(1)a、b、c的电负性由小到大的顺序为___________ (用元素符号表示)。基态f原子的核外电子排布式为___________ 。
(2)ab3分子中心原子的杂化方式为___________ ,其键角为___________ 。
(3)c的简单氢化物与同族相邻两种元素所形成的简单氢化物沸点由高到低的顺序为___________ (用化学式表示),理由:___________ 。
(4)CO与f形成的f(CO)5常温下是一种浅黄色液体,f(CO)5的空间构型为___________ ,提供孤电子对的原子是___________ (填元素符号),CO分子中σ键与π键数目之比为___________ 。
(1)a、b、c的电负性由小到大的顺序为
(2)ab3分子中心原子的杂化方式为
(3)c的简单氢化物与同族相邻两种元素所形成的简单氢化物沸点由高到低的顺序为
(4)CO与f形成的f(CO)5常温下是一种浅黄色液体,f(CO)5的空间构型为
您最近一年使用:0次
3 . 设NA为阿伏加德罗常数的值,下列说法不正确的是
| A.1mol CH2=CH2分子中含有的共价键数为6NA |
| B.500ml0.5mol·L-1的NaCl溶液中微粒数大于0.5NA |
| C.2.3g Na与O2完全反应,反应中转移的电子数介于0.1NA和0.2NA之间 |
| D.30g HCHO与CH3COOH混合物中含C原子数为NA |
您最近一年使用:0次
名校
4 . 雄黄(As4S4,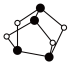 )与雌黄(As2S3)在古代均曾入药。二者可发生如图转化;NA表示阿伏加德罗常数的值,下列说法正确的是
)与雌黄(As2S3)在古代均曾入药。二者可发生如图转化;NA表示阿伏加德罗常数的值,下列说法正确的是
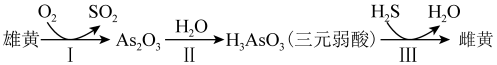
 )与雌黄(As2S3)在古代均曾入药。二者可发生如图转化;NA表示阿伏加德罗常数的值,下列说法正确的是
)与雌黄(As2S3)在古代均曾入药。二者可发生如图转化;NA表示阿伏加德罗常数的值,下列说法正确的是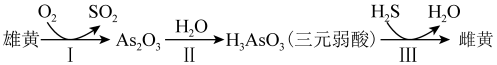
| A.1mol雄黄分子中,含有S-S非极性共价键的数目为2NA |
| B.反应I每生成22.4LSO2气体时,转移的电子数目为7NA |
| C.1mol雄黄分子中含有σ键的数目为10NA |
D.1L1mol/LNaH2AsO3溶液中,Na+、H2AsO 、AsO 、AsO 数目之和为2NA 数目之和为2NA |
您最近一年使用:0次
2022-09-19更新
|
319次组卷
|
5卷引用:山东省枣庄市第三中学2022-2023学年高三上学期期中考试化学试题
名校
解题方法
5 . 吡啶( )是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。
)是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。
 +
+ 



请回答下列问题:
(1)吡啶分子呈_______ 形;MPy 分子中碳原子的杂化方式为________ ,其组成元素的第一电离能由大到小的顺序为__________ 。
(2)EPy晶体中微粒间的作用力类型有_______ (填标号)。
a.离子键 b.金属键 c.极性键 d.非极性键 e.配位键 f.氢键
(3)反应①中每生成1 mol EPy,断裂_______ 个π键,形成______ 个 σ键。
(4)分子中的大π键可用 表示,其中m表示形成大
表示,其中m表示形成大 键的原子个数,n表示参与形成大
键的原子个数,n表示参与形成大 键的电子个数,则吡啶中大
键的电子个数,则吡啶中大 键表示为
键表示为__________ 。
(5)吡啶、Cl-与Pt2+形成二氯二吡啶合铂配合物,有顺式和反式两种同分异构体。科学研究表明,顺式分子具有抗癌活性。

Pt2+的配位数为_______ 。顺式二氯二吡啶合铂分子能否溶于水______ (填“能” 或“否”),简述理由______ 。
 )是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。
)是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。 +
+ 



请回答下列问题:
(1)吡啶分子呈
(2)EPy晶体中微粒间的作用力类型有
a.离子键 b.金属键 c.极性键 d.非极性键 e.配位键 f.氢键
(3)反应①中每生成1 mol EPy,断裂
(4)分子中的大π键可用
 表示,其中m表示形成大
表示,其中m表示形成大 键的原子个数,n表示参与形成大
键的原子个数,n表示参与形成大 键的电子个数,则吡啶中大
键的电子个数,则吡啶中大 键表示为
键表示为(5)吡啶、Cl-与Pt2+形成二氯二吡啶合铂配合物,有顺式和反式两种同分异构体。科学研究表明,顺式分子具有抗癌活性。

Pt2+的配位数为
您最近一年使用:0次
解题方法
6 . 2022年3月23日,神舟十三号航天员进行第二次太空授课,王亚平将小苏打和醋酸混合,先得到过饱和醋酸钠溶液的“液体球”,再经结晶以后得到了热的“冰球”。下列说法正确的是
A. 分子中 分子中 键和 键和 键的比例为 键的比例为 |
| B.同温度下将“液体球”溶于水可能得到醋酸钠的饱和溶液 |
| C.“液体球”中存在离子键、共价键和氢键 |
| D.结晶以后得到热的“冰球”,其形成原因是小苏打和醋酸反应过程放出热量 |
您最近一年使用:0次
解题方法
7 . 近些年,由于能源短缺问题不断加重,氨硼烷(NH3BH3)因其热稳定性好、高储氢密度等特点受到人们的关注。回答下列有关问题:
(1)氨硼烷分子中硼原子的杂化轨道类型为_______ 。
(2)已知NH3BH3分子中,与N原子相连的H呈正电性(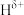 ),与B原子相连的H呈负电性(
),与B原子相连的H呈负电性(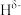 ),则N、B、H的电负性大小顺序为
),则N、B、H的电负性大小顺序为_______ ;NH3BH3分子中 之间的键角
之间的键角_______ (填“大于”“小于”或“等于”) 分子中
分子中 之间的键角。
之间的键角。
(3)氨硼烷晶体中存在的作用力有_______(填字母)。
(4)氨硼烷受热析氢的过程之一如图所示。

① 中的氮硼键键能大于
中的氮硼键键能大于 ,其原因
,其原因_______ 。
②CDB的结构简式为_______ 。
③反应Ⅳ失去 的过程中断裂的化学键数目为
的过程中断裂的化学键数目为_______ 。
(1)氨硼烷分子中硼原子的杂化轨道类型为
(2)已知NH3BH3分子中,与N原子相连的H呈正电性(
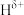 ),与B原子相连的H呈负电性(
),与B原子相连的H呈负电性(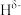 ),则N、B、H的电负性大小顺序为
),则N、B、H的电负性大小顺序为 之间的键角
之间的键角 分子中
分子中 之间的键角。
之间的键角。(3)氨硼烷晶体中存在的作用力有_______(填字母)。
| A.极性键 | B.非极性键 | C.配位键 | D.范德华力 |

①
 中的氮硼键键能大于
中的氮硼键键能大于 ,其原因
,其原因②CDB的结构简式为
③反应Ⅳ失去
 的过程中断裂的化学键数目为
的过程中断裂的化学键数目为
您最近一年使用:0次
2022-07-13更新
|
168次组卷
|
2卷引用:山东省菏泽市2021-2022学年高二下学期期末质量检测(期末联考)化学试题
解题方法
8 . 铝离子电池常用离子液体AlCl3/[EMIM]Cl作电解质,其中阴离子有AlCl 、Al2Cl
、Al2Cl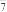 ,阳离子为EMIM+(
,阳离子为EMIM+( ),EMIM+以单个形式存在时可以获得良好的溶解性能。下列说法错误的是
),EMIM+以单个形式存在时可以获得良好的溶解性能。下列说法错误的是
 、Al2Cl
、Al2Cl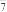 ,阳离子为EMIM+(
,阳离子为EMIM+( ),EMIM+以单个形式存在时可以获得良好的溶解性能。下列说法错误的是
),EMIM+以单个形式存在时可以获得良好的溶解性能。下列说法错误的是A.EMIM+中存在大π键,表示为π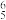 |
B.Al2Cl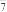 中各原子最外层均达到8电子结构 中各原子最外层均达到8电子结构 |
| C.1mol EMIM+中所含σ键17mol |
| D.为使EMIM+获得良好的溶解性,不能将与N原子相连的-CH3、-C2H5替换为H原子 |
您最近一年使用:0次
2022-07-11更新
|
671次组卷
|
2卷引用:山东省日照市2021-2022学年高二下学期期末考试化学试题
9 . 己二烯一定条件下可发生闭环反应。下列说法错误的是

| A.X分子中σ键与π键的个数比为13:2 |
| B.Y、Z互为对映异构体 |
| C.X被酸性KMnO4溶液氧化生成HOOC—COOH和CH3COOH |
| D.一定条件下X与乙烯反应生成的六元环状化合物中不含手性碳原子 |
您最近一年使用:0次
解题方法
10 . K4[Fe(CN)6]可作为食品添加剂,其受热易分解:3K4[Fe(CN)6] 12KCN+Fe3C+2(CN)2↑+N2↑+C。下列说法错误的是
12KCN+Fe3C+2(CN)2↑+N2↑+C。下列说法错误的是
 12KCN+Fe3C+2(CN)2↑+N2↑+C。下列说法错误的是
12KCN+Fe3C+2(CN)2↑+N2↑+C。下列说法错误的是| A.[Fe(CN)6]4-中铁元素的化合价是+2价 |
| B.配合物K4[Fe(CN)6]中配位原子是氮原子 |
| C.(CN)2分子中σ键和π键数目比为3:4 |
| D.已知Fe3C晶胞中每个碳原子被6个铁原子包围,则铁的配位数是2 |
您最近一年使用:0次



