名校
解题方法
1 . 下列分子或离子中,VSEPR模型和空间结构不一致 的是
| A.NCl3 | B.SO | C.BF3 | D.CO2 |
您最近一年使用:0次
解题方法
2 . 下列分子或离子中,VSEPR模型和空间结构不一致 的是
| A.CO2 | B.CH4 | C.BeCl2 | D.NH3 |
您最近一年使用:0次
3 . 硫酸镍溶于氨水形成 蓝色溶液。
蓝色溶液。
(1) 中阴离子的空间结构是
中阴离子的空间结构是_______ 。
(2)在 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为_______ ,提供孤电子对的成键原子是_______ 。
(3)向盛有少量氯化钠溶液的试管中滴入少量硝酸银溶液,再加入氨水。
①上述实验过程中观察到的现象是_______ 。
②用平衡移动的理论解释加入氨水后,现象发生变化的原因是_______ 。
 蓝色溶液。
蓝色溶液。(1)
 中阴离子的空间结构是
中阴离子的空间结构是(2)在
 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为(3)向盛有少量氯化钠溶液的试管中滴入少量硝酸银溶液,再加入氨水。
①上述实验过程中观察到的现象是
②用平衡移动的理论解释加入氨水后,现象发生变化的原因是
您最近一年使用:0次
解题方法
4 . 下列说法不正确 的是
A. 和 和 的空间构型相同 的空间构型相同 |
B. 离子的空间构型是平面三角形 离子的空间构型是平面三角形 |
| C.价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子对数 |
D. 和 和 中的N原子均采取 中的N原子均采取 杂化 杂化 |
您最近一年使用:0次
名校
解题方法
5 . 气态 分子的空间构型是
分子的空间构型是
 分子的空间构型是
分子的空间构型是| A.直线形 | B.平面三角形 | C.四面体形 | D.三角锥形 |
您最近一年使用:0次
解题方法
6 . 根据物质结构的基本理论,原子之间通过原子轨道的重叠方式,以不同类型的化学键结合,形成具有不同空间结构的分子或离子,按照已学的物质结构知识填写下列空白。
(1)在 分子中,硼原子的杂化轨道类型为
分子中,硼原子的杂化轨道类型为_______ ,F-B-F的键角是_______ , 为
为_______ 分子(极性分子或非极性分子)。
(2) 可与
可与 形成
形成 ,
, 中氧原子采用
中氧原子采用_______ 杂化。 的立体构型为
的立体构型为_______ 。
(3) 中H-O-H键角比
中H-O-H键角比 中H-O-H键角大,原因为
中H-O-H键角大,原因为_______ 。
(1)在
 分子中,硼原子的杂化轨道类型为
分子中,硼原子的杂化轨道类型为 为
为(2)
 可与
可与 形成
形成 ,
, 中氧原子采用
中氧原子采用 的立体构型为
的立体构型为(3)
 中H-O-H键角比
中H-O-H键角比 中H-O-H键角大,原因为
中H-O-H键角大,原因为
您最近一年使用:0次
解题方法
7 . 下列分子中,中心原子的杂化方式和分子的空间构型均正确的是
| A.C2H4:sp、平面形 | B.NH3:sp3、四面体 |
| C.H2O:sp3、V形 | D.CO2:sp2、直线形 |
您最近一年使用:0次
名校
解题方法
8 . 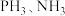 和
和 的分子空间结构和相应的键角如图所示。
的分子空间结构和相应的键角如图所示。

下列说法不正确 的是
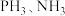 和
和 的分子空间结构和相应的键角如图所示。
的分子空间结构和相应的键角如图所示。
下列说法
| A.N、O、P都是周期表中的p区元素 |
B. 相对分子质量大于 相对分子质量大于 ,故沸点: ,故沸点: |
C. 的键角小于 的键角小于 是因为孤电子对之间的斥力更大 是因为孤电子对之间的斥力更大 |
D.上述分子中P、N、O的轨道杂化类型均为 |
您最近一年使用:0次
解题方法
9 . 电负性与电离能是两种定量描述元素原子得失电子能力的参数,请回答下列问题:
(1)非金属性强弱:O_______ Cl(填“>”或“<”)。
(2)通过分析电负性的变化规律,确定Mg元素电负性的最小范围_______ 。
(3)卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所示,已知TiF4的晶体类型与TiCl4、TiBr4、TiI4不同,下列判断不正确 的是_______ (选填字母序号)。
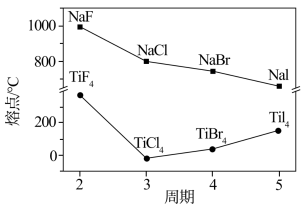
a.NaX均为离子晶体
b.随X半径增大,NaX离子键减弱,熔点逐渐降低
c.TiF4的熔点反常升高是由于氢键的作用
d.TiCl4、TiBr4、TiI4的相对分子质量依次增大,分子间作用力增大,熔点逐渐升高
(4)二氟化氧(OF2)的结构式为F—O—F,氧元素的化合价为_______ ,该分子属于_______ 分子(填“极性”或“非极性”)。
(5)已知苯可与ICl发生取代反应,利用电负性相关知识预测反应产物:_______
 +I-Cl
+I-Cl _______ + _______
_______ + _______
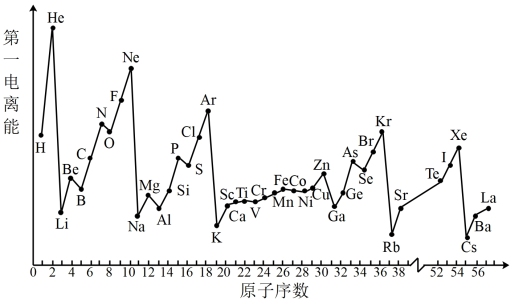
(6)随着原子序数的递增,元素气态基态原子的第一电离能呈现起伏变化,而电负性的规律性更强。结合原子核外电子排布式解释N的第一电离能比O的高的原因_______ 。
| 元素符号 | H | C | O | F | Mg | Al | Cl | Na |
| 电负性 | 2.1 | 2.5 | 3.5 | 4.0 | 1.5 | 3.0 | 0.9 |
(2)通过分析电负性的变化规律,确定Mg元素电负性的最小范围
(3)卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所示,已知TiF4的晶体类型与TiCl4、TiBr4、TiI4不同,下列判断

a.NaX均为离子晶体
b.随X半径增大,NaX离子键减弱,熔点逐渐降低
c.TiF4的熔点反常升高是由于氢键的作用
d.TiCl4、TiBr4、TiI4的相对分子质量依次增大,分子间作用力增大,熔点逐渐升高
(4)二氟化氧(OF2)的结构式为F—O—F,氧元素的化合价为
(5)已知苯可与ICl发生取代反应,利用电负性相关知识预测反应产物:
 +I-Cl
+I-Cl _______ + _______
_______ + _______(6)随着原子序数的递增,元素气态基态原子的第一电离能呈现起伏变化,而电负性的规律性更强。结合原子核外电子排布式解释N的第一电离能比O的高的原因

您最近一年使用:0次
名校
10 . 下列四种微粒的中心原子的杂化方式、VSEPR模型名称及微粒的立体构型中,有错误的是
| A.H2F+ :sp、平面三角形、直线形 |
| B.NCl3:sp3、四面体形、三角锥形 |
| C.SnBr2:sp2、平面三角形、V形 |
D.SeO :sp3、正四面体、正四面体 :sp3、正四面体、正四面体 |
您最近一年使用:0次
2022-04-22更新
|
183次组卷
|
2卷引用:北京市东直门中学2022-2023学年高二上学期期中考试化学试题



