名校
1 . 氨气是一种重要的化工原料,极易溶于水,合成氨反应为N2(g)+3H2(g)=2NH3(g)  =-92.4kJ•mol-1。下列说法正确的是
=-92.4kJ•mol-1。下列说法正确的是
 =-92.4kJ•mol-1。下列说法正确的是
=-92.4kJ•mol-1。下列说法正确的是A.键角:H2O>NH3>NH |
B.相同浓度的氨水和 溶液中,水的电离程度相同 溶液中,水的电离程度相同 |
C.合成氨反应的 =E(N≡N)+3E(H-H)-6E(N-H)(E表示键能) =E(N≡N)+3E(H-H)-6E(N-H)(E表示键能) |
| D.1molN2与足量H2发生合成氨反应,放出的热量为92.4kJ |
您最近一年使用:0次
名校
解题方法
2 . 下列化学用语或图示表达正确的是
A. 的电子式为 的电子式为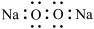 | B. 的VSEPR(价层电子对互斥)模型 的VSEPR(价层电子对互斥)模型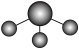 |
C.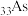 的电子排布式: 的电子排布式: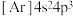 | D.中子数为10的氧原子: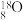 |
您最近一年使用:0次
名校
解题方法
3 . 价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是
A. 和 和 的空间构型均为直线型 的空间构型均为直线型 | B. 和 和 的价层电子对互斥模型均为四面体 的价层电子对互斥模型均为四面体 |
C. 和 和 均为非极性分子 均为非极性分子 | D. 与 与 的键角相等 的键角相等 |
您最近一年使用:0次
名校
4 . 镍、钴是重要的战略物资,但资源匮乏。一种利用酸浸出法从冶金厂废炉渣中提取镍和钴的工艺流程如下:
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)Co2+ 的价电子排布式________ , 空间构型为
空间构型为________
(2)提高“酸浸”速率的方法有_________ 。(任写一条)
(3)“滤渣1”的主要成分是_________ 。(写化学式)
(4)黄钠铁矾的化学式为Na2 Fe 6(SO4)4(OH)12,“除铁”的离子方程式为___________ 。
(5)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是________ (结合平衡理论解释)。Ca2+和Mg2+沉淀完全时,溶液中F-的浓度c(F- )最小为______ mol·L-1(已知离子浓度≤10-5 mol·L-1时,认为该离子沉淀完全,Ksp(CaF2)=1.0 ×10-10,Ksp(MgF2)=7.5×10-11)。
(6)获得NiSO4(s)的“一系列操作”是________ 。
(7)工艺流程中,可循环利用的物质是___________ 。
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)Co2+ 的价电子排布式
 空间构型为
空间构型为(2)提高“酸浸”速率的方法有
(3)“滤渣1”的主要成分是
(4)黄钠铁矾的化学式为Na2 Fe 6(SO4)4(OH)12,“除铁”的离子方程式为
(5)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是
(6)获得NiSO4(s)的“一系列操作”是
(7)工艺流程中,可循环利用的物质是
您最近一年使用:0次
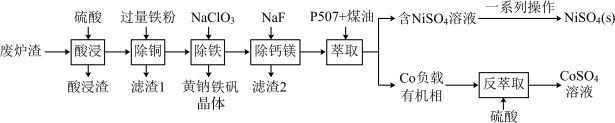
5 . 观察下列图形,判断下列说法不正确的是

| A.第三周期某元素的前5个电子的电离能如图1所示,该元素是Mg |
| B.铝镁合金是优质储钠材料,原子位于面心和顶点,其晶胞如图2所示。1个铝原子周围有8个镁原子最近且等距离 |
| C.某气态团簇分子结构如图3所示,该气态团簇分子的分子式为EF或FE |
| D.图4所示是[Zn(NH3)6]2+的部分结构,其中H-N-H键的键角比NH3的键角大,与NH3中N原子的孤电子对在该配离子中转化为成键电子对有关 |
您最近一年使用:0次
名校
解题方法
6 . 下表中各粒子对应的空间结构及解释均正确的是
| 选项 | 粒子 | 空间结构 | 解释 |
| A | 氨基负离子( ) ) | 直线形 | N原子采取 杂化 杂化 |
| B | 二氧化硫( ) ) | V形 | S原子采取 杂化 杂化 |
| C | 碳酸根离子( ) ) | 三角锥形 | C原子采取 杂化 杂化 |
| D | 乙炔( ) ) | 直线形 | C原子采取 杂化且C原子的价电子均参与成键 杂化且C原子的价电子均参与成键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-04-07更新
|
335次组卷
|
27卷引用:福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(1卷)试题
福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(1卷)试题2015-2016学年江苏省泰州中学高二下期中化学试卷四川省新津中学2019-2020学年高二下学期4月月考(入学)化学试题四川省成都外国语学校2019-2020学年高二下学期期中考试化学试题陕西省榆林市第十二中学2019-2020学年高二下学期期中考试化学试题四川绵阳南山中学双语学校2020-2021学年高二上学期10月月考化学试题湖南师范大学附属中学2020-2021学年高二上学期第三次大练习化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 B素养拓展区河南省名校联盟2020-2021学年高二下学期开学考试化学试题(已下线)2.2 分子的空间结构(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)山东省泰安市宁阳一中2020-2021学年高二下学期3月月考化学试题(已下线)作业04 分子的空间结构-2021年高二化学暑假作业(人教版2019)(已下线)2.2.2 杂化轨道理论(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)第2.2.2讲 杂化轨道理论-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)(已下线)第2章 章末综合测评B-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)专题4 分子空间结构与物质性质 专题强化练5 分子(离子)的空间结构与杂化轨道类型的判断第二节 分子的空间结构 第2课时 杂化轨道理论湖南省邵阳市新邵县2021-2022学年高二上学期期末考试化学试题天津市耀华中学2022-2023学年高二上学期期末考试化学试题陕西省武功县普集高级中学2022-2023学年高二下学期第一次月考化学试题广东省阳山县南阳中学2022-2023学年高二下学期第一次月考化学试题广东省深圳龙岗四校2022--2023学年高二下学期期中考试化学试题安徽省颍上第一中学2022-2023学年高二下学期5月月考化学试题黑龙江省大庆市肇州县第二中学2023-2024学年高二上学期12月月考化学试题湖南省岳阳市岳阳县第一中学2023-2024学年高二下学期开学化学试题四川省内江市威远县威远中学校2023-2024学年高二下学期第一次月考化学试卷四川省绵阳市东辰学校2023-2024学年高二上学期第四次月考化学试题
名校
解题方法
7 . 下列说法错误 的是
A. 与 与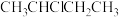 都含一个手性碳原子 都含一个手性碳原子 |
B. 和 和 的空间构型相似 的空间构型相似 |
C. 与 与 都是平面型分子 都是平面型分子 |
D. 和乙醚( 和乙醚( )都是直线型非极性分子 )都是直线型非极性分子 |
您最近一年使用:0次
2022-05-01更新
|
218次组卷
|
7卷引用:福建省莆田锦江中学2022-2023学年高二下学期期中考试化学试题
解题方法
8 . 周期表中前四周期元素R、W、X、Y、Z的原子序数依次增大。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)YX 的立体构型是
的立体构型是____________ ;与YX 互为等电子体的一种分子为
互为等电子体的一种分子为________ (填化学式)。
(2)结构简式为RX(WH2)2的化合物中R原子的杂化轨道类型为_______ ;1 mol RX(WH2)2分子中含有σ键数目为________ 。(H为氢元素,下同)
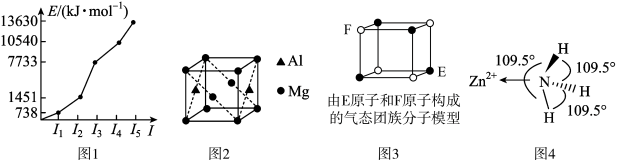
(3)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。

①该晶体的化学式为_______ 。
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于____ (填“离子”或“共价”)化合物。
③已知该晶体的密度为ρ g·cm-3,阿伏加 德罗常数的值为NA,则该晶体中Z原子和Y原子之间的最短距离为________ cm(只写计算式)(Z原子位于体对角线上)。
(1)YX
 的立体构型是
的立体构型是 互为等电子体的一种分子为
互为等电子体的一种分子为(2)结构简式为RX(WH2)2的化合物中R原子的杂化轨道类型为
(3)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。

①该晶体的化学式为
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于
③已知该晶体的密度为ρ g·cm-3,阿伏加 德罗常数的值为NA,则该晶体中Z原子和Y原子之间的最短距离为
您最近一年使用:0次
名校
解题方法
9 . 下列说法不正确的是
| A. NH4+与H3O+中心原子的价层电子对数相同 |
| B.BF3中硼原子的杂化类型与苯中碳原子的杂化类型相同 |
| C.SO2和O3互为等电子体,但两者具有不同的化学性质 |
| D. ClO2−、ClO3−、ClO4−中的氯原子都采取sp3杂化,离子中相邻两个Cl−O键间键角依次减小 |
您最近一年使用:0次
名校
解题方法
10 . 非金属及其化合物在生产、生活中应用广泛。
Ⅰ.CO2的有效利用可以缓解温室效应和能源短缺问题,CO2的分子结构决定了其性质和用途。
(1)CO2的电子式是______ ,包含的化学键类型为______ 共价键(填“非极性”或“极性”)。
(2)在温度高于31.26 oC、压强高于7.29×106 Pa时,CO2处于超临界状态,称为超临界CO2流体,可用作萃取剂提取草药中的有效成分。与用有机溶剂萃取相比,超临界CO2萃取的优点有______ (答出一点即可)。
Ⅱ.氯水以及氯的化合物经常用于饮用水的消毒。
(3)将铁片插入盛有少量新制氯水的试管中,无气泡产生,用长滴管吸取KSCN溶液滴入铁片附近,溶液变红色,然后红色消失。显红色的离子方程式为______ 。
(4)净水丸能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯净Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去。
①优氯净中氯元素的化合价为___________ 。
②亚硫酸钠将水中多余次氯酸除去的反应的化学方程式为_______________ 。
Ⅰ.CO2的有效利用可以缓解温室效应和能源短缺问题,CO2的分子结构决定了其性质和用途。
(1)CO2的电子式是
(2)在温度高于31.26 oC、压强高于7.29×106 Pa时,CO2处于超临界状态,称为超临界CO2流体,可用作萃取剂提取草药中的有效成分。与用有机溶剂萃取相比,超临界CO2萃取的优点有
Ⅱ.氯水以及氯的化合物经常用于饮用水的消毒。
(3)将铁片插入盛有少量新制氯水的试管中,无气泡产生,用长滴管吸取KSCN溶液滴入铁片附近,溶液变红色,然后红色消失。显红色的离子方程式为
(4)净水丸能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯净Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去。
①优氯净中氯元素的化合价为
②亚硫酸钠将水中多余次氯酸除去的反应的化学方程式为
您最近一年使用:0次



