解题方法
1 . 铜(Cu)、铁(Fe)、银(Ag)、镍(Ni)、钛(Ti)及其化合物在生产生活中应用广泛。
(1)基态Ni原子的外围电子排布式为___________ 。
(2)[Ag(NH3)2]+中含有的σ键数目为___________ 。
(3)配合物[Cu(NH3)4]SO4与NH3相比,H—N—H的键角前者___________ 后者(填“>”、“<”或“=”)。
(4)某镍配合物由1个 与2个
与2个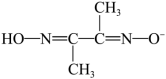 离子组成。组成该镍配合物的元素中,属于第二周期元素非金属性由高到低的顺序为
离子组成。组成该镍配合物的元素中,属于第二周期元素非金属性由高到低的顺序为___________ (用元素符号表示)。
(5)已知Ti元素的电负性为1.5,O元素的电负性为3.5,则Ti、O原子之间通过___________ 形成化合物TiO2(填“离子键”或“共价键”)。
(6)利用该纳米铁制成的改性Fe3O4是一种优良的磁性材料,该Fe3O4晶胞的 的结构如图所示,研究发现结构中的Fe2+只可能出现在图中某一“▲”所示位置上,请确定Fe2+所在晶胞的位置
的结构如图所示,研究发现结构中的Fe2+只可能出现在图中某一“▲”所示位置上,请确定Fe2+所在晶胞的位置___________ (填a或b或c)。
(1)基态Ni原子的外围电子排布式为
(2)[Ag(NH3)2]+中含有的σ键数目为
(3)配合物[Cu(NH3)4]SO4与NH3相比,H—N—H的键角前者
(4)某镍配合物由1个
 与2个
与2个 离子组成。组成该镍配合物的元素中,属于第二周期元素非金属性由高到低的顺序为
离子组成。组成该镍配合物的元素中,属于第二周期元素非金属性由高到低的顺序为(5)已知Ti元素的电负性为1.5,O元素的电负性为3.5,则Ti、O原子之间通过
(6)利用该纳米铁制成的改性Fe3O4是一种优良的磁性材料,该Fe3O4晶胞的
 的结构如图所示,研究发现结构中的Fe2+只可能出现在图中某一“▲”所示位置上,请确定Fe2+所在晶胞的位置
的结构如图所示,研究发现结构中的Fe2+只可能出现在图中某一“▲”所示位置上,请确定Fe2+所在晶胞的位置
您最近一年使用:0次
解题方法
2 . 高技术领域常使用高纯试剂。纯磷酸(熔点为42℃,易吸潮)可通过市售 磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于21℃易形成
磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于21℃易形成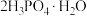 (熔点为30℃),温度高于100℃则进行分子间脱水形成焦磷酸。某兴趣小组为制备磷酸晶体设计的实验装置如图所示(加热及夹持装置已略去),回答下列问题:
(熔点为30℃),温度高于100℃则进行分子间脱水形成焦磷酸。某兴趣小组为制备磷酸晶体设计的实验装置如图所示(加热及夹持装置已略去),回答下列问题:_______ 。
(2)仪器 的名称为
的名称为_______ 。
(3)实验进行时,冷却水采用“ 进
进 出”的目的是
出”的目的是_______ 。
(4)磷酸的分子式为 :
:
① 的VSEPR模型名称为
的VSEPR模型名称为_______ 。_______ 促进其结晶。
(6)过滤磷酸晶体时,除需控制温度(30~35℃)外,还需要干燥的环境,其原因为_______ 。
 磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于21℃易形成
磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于21℃易形成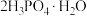 (熔点为30℃),温度高于100℃则进行分子间脱水形成焦磷酸。某兴趣小组为制备磷酸晶体设计的实验装置如图所示(加热及夹持装置已略去),回答下列问题:
(熔点为30℃),温度高于100℃则进行分子间脱水形成焦磷酸。某兴趣小组为制备磷酸晶体设计的实验装置如图所示(加热及夹持装置已略去),回答下列问题:
(2)仪器
 的名称为
的名称为(3)实验进行时,冷却水采用“
 进
进 出”的目的是
出”的目的是(4)磷酸的分子式为
 :
:①
 的VSEPR模型名称为
的VSEPR模型名称为②查阅资料可知,磷酸分子( )中三个氢原子都可以和重水(
)中三个氢原子都可以和重水( )中的D原子进行交换,又知次磷酸(
)中的D原子进行交换,又知次磷酸( )也能跟
)也能跟 进行氢交换,次磷酸钠(
进行氢交换,次磷酸钠( )却不能再跟
)却不能再跟 进行氢交换,由此可推断出次磷酸分子的结构是
进行氢交换,由此可推断出次磷酸分子的结构是
③查阅资料可知,焦磷酸( )的酸性强于磷酸,原因为
)的酸性强于磷酸,原因为
(6)过滤磷酸晶体时,除需控制温度(30~35℃)外,还需要干燥的环境,其原因为
您最近一年使用:0次
2024-07-16更新
|
27次组卷
|
2卷引用:湖南省湘西土家族苗族自治州2023-2024学年高二下学期期末考试化学试卷
3 .  是一种光催化材料。工业上利用某废催化剂(主要含 V2O5、Bi2O3、NiO 及少量
是一种光催化材料。工业上利用某废催化剂(主要含 V2O5、Bi2O3、NiO 及少量  制备
制备  的工艺流程如图所示。
的工艺流程如图所示。
Ⅱ. 溶液的pH=1.0;
溶液的pH=1.0;
Ⅲ. (有机层)
(有机层) VOR2(有机层)+2H+。
VOR2(有机层)+2H+。
回答下列问题:
(1)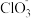 的 VSEPR模型的名称为
的 VSEPR模型的名称为_________ 。
(2)“浸出”时,Al2O3发生反应的离子方程式为__________________ 。
(3)“酸化”后的溶液中存在VO ,则“还原”时发生反应的离子方程式为
,则“还原”时发生反应的离子方程式为__________________ 。
(4)若“萃取”“反萃取”的过程中钒的总回收率为90%,则“还原”时加入的 和“氧化”时加入的NaClO3的物质的量之比为
和“氧化”时加入的NaClO3的物质的量之比为________ 。
(5)生成 BiVO4的化学方程式为________ 。
(6)NiO的晶胞结构和NaCl的相似。
①从 NiO晶胞中能分割出来的结构图有________ (填标号)。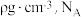 为阿伏加德罗常数的值。NiO晶胞中镍离子周围与其等距离且最近的镍离子有
为阿伏加德罗常数的值。NiO晶胞中镍离子周围与其等距离且最近的镍离子有_________ 个,该距离为_________ (用含ρ和)  的代数式表示) pm。
的代数式表示) pm。
 是一种光催化材料。工业上利用某废催化剂(主要含 V2O5、Bi2O3、NiO 及少量
是一种光催化材料。工业上利用某废催化剂(主要含 V2O5、Bi2O3、NiO 及少量  制备
制备  的工艺流程如图所示。
的工艺流程如图所示。
Ⅱ.
 溶液的pH=1.0;
溶液的pH=1.0;Ⅲ.
 (有机层)
(有机层) VOR2(有机层)+2H+。
VOR2(有机层)+2H+。回答下列问题:
(1)
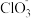 的 VSEPR模型的名称为
的 VSEPR模型的名称为(2)“浸出”时,Al2O3发生反应的离子方程式为
(3)“酸化”后的溶液中存在VO
 ,则“还原”时发生反应的离子方程式为
,则“还原”时发生反应的离子方程式为(4)若“萃取”“反萃取”的过程中钒的总回收率为90%,则“还原”时加入的
 和“氧化”时加入的NaClO3的物质的量之比为
和“氧化”时加入的NaClO3的物质的量之比为(5)生成 BiVO4的化学方程式为
(6)NiO的晶胞结构和NaCl的相似。
①从 NiO晶胞中能分割出来的结构图有
a.  b.
b.  c.
c. d.
d.  e
e
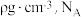 为阿伏加德罗常数的值。NiO晶胞中镍离子周围与其等距离且最近的镍离子有
为阿伏加德罗常数的值。NiO晶胞中镍离子周围与其等距离且最近的镍离子有 的代数式表示) pm。
的代数式表示) pm。
您最近一年使用:0次
2024-07-03更新
|
71次组卷
|
3卷引用:河北省邯郸市2023-2024学年高二下学期期末考试化学试题
真题
名校
4 .  是一种高活性的人工固氮产物,其合成反应为
是一种高活性的人工固氮产物,其合成反应为 ,晶胞如图所示,下列说法错误的是
,晶胞如图所示,下列说法错误的是
 是一种高活性的人工固氮产物,其合成反应为
是一种高活性的人工固氮产物,其合成反应为 ,晶胞如图所示,下列说法错误的是
,晶胞如图所示,下列说法错误的是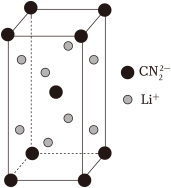
A.合成反应中,还原剂是 和C 和C |
B.晶胞中含有的 个数为4 个数为4 |
C.每个 周围与它最近且距离相等的 周围与它最近且距离相等的 有8个 有8个 |
D. 为V型结构 为V型结构 |
您最近一年使用:0次
2024-06-24更新
|
3013次组卷
|
8卷引用:河北省石家庄市第十七中学2023-2024学年高二下学期期末考试化学试题
河北省石家庄市第十七中学2023-2024学年高二下学期期末考试化学试题2024年湖南高考真题化学试题(已下线)11物质结构与元素周期律(已下线)选择题11-14(已下线)2024年高考化学真题完全解读(湖南卷)(课件+讲义)(已下线)专题五 晶胞的计算(练)(已下线)专题10 物质结构与性质 元素推断-备战2025年高考化学真题题源解密(新高考通用)(已下线)第04讲 晶体结构与性质(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
5 . 氮和氧是构建化合物的常见元素。
(1)某化合物的晶胞如图,其化学式是_______ ,晶体类型是_______ 。
(2)下列说法正确的是_______。
(3)① ,其中
,其中 的N原子杂化方式为
的N原子杂化方式为_______ ;比较键角 中的
中的
_______  中的
中的 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由_______ 。
②将 与
与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是
按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 。比较氧化性强弱:
。比较氧化性强弱:
_______  (填“>”、“<”或“=”);写出A中阴离子的结构式
(填“>”、“<”或“=”);写出A中阴离子的结构式_______ 。
已知: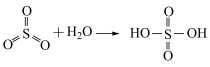
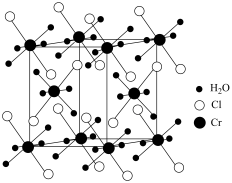
(1)某化合物的晶胞如图,其化学式是
(2)下列说法正确的是_______。
A.电负性: | B.离子半径: |
C.第一电离能: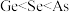 | D.基态 2+的简化电子排布式: 2+的简化电子排布式: |
(3)①
 ,其中
,其中 的N原子杂化方式为
的N原子杂化方式为 中的
中的
 中的
中的 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由②将
 与
与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是
按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 。比较氧化性强弱:
。比较氧化性强弱:
 (填“>”、“<”或“=”);写出A中阴离子的结构式
(填“>”、“<”或“=”);写出A中阴离子的结构式
您最近一年使用:0次
2024-02-02更新
|
4650次组卷
|
8卷引用:四川省成都市锦江区嘉祥外国语高级中学2023-2024学年高二下学期期末考试化学试题
四川省成都市锦江区嘉祥外国语高级中学2023-2024学年高二下学期期末考试化学试题浙江省余姚中学2023-2024学年高二下学期期中考试化学试题(已下线)暑假作业05 以元素“位一构一性”突破元素周期表、周期律-【暑假分层作业】2024年高二化学暑假培优练(2025届一轮复习通用)(已下线)暑假作业16 掌握物质结构与性质综合题-【暑假分层作业】2024年高二化学暑假培优练(2025届一轮复习通用)2024年浙江高考真题化学(1月)(已下线)T17-结构与性质(已下线)2024年高考化学真题完全解读(浙江1月卷)(讲义+课件)(已下线)12物质结构与性质综合
名校
解题方法
6 . 铜的单质及其化合物在工农业、国防、科技等领域具有广泛应用。回答下列问题:
(1)基态Cu+的价层电子排布式为_______ 。
_______ (填“ ”或“
”或“ ”)
”)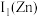 ,原因是
,原因是_______ 。
(2)研究发现,阳离子的颜色与未成对电子数有关。例如:Cu2+、Fe2+、Fe3+等。Cu+呈无色,其原因是_______ 。
(3)合成氨工业中,铜(I)氨溶液常用于除去原料气(N2和H2等)中少量的CO,发生的化学反应为: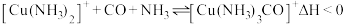 。
。
①NH3分子中N原子的杂化轨道类型是_______ ,NH3和[Cu(NH3)4]2+中H-N-H键角的大小:NH3_______ [Cu(NH3)4]2+ (填“ ”或“
”或“ ”)。
”)。
②铜(Ⅰ)氨液吸收CO适宜的生产条件是_______ (填序号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
③[Cu(NH3)3CO]+配离子中配体是_______ 。
(4)CuCl2与乙二胺(H2NCH2CH2NH2)可形成配离子[Cu(En)2]2+ (En是乙二胺的简写),其结构简式如图所示:_______ 。
②配合物[Cu(En)2]Cl2中不存在的作用力类型有_______ (填选项字母)。
A.配位键 B.极性键 C.离子键 D.非极性键 E.范德华力 F.金属键
(5)金属合金MgCux的结构可看作以Cu4四面体(相互共用顶点)替换立方金刚石结构中的碳原子,形成三维骨架,在晶胞空隙处,有序地放置Mg原子(四面体的4个顶点代表Cu原子,圆球代表Mg原子),结构如图所示。
_______ 。
②若Mg原子A的原子坐标为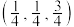 ,则C的原子坐标为
,则C的原子坐标为_______ 。
③晶胞参数为 ,则AB原子之间的距离为
,则AB原子之间的距离为_______ nm。
(1)基态Cu+的价层电子排布式为
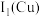
 ”或“
”或“ ”)
”)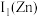 ,原因是
,原因是(2)研究发现,阳离子的颜色与未成对电子数有关。例如:Cu2+、Fe2+、Fe3+等。Cu+呈无色,其原因是
(3)合成氨工业中,铜(I)氨溶液常用于除去原料气(N2和H2等)中少量的CO,发生的化学反应为:
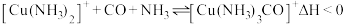 。
。①NH3分子中N原子的杂化轨道类型是
 ”或“
”或“ ”)。
”)。②铜(Ⅰ)氨液吸收CO适宜的生产条件是
A.高温高压 B.高温低压 C.低温高压 D.低温低压
③[Cu(NH3)3CO]+配离子中配体是
(4)CuCl2与乙二胺(H2NCH2CH2NH2)可形成配离子[Cu(En)2]2+ (En是乙二胺的简写),其结构简式如图所示:
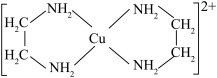
②配合物[Cu(En)2]Cl2中不存在的作用力类型有
A.配位键 B.极性键 C.离子键 D.非极性键 E.范德华力 F.金属键
(5)金属合金MgCux的结构可看作以Cu4四面体(相互共用顶点)替换立方金刚石结构中的碳原子,形成三维骨架,在晶胞空隙处,有序地放置Mg原子(四面体的4个顶点代表Cu原子,圆球代表Mg原子),结构如图所示。


②若Mg原子A的原子坐标为
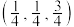 ,则C的原子坐标为
,则C的原子坐标为③晶胞参数为
 ,则AB原子之间的距离为
,则AB原子之间的距离为
您最近一年使用:0次
2023-07-16更新
|
702次组卷
|
2卷引用:广东省广州市第二中学2022-2023学年高二下学期期末考试化学试题
解题方法
7 . 类比法是一种学习化学的重要方法,下列类比合理的是
| 选项 | 已知 | 类比 |
| A |  与水反应生成乙炔 与水反应生成乙炔 | 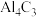 与水反应生成丙炔 与水反应生成丙炔 |
| B |  酸性强于 酸性强于 |  酸性强于 酸性强于 |
| C | 非金属性: | 第一电离能: |
| D |  为V形分子 为V形分子 |  为三角锥形分子 为三角锥形分子 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
8 . 在催化剂作用下,环己酮氧化反应的可能机理如图所示。下列说法正确的是
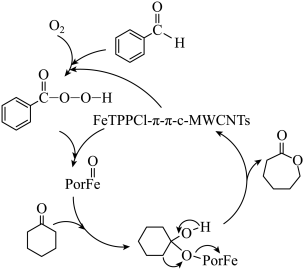
| A.产物中环上O原子的VSEPR模型为角形 |
B.用 代替环己酮所得产物为 代替环己酮所得产物为 |
C.每消耗 环己酮,转移电子数为 环己酮,转移电子数为 |
| D.用丙酮代替环己酮所得产物为乙酸甲酯 |
您最近一年使用:0次
名校
解题方法
9 .  (砒霜)是两性氧化物,分子结构如图所示,与盐酸反应能生成
(砒霜)是两性氧化物,分子结构如图所示,与盐酸反应能生成 ,
, 和
和 反应的产物之一为
反应的产物之一为 。下列说法错误的是
。下列说法错误的是
 (砒霜)是两性氧化物,分子结构如图所示,与盐酸反应能生成
(砒霜)是两性氧化物,分子结构如图所示,与盐酸反应能生成 ,
, 和
和 反应的产物之一为
反应的产物之一为 。下列说法错误的是
。下列说法错误的是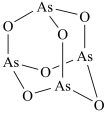
A. 分子中As原子的杂化方式为 分子中As原子的杂化方式为 |
B. 的分子空间构型为平面正三角形 的分子空间构型为平面正三角形 |
C. 的价层电子对互斥模型是四面体形 的价层电子对互斥模型是四面体形 |
D. 分子的键角小于 分子的键角小于 |
您最近一年使用:0次
2023-07-06更新
|
596次组卷
|
5卷引用:江西省吉安市2022-2023学年高二下学期6月期末考试化学试题
解题方法
10 . 含硅化合物在生活中的应用非常广泛。请回答下列问题:
(1)祖母绿宝石的主要成分化学式为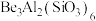 ,
, 与
与 的第一电离能大小关系为:
的第一电离能大小关系为:
___________ 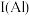 。
。
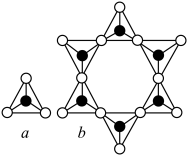
(2)硅酸盐的阴离子结构丰富多样,有些是有限数目的硅氧四面体构建的简单阴离子,如图所示,最简单的硅酸盐阴离子a的化学式为 ,则六元环状硅酸盐阴离子b的化学式是
,则六元环状硅酸盐阴离子b的化学式是___________ (不能用最简式表示)。
(3)工业制备高纯硅,先用焦炭在电炉中将石英还原为粗硅,再将粗硅与 在300℃反应生成
在300℃反应生成 ,氯原子的价层电子排布式为
,氯原子的价层电子排布式为___________ , 的空间构型为
的空间构型为___________ 。
(4)硅的各种卤化物的沸点如下表,沸点依次升高的原因是___________ 。
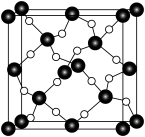
(5)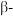 石英是晶质石英(
石英是晶质石英( )的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为
)的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为___________ ,请用价层电子对互斥模型解释图中键角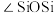 并不是
并不是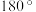 的原因是
的原因是___________ 。
(1)祖母绿宝石的主要成分化学式为
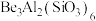 ,
, 与
与 的第一电离能大小关系为:
的第一电离能大小关系为:
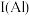 。
。(2)硅酸盐的阴离子结构丰富多样,有些是有限数目的硅氧四面体构建的简单阴离子,如图所示,最简单的硅酸盐阴离子a的化学式为
 ,则六元环状硅酸盐阴离子b的化学式是
,则六元环状硅酸盐阴离子b的化学式是
(3)工业制备高纯硅,先用焦炭在电炉中将石英还原为粗硅,再将粗硅与
 在300℃反应生成
在300℃反应生成 ,氯原子的价层电子排布式为
,氯原子的价层电子排布式为 的空间构型为
的空间构型为(4)硅的各种卤化物的沸点如下表,沸点依次升高的原因是
 |  | 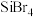 |  | |
| 沸点/K | 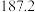 | 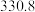 | 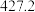 | 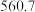 |
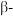 石英是晶质石英(
石英是晶质石英( )的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为
)的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为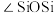 并不是
并不是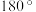 的原因是
的原因是
您最近一年使用:0次



