名校
1 . 回答下列问题:
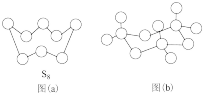
(1)图(a)为 的结构,其硫原子的杂化轨道类型为
的结构,其硫原子的杂化轨道类型为___________ 。
(2)气态三氧化硫以单分子形式存在,其分子的空间结构为___________ ;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为___________ 。
(3) 分子中所有原子均满足8电子构型,
分子中所有原子均满足8电子构型, 分子中
分子中 键和
键和 键的个数比为
键的个数比为___________ ,中心原子的杂化方式为___________ 。
(4) 的分子结构如图所示,其中
的分子结构如图所示,其中 原子的杂化方式为
原子的杂化方式为___________ 。
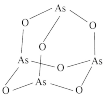
(5) 中,
中, 原子的轨道杂化方式为
原子的轨道杂化方式为___________ 。

(1)图(a)为
 的结构,其硫原子的杂化轨道类型为
的结构,其硫原子的杂化轨道类型为(2)气态三氧化硫以单分子形式存在,其分子的空间结构为
(3)
 分子中所有原子均满足8电子构型,
分子中所有原子均满足8电子构型, 分子中
分子中 键和
键和 键的个数比为
键的个数比为(4)
 的分子结构如图所示,其中
的分子结构如图所示,其中 原子的杂化方式为
原子的杂化方式为
(5)
 中,
中, 原子的轨道杂化方式为
原子的轨道杂化方式为
您最近一年使用:0次
2023-03-14更新
|
782次组卷
|
2卷引用:山东省曹县第一中学2022-2023学年高二下学期2月月考化学试题
名校
解题方法
2 . Zn、V、Cu、In、S和Se等原子是生物医药、太阳能电池等领域的理想荧光材料。回答下列问题:
(1)49In的价层电子排布式为_______ 。
(2)Zn、O、S和Se的电负性由大到小的顺序为_______ 。制备荧光材料过程中会产生少量SO 、VO
、VO ,其中V原子采用
,其中V原子采用_______ 杂化,VO 空间结构为
空间结构为_______ ,SO 的空间构型为
的空间构型为_______ 。
(3)C、N、S分别与H形成的简单氢化物中键角最小的是_______ ,其原因是_______ 。
(4)H、C、N、S四种元素可形成硫氰酸(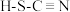 )和异硫氰酸(H-N=C=S),异硫氰酸分子中σ键与π键的数目比为
)和异硫氰酸(H-N=C=S),异硫氰酸分子中σ键与π键的数目比为_______ ,异硫氰酸沸点较高,原因是_______ 。
(5)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用−
表示,与之相反的用− 表示,称为电子的自旋量子数。对于基态Cu原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋量子数。对于基态Cu原子,其价电子自旋磁量子数的代数和为_______ 。
(1)49In的价层电子排布式为
(2)Zn、O、S和Se的电负性由大到小的顺序为
 、VO
、VO ,其中V原子采用
,其中V原子采用 空间结构为
空间结构为 的空间构型为
的空间构型为(3)C、N、S分别与H形成的简单氢化物中键角最小的是
(4)H、C、N、S四种元素可形成硫氰酸(
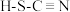 )和异硫氰酸(H-N=C=S),异硫氰酸分子中σ键与π键的数目比为
)和异硫氰酸(H-N=C=S),异硫氰酸分子中σ键与π键的数目比为(5)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用−
表示,与之相反的用− 表示,称为电子的自旋量子数。对于基态Cu原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋量子数。对于基态Cu原子,其价电子自旋磁量子数的代数和为
您最近一年使用:0次
3 . 自然界中不存在氟的单质,得到单质氟的过程中,不少科学家为此献出了宝贵的生命.1886年,法国化学家莫瓦桑发明了莫氏电炉,用电解法成功地制取了单质氟,因此荣获1906年诺贝尔化学奖,氟及其化合物在生产及生活中有着广泛的用途。
请回答下列问题:
(1)氟磷灰石可用于制取磷肥,其中 原子的L层电子排布式为
原子的L层电子排布式为_______ .基态P原子有_______ 个未成对电子, 的中心P原子的杂化方式为
的中心P原子的杂化方式为_______ 。
(2)氟气可以用于制取情性强于 的保护气
的保护气 ,也可以用于制取聚合反应的催化剂
,也可以用于制取聚合反应的催化剂 ,
, 可以作为工业制取硅单质的中间物质(
可以作为工业制取硅单质的中间物质( )的原料。
)的原料。
① 分子的空间结构为
分子的空间结构为_______ 。
②S、P、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为_______ 。
(3)氟气可以用于制取高化学稳定性材料聚四氟乙烯的原料四氟乙烯,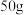 四氟乙烯含
四氟乙烯含 键的数目为
键的数目为_______
(4)工业上电解 制取单质铝,常利用冰晶石
制取单质铝,常利用冰晶石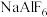 降低
降低 的熔点.
的熔点. 、
、 、F的电负性由小到大的顺序为
、F的电负性由小到大的顺序为_______ ,工业上不用电解 制取铝的原因为
制取铝的原因为_______ 。
请回答下列问题:
(1)氟磷灰石可用于制取磷肥,其中
 原子的L层电子排布式为
原子的L层电子排布式为 的中心P原子的杂化方式为
的中心P原子的杂化方式为(2)氟气可以用于制取情性强于
 的保护气
的保护气 ,也可以用于制取聚合反应的催化剂
,也可以用于制取聚合反应的催化剂 ,
, 可以作为工业制取硅单质的中间物质(
可以作为工业制取硅单质的中间物质( )的原料。
)的原料。①
 分子的空间结构为
分子的空间结构为②S、P、
 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为(3)氟气可以用于制取高化学稳定性材料聚四氟乙烯的原料四氟乙烯,
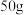 四氟乙烯含
四氟乙烯含 键的数目为
键的数目为(4)工业上电解
 制取单质铝,常利用冰晶石
制取单质铝,常利用冰晶石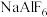 降低
降低 的熔点.
的熔点. 、
、 、F的电负性由小到大的顺序为
、F的电负性由小到大的顺序为 制取铝的原因为
制取铝的原因为
您最近一年使用:0次
2021-02-06更新
|
1175次组卷
|
4卷引用:山东省烟台市华夏学校2021-2022学年高二上学期期中考试化学试题
4 . 我国硒含量居世界首位,硒广泛用于冶金、陶瓷、电子、太阳能等领域。工业上常将含硒废料处理得到亚硒酸(H2SeO3)进而制备单质硒。
(1)工业上在103℃的条件下,用甲酸(HCOOH)还原含亚硒酸(H2SeO3)的工业废液提取硒,此反应的化学方程式为___________ 。
(2)研究表明,电解亚硒酸钠(Na2SeO3)、聚乙二醇和盐酸混合液也可直接制得单质硒,写出电解时阴极上发生的电极反应___________ 。
(3)基态Se原子电子占据最高能级的电子云轮廓图为___________ 形。 号的空间结构为
号的空间结构为___________ 形。
(4)关于硒单质及其化合物说法正确的是___________ (填标号)。
a.硒单质在常温下呈固态 b. 既有氧化性又有还原性
既有氧化性又有还原性
c.键角: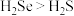 d.
d. 的最高价氧化物对应水化物的化学式为
的最高价氧化物对应水化物的化学式为
(5)室温下, 电离平衡体系中含
电离平衡体系中含 微粒的物质的量分数与溶液
微粒的物质的量分数与溶液 的关系如图所示,回答下列问题:
的关系如图所示,回答下列问题:

 的
的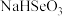 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为___________ ,计算反应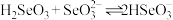 的平衡常数K=
的平衡常数K=___________ 。
(1)工业上在103℃的条件下,用甲酸(HCOOH)还原含亚硒酸(H2SeO3)的工业废液提取硒,此反应的化学方程式为
(2)研究表明,电解亚硒酸钠(Na2SeO3)、聚乙二醇和盐酸混合液也可直接制得单质硒,写出电解时阴极上发生的电极反应
(3)基态Se原子电子占据最高能级的电子云轮廓图为
 号的空间结构为
号的空间结构为(4)关于硒单质及其化合物说法正确的是
a.硒单质在常温下呈固态 b.
 既有氧化性又有还原性
既有氧化性又有还原性c.键角:
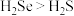 d.
d. 的最高价氧化物对应水化物的化学式为
的最高价氧化物对应水化物的化学式为
(5)室温下,
 电离平衡体系中含
电离平衡体系中含 微粒的物质的量分数与溶液
微粒的物质的量分数与溶液 的关系如图所示,回答下列问题:
的关系如图所示,回答下列问题:
 的
的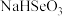 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为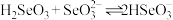 的平衡常数K=
的平衡常数K=
您最近一年使用:0次
名校
5 . 回答下列问题。
(1) 中,
中, 的轨道杂化方式为
的轨道杂化方式为___________ ;列举与 空间结构相同的一种离子和一种分子:
空间结构相同的一种离子和一种分子:___________ 、___________ (填化学式)。
(2)用价电子对互斥理论推断 分子中,
分子中, 原子的轨道杂化方式为
原子的轨道杂化方式为___________ , 分子中
分子中 的键角
的键角___________  (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。
(3)下列物质中具有旋光性的是___________(填标号)。
(1)
 中,
中, 的轨道杂化方式为
的轨道杂化方式为 空间结构相同的一种离子和一种分子:
空间结构相同的一种离子和一种分子:(2)用价电子对互斥理论推断
 分子中,
分子中, 原子的轨道杂化方式为
原子的轨道杂化方式为 分子中
分子中 的键角
的键角 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。(3)下列物质中具有旋光性的是___________(填标号)。
A.乙醇( ) ) | B.1,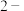 二氧丙烷( 二氧丙烷( ) ) |
C.乙酸( ) ) | D.乳酸(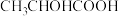 ) ) |
您最近一年使用:0次
6 . 回答下列问题:
(1)两种有机物的相关数据如表:
HCON(CH3)2的相对分子质量比HCONH2的大,但其沸点反而比HCONH2的低,主要原因是_______ 。
(2)四种晶体的熔点数据如表:
CF4和SiF4熔点相差较小,BF3和AlF3熔点相差较大,原因是_______ 。
(3)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_______ 。
(4)气态三氧化硫以单分子形式存在,其分子的空间结构为_______ 形,其中共价键的类型有_______ 种;固体三氧化硫中存在如图所示的三聚分子,该分子中S原子的杂化轨道类型为_______ 。

(1)两种有机物的相关数据如表:
| 物质 | HCON(CH3)2 | HCONH2 |
| 相对分子质量 | 73 | 45 |
| 沸点/℃ | 153 | 220 |
HCON(CH3)2的相对分子质量比HCONH2的大,但其沸点反而比HCONH2的低,主要原因是
(2)四种晶体的熔点数据如表:
| 物质 | CF4 | SiF4 | BF3 | AlF3 |
| 熔点/℃ | -183 | -90 | -127 | >1000 |
CF4和SiF4熔点相差较小,BF3和AlF3熔点相差较大,原因是
(3)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是
(4)气态三氧化硫以单分子形式存在,其分子的空间结构为

您最近一年使用:0次
解题方法
7 . 根据所学物质结构知识,回答下列问题:
(1)氮元素是植物生长所需的元素,常见氮肥有铵盐(NH4+)、尿素 (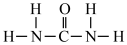 )等,NH4+中H-N-H键角
)等,NH4+中H-N-H键角_______ (填“>”“<”或“=”)。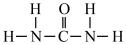 中N-C-N键角。
中N-C-N键角。
(2)硫元素和人类的生存与发展联系密切,在战国时期,我国的炼丹家们就开始了对硫单质及含硫化合物的研究应用。硫单质有多种同素异形体,其中一种单质分子(S8)的结构为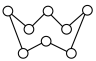 ,其熔点和沸点要比二氧化硫的高很多,主要原因为
,其熔点和沸点要比二氧化硫的高很多,主要原因为___________ 。气态三氧化硫以单分子形式存在,其分子的立体构型为____ 形,实验测得三种氧化物的熔沸点如下,推测固态三氧化硫的分子式为____________ 。
(3)在气体分析中,常用CuCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2CuCl+2CO+2H2O=Cu2Cl2·2CO·2H2O;Cu2Cl2·2CO·2H2O是一种配合物,其结构如图所示:
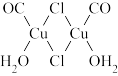
①H2O中氧原子的杂化方式为_____________ ;
②该配合物中,CO作配体时配位原子是C而不是O的原因是______________ 。
(1)氮元素是植物生长所需的元素,常见氮肥有铵盐(NH4+)、尿素 (
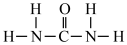 )等,NH4+中H-N-H键角
)等,NH4+中H-N-H键角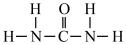 中N-C-N键角。
中N-C-N键角。(2)硫元素和人类的生存与发展联系密切,在战国时期,我国的炼丹家们就开始了对硫单质及含硫化合物的研究应用。硫单质有多种同素异形体,其中一种单质分子(S8)的结构为
 ,其熔点和沸点要比二氧化硫的高很多,主要原因为
,其熔点和沸点要比二氧化硫的高很多,主要原因为| P4O10 | 三氧化硫 | Cl2O7 | |
| 熔点 | 613K | 289K | 182K |
| 沸点 | 633K | 317K | 355K |
(3)在气体分析中,常用CuCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2CuCl+2CO+2H2O=Cu2Cl2·2CO·2H2O;Cu2Cl2·2CO·2H2O是一种配合物,其结构如图所示:

①H2O中氧原子的杂化方式为
②该配合物中,CO作配体时配位原子是C而不是O的原因是
您最近一年使用:0次
名校
8 . 前四周期元素X、Y、Z、W原子序数依次增大,X和Z同主族,基态Y原子核外电子的运动状态有9种,基态Z原子4p能级上有三个单电子,常温下W2是一种深红棕色液体。回答下列问题:
(1)基态W原子的价电子排布式为_______ ,基态X、Z原子核外电子的空间运动状态数之比为_______ 。
(2)同周期第一电离能小于X的元素有_______ 种。
(3)键角大小:XY3_______ ZY3(填“>”“=”或“<”,下同),原子半径大小:W_______ Z。
(4)ZY5中Z的价层电子对数为_______ 。
(1)基态W原子的价电子排布式为
(2)同周期第一电离能小于X的元素有
(3)键角大小:XY3
(4)ZY5中Z的价层电子对数为
您最近一年使用:0次
9 . 碳族元素包括:C、Si、 Ge、 Sn、Pb。
(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过____ 杂化与周围碳原子成键,多层碳纳米管的层与层之间靠____ 结合在一起。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为____ 。
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角___ 120°(填“>”“<”或“=”)。
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为_______ ,每个Ba2+与____ 个O2-配位。
(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为
您最近一年使用:0次
2019-01-30更新
|
964次组卷
|
7卷引用:2010年普通高等学校招生全国统一考试理综化学部分(山东卷)
解题方法
10 . 按要求回答下列问题。
(1)下列基态原子或离子的电子排布式或轨道表示式正确的是_______ (填序号,下同),违反能量最低原理的是_______ ,违反泡利不相容原理的是_______ ,违反洪特规则的是_______ 。
①Si:
②Al:
③Co3+最外层:
④Mg2+:1s22s22p6
⑤Sc:1s22s22p63s23p63d3
⑥Cr:1s22s22p63s23p63d54s1
(2)物质:①甲烷 ②硫化氢 ③氢氧化镁 ④氨气 ⑤乙烯
(1)下列基态原子或离子的电子排布式或轨道表示式正确的是
①Si:

②Al:

③Co3+最外层:

④Mg2+:1s22s22p6
⑤Sc:1s22s22p63s23p63d3
⑥Cr:1s22s22p63s23p63d54s1
(2)物质:①甲烷 ②硫化氢 ③氢氧化镁 ④氨气 ⑤乙烯
| 条件 | 符合条件物质的序号 |
| 既含极性键又含非极性键 | |
| 含有极性键的极性分子 | |
| 上述分子中键角由大到小的顺序 |
您最近一年使用:0次



