名校
解题方法
1 . 2022年9月9日,国家航天局、国家原子能机构联合在北京发布嫦娥五号最新科学成果,中核集团核工业北京地质研究院科研团队首次在月球上发现的新矿物,被命名为“嫦娥石”,我国成为世界上第三个在月球发现新矿物的国家。
回答下列问题:
(1)中核集团核工业北京地质研究院科研团队,通过晶体___________ 实验等一系列高新技术手段,成功解译其晶体结构。
(2)嫦娥石是一种陨磷钠镁钙石类矿物,基态P、Na、Mg、Ca四种元素的原子第一电离能由大到小的顺序为___________ 。
(3)从晶体结构上看,嫦娥石可以分为两大部分,其中阴离子结构单元为[Fe(PO4)6]16-,请写出Fe2+的基态价层电子排布式___________ ,PO 的VSEPR模型名称为
的VSEPR模型名称为___________ 。
(4)从结构角度分析Fe3+比Fe2+稳定的原因___________ 。
(5)嫦娥石的一种伴生矿物为方石英,方石英结构和金刚石相似,其晶胞结构如图所示,Si-O键长为anm,∠AED=109°28′,已知阿伏伽德罗常数为NA,则方石英晶体的的密度为___________ g·cm-3(列出计算式即可)。

回答下列问题:
(1)中核集团核工业北京地质研究院科研团队,通过晶体
(2)嫦娥石是一种陨磷钠镁钙石类矿物,基态P、Na、Mg、Ca四种元素的原子第一电离能由大到小的顺序为
(3)从晶体结构上看,嫦娥石可以分为两大部分,其中阴离子结构单元为[Fe(PO4)6]16-,请写出Fe2+的基态价层电子排布式
 的VSEPR模型名称为
的VSEPR模型名称为(4)从结构角度分析Fe3+比Fe2+稳定的原因
(5)嫦娥石的一种伴生矿物为方石英,方石英结构和金刚石相似,其晶胞结构如图所示,Si-O键长为anm,∠AED=109°28′,已知阿伏伽德罗常数为NA,则方石英晶体的的密度为

您最近一年使用:0次
2023-08-12更新
|
400次组卷
|
2卷引用:浙江省金丽衢十二校2022-2023学年高三上学期第一次联考化学试题
解题方法
2 . 氧族元素包括氧、硫、硒等,这些元素的单质及其化合物在工农业生产和科学研究中具有广泛的用途。回答下列问题:
(1)下列属于氧原子激发态的轨道表示式的有___________ (填字母,下同),其中失去最外层上一个电子所需能量最低的是___________ 。
a. b.
b.
c.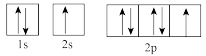 d.
d.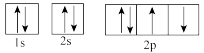
(2)科学研究表明,过硫化氢(也叫二硫化氢)加入烯烃中可制备硫醇,其熔沸点及制备方法如下表所示:
① 的结构为
的结构为 ,其中2个S原子的
,其中2个S原子的___________ 杂化轨道形成S—S___________ (填“ ”或“
”或“ ”)共价键。
”)共价键。
② 分子结构中H—O—O键角为
分子结构中H—O—O键角为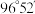 ,则
,则 分子结构中H—S—S键角
分子结构中H—S—S键角___________ (填“=”“>”或“<”)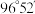 。
。
③ 的熔沸点比
的熔沸点比 的熔沸点低的原因是
的熔沸点低的原因是___________ 。
(3)在能源逐渐匮乏的形势下,超导材料显得尤为重要。Li、Fe、Se三种元素组成的某新型超导材料的晶胞结构如图所示:
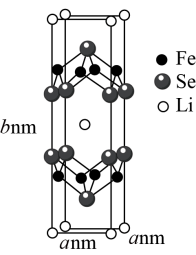
1个晶胞中的Se原子数为___________ 。晶胞的部分参数如图所示,且晶胞棱边夹角均为90°,晶体密度为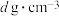 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为___________ (列式表示)。
(1)下列属于氧原子激发态的轨道表示式的有
a.
 b.
b.
c.
 d.
d.
(2)科学研究表明,过硫化氢(也叫二硫化氢)加入烯烃中可制备硫醇,其熔沸点及制备方法如下表所示:
| 物质 | 熔点/℃ | 沸点/℃ |  制备方法 制备方法 |
 | -90.0 | 71.0 | 加热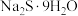 至熔融,再把硫溶入其中,得多硫化钠溶液。在263K下,将该溶液注入稀硫酸中,得多硫化氢混合物,分离、干燥、真空蒸馏,即得 至熔融,再把硫溶入其中,得多硫化钠溶液。在263K下,将该溶液注入稀硫酸中,得多硫化氢混合物,分离、干燥、真空蒸馏,即得 |
 | -0.4 | 150.0 |
 的结构为
的结构为 ,其中2个S原子的
,其中2个S原子的 ”或“
”或“ ”)共价键。
”)共价键。②
 分子结构中H—O—O键角为
分子结构中H—O—O键角为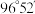 ,则
,则 分子结构中H—S—S键角
分子结构中H—S—S键角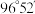 。
。③
 的熔沸点比
的熔沸点比 的熔沸点低的原因是
的熔沸点低的原因是(3)在能源逐渐匮乏的形势下,超导材料显得尤为重要。Li、Fe、Se三种元素组成的某新型超导材料的晶胞结构如图所示:

1个晶胞中的Se原子数为
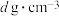 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为
您最近一年使用:0次
名校
解题方法
3 . 某油脂厂废弃的油脂加氢镍催化剂的主要成分为Ni,还含有一定量Al、Fe及氧化铁、少量其他不溶性物质,回收废镍催化剂制备硫酸镍晶体( )的工艺流程如下:
)的工艺流程如下:
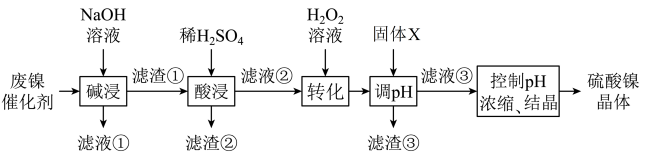
已知:溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)下列状态的Ni微粒中,电离最外层一个电子所需能量最大的是_______(填标号)。
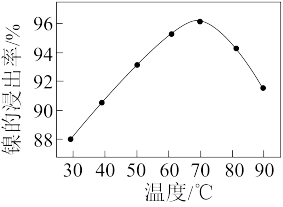
(2)“碱浸”中NaOH溶液的两个作用分别是_______ 。如图是“酸浸”时镍的浸出率与温度的关系,则酸浸时合适的浸出温度是_______ ℃。
(3)为回收金属,向“滤液①”中通入过量二氧化碳气体,反应的离子方程式为_______ 。
(4)“转化”步骤中反应的离子方程式是_____ 。“调pH”时,最适宜的pH范围是______ 。
(5)Ni可以形成多种多样的配合物。 、
、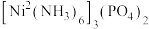 是镍的两种配合物,这两种配合物都存在的作用力是
是镍的两种配合物,这两种配合物都存在的作用力是_______ (填标号)。
a.范德华力 b.配位键 c.极性键 d.离子键 e.氢键 f.非极性键
(6) 中阴离子的空间构型为
中阴离子的空间构型为_______ 。
 )的工艺流程如下:
)的工艺流程如下:
已知:溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |
开始沉淀的pH( ) ) | 2.2 | 7.5 | 7.2 |
沉淀完全的pH( ) ) | 3.2 | 9.0 | 8.7 |
回答下列问题:
(1)下列状态的Ni微粒中,电离最外层一个电子所需能量最大的是_______(填标号)。
A. | B.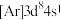 | C.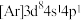 | D. |

(3)为回收金属,向“滤液①”中通入过量二氧化碳气体,反应的离子方程式为
(4)“转化”步骤中反应的离子方程式是
(5)Ni可以形成多种多样的配合物。
 、
、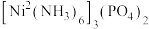 是镍的两种配合物,这两种配合物都存在的作用力是
是镍的两种配合物,这两种配合物都存在的作用力是a.范德华力 b.配位键 c.极性键 d.离子键 e.氢键 f.非极性键
(6)
 中阴离子的空间构型为
中阴离子的空间构型为
您最近一年使用:0次
22-23高三·浙江·开学考试
4 .  是一种重要的工业原料,常用作媒染剂等。已知
是一种重要的工业原料,常用作媒染剂等。已知 常温下是无色液体,在潮湿空气中易水解,熔点
常温下是无色液体,在潮湿空气中易水解,熔点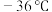 ,沸点
,沸点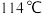 。工业上制备
。工业上制备 的工艺流程如图:
的工艺流程如图:
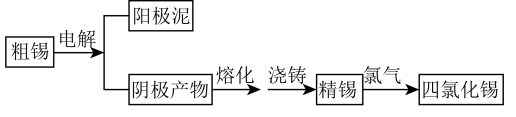
请回答下列问题;
(1)粗锡电解精炼时,常用硅氟酸 和硅氟酸亚锡
和硅氟酸亚锡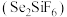 为电解液。已知
为电解液。已知 为强酸,则用硅氟酸溶解氧化亚锡的离子方程式为
为强酸,则用硅氟酸溶解氧化亚锡的离子方程式为___________ 。阴极的电极反应式为___________ ,根据价层电子对互斥理论和杂化轨道理论,判断 离子的空间构型是
离子的空间构型是___________ ,硅的杂化类型是___________ 。
(2)某同学模拟工业制法设计了由 与
与 反应制取
反应制取 的实验装置:
的实验装置:
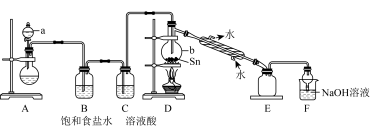
①a中浓盐酸与烧瓶内固体反应生成 ,则烧瓶内固体可以选用
,则烧瓶内固体可以选用___________ ,仪器b的名称为___________ 。
②装置D的主要缺点是___________ ,除此之外,整套装置还有的缺点是___________ 。
③制取 中可能会产生少量
中可能会产生少量 ,为测定产品中
,为测定产品中 的含量,可选用重铬酸钾标准液滴定,准确称取该样品
的含量,可选用重铬酸钾标准液滴定,准确称取该样品 放于烧杯中,用少量浓盐酸溶解,加入过量的氯化铁溶液,再加水稀释,配制成
放于烧杯中,用少量浓盐酸溶解,加入过量的氯化铁溶液,再加水稀释,配制成 溶液,取
溶液,取 于锥形瓶中,用
于锥形瓶中,用 重铬酸钾标准溶液滴定至终点,消耗标准液
重铬酸钾标准溶液滴定至终点,消耗标准液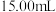 ,则产品中
,则产品中 的含量为
的含量为___________  (用含m的代数式表示),测定
(用含m的代数式表示),测定 含量会随在烧杯中配制时间的增加而逐渐增大,其原因可能是
含量会随在烧杯中配制时间的增加而逐渐增大,其原因可能是___________ (用离子方程式表示)。
 是一种重要的工业原料,常用作媒染剂等。已知
是一种重要的工业原料,常用作媒染剂等。已知 常温下是无色液体,在潮湿空气中易水解,熔点
常温下是无色液体,在潮湿空气中易水解,熔点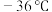 ,沸点
,沸点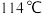 。工业上制备
。工业上制备 的工艺流程如图:
的工艺流程如图:
请回答下列问题;
(1)粗锡电解精炼时,常用硅氟酸
 和硅氟酸亚锡
和硅氟酸亚锡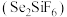 为电解液。已知
为电解液。已知 为强酸,则用硅氟酸溶解氧化亚锡的离子方程式为
为强酸,则用硅氟酸溶解氧化亚锡的离子方程式为 离子的空间构型是
离子的空间构型是(2)某同学模拟工业制法设计了由
 与
与 反应制取
反应制取 的实验装置:
的实验装置:
①a中浓盐酸与烧瓶内固体反应生成
 ,则烧瓶内固体可以选用
,则烧瓶内固体可以选用②装置D的主要缺点是
③制取
 中可能会产生少量
中可能会产生少量 ,为测定产品中
,为测定产品中 的含量,可选用重铬酸钾标准液滴定,准确称取该样品
的含量,可选用重铬酸钾标准液滴定,准确称取该样品 放于烧杯中,用少量浓盐酸溶解,加入过量的氯化铁溶液,再加水稀释,配制成
放于烧杯中,用少量浓盐酸溶解,加入过量的氯化铁溶液,再加水稀释,配制成 溶液,取
溶液,取 于锥形瓶中,用
于锥形瓶中,用 重铬酸钾标准溶液滴定至终点,消耗标准液
重铬酸钾标准溶液滴定至终点,消耗标准液 ,则产品中
,则产品中 的含量为
的含量为 (用含m的代数式表示),测定
(用含m的代数式表示),测定 含量会随在烧杯中配制时间的增加而逐渐增大,其原因可能是
含量会随在烧杯中配制时间的增加而逐渐增大,其原因可能是
您最近一年使用:0次
解题方法
5 . 2020年3月29日,比亚迪发布刀片电池,该电池不但大幅提高了体积利用率,并且顺利通过了安全性能的“针刺测试”,其使用的磷酸铁锂电池的工作原理为LiFePO4 +C Li1-xFePO4 +LixC,已知:NA代表阿伏加德罗常数的值。回答下列问题:
Li1-xFePO4 +LixC,已知:NA代表阿伏加德罗常数的值。回答下列问题:
(1)LiFePO4中基态铁粒子的核外电子排布式为_______ ,Fe原子的所有能级中能量最高的能级是_______ 。
(2)在元素周期表中,氮元素分别与磷、氧相邻,在N、O、P三种元素中,电负性由大到小的顺序为_______ ,NH3的键角略大于PH3,从原子结构角度说明原因_______ 。
(3)磷的氯化物有两种: PCl3和 PCl5, PCl3的VSEPR模型为_______ ,其中PCl3的沸点_______ (填“大于”或“小于”)PCl5。
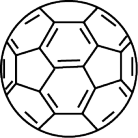
(4)电池反应中C常以足球烯(C60)的形式参与,足球烯的结构如图所示,2mol足球烯含_______ 个π键。
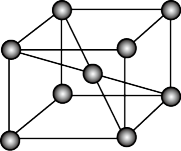
(5)锂、铁单质晶胞分别如左图、右图所示,锂、铁晶胞的配位数之比为_______ 。
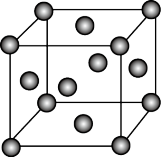
(6)金刚石晶胞如图Ⅳ所示。已知金刚石的密度为ρg·cm-3,金刚石中C—C键的键长为_______ m(用代数式表示)。

 Li1-xFePO4 +LixC,已知:NA代表阿伏加德罗常数的值。回答下列问题:
Li1-xFePO4 +LixC,已知:NA代表阿伏加德罗常数的值。回答下列问题:(1)LiFePO4中基态铁粒子的核外电子排布式为
(2)在元素周期表中,氮元素分别与磷、氧相邻,在N、O、P三种元素中,电负性由大到小的顺序为
(3)磷的氯化物有两种: PCl3和 PCl5, PCl3的VSEPR模型为
(4)电池反应中C常以足球烯(C60)的形式参与,足球烯的结构如图所示,2mol足球烯含

(5)锂、铁单质晶胞分别如左图、右图所示,锂、铁晶胞的配位数之比为


(6)金刚石晶胞如图Ⅳ所示。已知金刚石的密度为ρg·cm-3,金刚石中C—C键的键长为

您最近一年使用:0次
2022-07-26更新
|
453次组卷
|
2卷引用:云南省保山市2021-2022学年高三第一次教学质量监测理科综合化学试题
名校
解题方法
6 . 卤族元素及其化合物种类繁多,有着非常重要的用途,回答下列问题:
(1)基态Br原子的电子排布式为[Ar]____ 。
(2)同一条件下,HF的沸点____ HCl(填“大于”“等于”或“小于”,以下同)。HF在水中的溶解度____ HCl,原因是____ 。SOCl2中心S原子VSEPR模型为____ 。1mol氟硼酸铵NH4BF4中含有____ mol配位键。
(3)一种Ag2HgI4固体导电材料为四方晶系,其晶胞参数为apm、apm和2apm,晶胞沿x、y、z的方向投影(如图所示),A、B、C表示三种不同原子的投影,标记为n的原子分数坐标为( ,
, ,
, ),则m的原子分数坐标为
),则m的原子分数坐标为____ ,距离Hg最近的Ag有____ 个。设NA为阿伏加德罗常数的值,Ag2HgI4的摩尔质量为Mg·mol-1,该晶体的密度为____ g·cm-3(用代数式表示)。

(1)基态Br原子的电子排布式为[Ar]
(2)同一条件下,HF的沸点
(3)一种Ag2HgI4固体导电材料为四方晶系,其晶胞参数为apm、apm和2apm,晶胞沿x、y、z的方向投影(如图所示),A、B、C表示三种不同原子的投影,标记为n的原子分数坐标为(
 ,
, ,
, ),则m的原子分数坐标为
),则m的原子分数坐标为
您最近一年使用:0次
名校
解题方法
7 . 铝、硅、磷三种元素的单质及其化合物在生产生活中有广泛应用。
(1)基态硅原子的价电子的轨道表达式_______ ;第三周期元素中第一电离能介于铝和磷元素之间的有_______ (填元素符号)。
(2)比较铝、磷元素的简单离子半径_______ (用相关化学符号表示)。
(3)下列关于三种元素的化合物的叙述正确的是_______ 。
①三种元素的最高价氧化物均能与水直接化合
②三种元素的最高价氧化物均存在晶体形式,且晶体类型不同
③ 、
、 均既能与酸又能与碱反应,均属于两性氧化物
均既能与酸又能与碱反应,均属于两性氧化物
(4) 与
与 比较,沸点较高的是
比较,沸点较高的是_______ ,两种分子中键角较大的是_______ ,其中 的分子构型为
的分子构型为_______ 。
(5)三种单质的晶胞结构如下
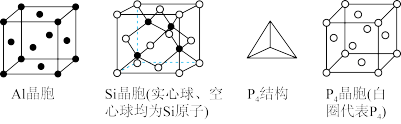
这三种晶胞中的原子的个数比为_______ 。
(6)①工业由粗硅制高纯硅的化学方程式_______ 。
②利用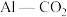 电池(工作原理如下图所示)能有效地将
电池(工作原理如下图所示)能有效地将 转化成化工原料草酸铝
转化成化工原料草酸铝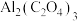 ,根据图示,下列表述正确的是
,根据图示,下列表述正确的是_______ 。

A.该电池的使用可有效利用
B.电池工作时,电流从铝电极流向多孔碳电极
C. 在整个反应过程中的作用是催化剂
在整个反应过程中的作用是催化剂
D.含 的离子液体是熔融态的
的离子液体是熔融态的
(1)基态硅原子的价电子的轨道表达式
(2)比较铝、磷元素的简单离子半径
(3)下列关于三种元素的化合物的叙述正确的是
①三种元素的最高价氧化物均能与水直接化合
②三种元素的最高价氧化物均存在晶体形式,且晶体类型不同
③
 、
、 均既能与酸又能与碱反应,均属于两性氧化物
均既能与酸又能与碱反应,均属于两性氧化物(4)
 与
与 比较,沸点较高的是
比较,沸点较高的是 的分子构型为
的分子构型为(5)三种单质的晶胞结构如下

这三种晶胞中的原子的个数比为
(6)①工业由粗硅制高纯硅的化学方程式
②利用
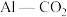 电池(工作原理如下图所示)能有效地将
电池(工作原理如下图所示)能有效地将 转化成化工原料草酸铝
转化成化工原料草酸铝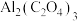 ,根据图示,下列表述正确的是
,根据图示,下列表述正确的是
A.该电池的使用可有效利用

B.电池工作时,电流从铝电极流向多孔碳电极
C.
 在整个反应过程中的作用是催化剂
在整个反应过程中的作用是催化剂D.含
 的离子液体是熔融态的
的离子液体是熔融态的
您最近一年使用:0次
2022-06-20更新
|
475次组卷
|
2卷引用:天津市耀华中学2022届高三下学期一模化学试题
解题方法
8 . TIC、TiN、MnS、MnSe在电化学领域均有巨大的应用潜力。回答下列问题:
(1)基态Ti2+和Mn2+中未成对电子数之比为_______ ;N、S、Mn的第一电离能由大到小的顺序为_______ 。
(2)键能:H—S_______ H—Se(填“>”或“<"),理由为_______ 。
(3)C3N4的硬度可以和金刚石媲美,其中N原子的杂化方式为_______ 。
(4)SeO2的VSEPR模型为_______ 。
(5)H2S2O8是一种强氧化剂,可看作两个H2SO4分子通过形成过氧键结合而成。1molH2S2O8中σ键的数目为_______ 。
(6)MnSe具有NaCl型结构,其立方晶胞结构如图1所示。
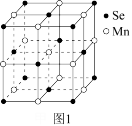
①MnSe晶体可以看成是由Se原子堆成的正八面体中空隙被Mn原子填充,填充率为_______ 。
②图2所示单元不是MnSe的晶胞单元,原因为_______ 。

③若阿伏加德罗常数的值为NA,晶体密度为ρg·cm-3,则该晶体中Se原子与Mn原子之间最短距离为_______ pm。
(1)基态Ti2+和Mn2+中未成对电子数之比为
(2)键能:H—S
(3)C3N4的硬度可以和金刚石媲美,其中N原子的杂化方式为
(4)SeO2的VSEPR模型为
(5)H2S2O8是一种强氧化剂,可看作两个H2SO4分子通过形成过氧键结合而成。1molH2S2O8中σ键的数目为
(6)MnSe具有NaCl型结构,其立方晶胞结构如图1所示。

①MnSe晶体可以看成是由Se原子堆成的正八面体中空隙被Mn原子填充,填充率为
②图2所示单元不是MnSe的晶胞单元,原因为

③若阿伏加德罗常数的值为NA,晶体密度为ρg·cm-3,则该晶体中Se原子与Mn原子之间最短距离为
您最近一年使用:0次
解题方法
9 . 单质硼的硬度近似于金刚石,有很高的电阻。但它的导电率随温度的升高而增大,高温时为良导体。硼在自然界中主要以硼酸和硼酸盐的形式存在。
(1)基态硼原子的价电子排布式为_______ ,晶体硼的熔沸点_______ (填“高于”或“低于”)金刚石,原因是_______ 。
(2)硼酸与氢氧化钠在一定条件下可以生成四硼酸钠,结构如图所示,四硼酸钠中含有的化学键类型为_______ ,O原子的杂化类型为_______ ,B原子与相连的3个O原子围成的图形为_______ ,第一电离能介于硼元素和氧元素之间的第二周期元素有_______ 种。

(3)硼和氮可以构成多种类型的晶体,其中一种晶体的晶胞如图所示,晶胞上下底面均为菱形,晶胞参数如图所示,该晶体的化学式为_______ ,晶胞密度为_______ (写出表达式即可)。

(1)基态硼原子的价电子排布式为
(2)硼酸与氢氧化钠在一定条件下可以生成四硼酸钠,结构如图所示,四硼酸钠中含有的化学键类型为

(3)硼和氮可以构成多种类型的晶体,其中一种晶体的晶胞如图所示,晶胞上下底面均为菱形,晶胞参数如图所示,该晶体的化学式为

您最近一年使用:0次
10 . “碳中和”的一种重要方案就是将 转化处理为有用物质或能源转化,由于
转化处理为有用物质或能源转化,由于 分子的结构非常稳定,不容易活化,常用的方法有,光化学催化,热催化光催化、热催化及光热催化法。
分子的结构非常稳定,不容易活化,常用的方法有,光化学催化,热催化光催化、热催化及光热催化法。
(1) 的
的 模型是
模型是_______ 形非极性对称分子,其中C原子的轨道杂化类型是_______ 。
(2)研究表明,在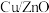 催化剂存在下,
催化剂存在下, 和
和 可发生两个平行反应,分别生成
可发生两个平行反应,分别生成 和
和 。反应的热化学方程式如下:
。反应的热化学方程式如下:
I.
II.
已知:① 和
和 的标准燃烧热分别为
的标准燃烧热分别为 和
和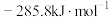
②
反应Ⅱ的
_______  。
。
(3) 与
与 可以用来生产尿素
可以用来生产尿素 ,其反应过程为:
,其反应过程为: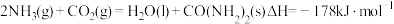 。
。
① 时,在
时,在 的密闭容器中充入
的密闭容器中充入 与
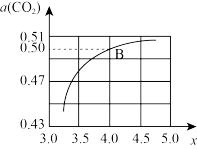
与 模拟工业生产。投料比
模拟工业生产。投料比 ,图是
,图是 平衡转化率
平衡转化率 与X的关系。则图中B点
与X的关系。则图中B点 的平衡转化率
的平衡转化率
_______ 。
②当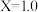 时,若起始的压强为
时,若起始的压强为 ,水为液态,平衡时压强变为起始的
,水为液态,平衡时压强变为起始的 。用平衡分压(分压=总压×物质的量分数)代替平衡浓度表示该反应的平衡常数
。用平衡分压(分压=总压×物质的量分数)代替平衡浓度表示该反应的平衡常数
_______ 。
(4)以二氧化钛表面覆盖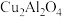 为催化剂,可以将
为催化剂,可以将 和
和 直接转化成乙酸。
直接转化成乙酸。

①在不同温度下催化剂的催化效率与乙酸的生成速率的变化情况如图Ⅲ所示。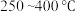 阶段,温度升高而乙酸的生成速率变化的原因是
阶段,温度升高而乙酸的生成速率变化的原因是_______ 。
②为了提高该反应中 的转化率,可以采取的措施是
的转化率,可以采取的措施是_______ 。
(5)纳米二氧化钛膜中 的电对吸附
的电对吸附 并将其还原。以纳米二氧化钛膜为工作电极,以一定浓度的硫酸为介质,在一定条件下通入
并将其还原。以纳米二氧化钛膜为工作电极,以一定浓度的硫酸为介质,在一定条件下通入 进行电解,在阴极可制得低密度聚乙烯(
进行电解,在阴极可制得低密度聚乙烯(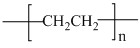 简称
简称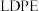 )。电解时,
)。电解时, 最终转化为
最终转化为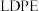 的电极反应式是
的电极反应式是_______ 。
(6)绿色植物进行光合作用的简易流程如下图:

①写出暗反应过程中 发生转化的总反应方程式:
发生转化的总反应方程式:_______ 。光反应过程中水分解为氧气脱离体系对于暗反应阶段的意义是:_______ (一条即可)。
②下图为光电催化能源化利用 制备太阳能燃料的示意图。下列说法正确的是
制备太阳能燃料的示意图。下列说法正确的是_______ 。

A.阳极反应式为
B. 还原产物可能为
还原产物可能为 等
等
C.阳极、阴极材料互换对制备太阳能燃料影响不大
 转化处理为有用物质或能源转化,由于
转化处理为有用物质或能源转化,由于 分子的结构非常稳定,不容易活化,常用的方法有,光化学催化,热催化光催化、热催化及光热催化法。
分子的结构非常稳定,不容易活化,常用的方法有,光化学催化,热催化光催化、热催化及光热催化法。(1)
 的
的 模型是
模型是(2)研究表明,在
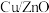 催化剂存在下,
催化剂存在下, 和
和 可发生两个平行反应,分别生成
可发生两个平行反应,分别生成 和
和 。反应的热化学方程式如下:
。反应的热化学方程式如下:I.

II.

已知:①
 和
和 的标准燃烧热分别为
的标准燃烧热分别为 和
和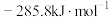
②

反应Ⅱ的

 。
。(3)
 与
与 可以用来生产尿素
可以用来生产尿素 ,其反应过程为:
,其反应过程为: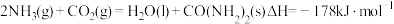 。
。①
 时,在
时,在 的密闭容器中充入
的密闭容器中充入 与
与 模拟工业生产。投料比
模拟工业生产。投料比 ,图是
,图是 平衡转化率
平衡转化率 与X的关系。则图中B点
与X的关系。则图中B点 的平衡转化率
的平衡转化率

②当
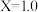 时,若起始的压强为
时,若起始的压强为 ,水为液态,平衡时压强变为起始的
,水为液态,平衡时压强变为起始的 。用平衡分压(分压=总压×物质的量分数)代替平衡浓度表示该反应的平衡常数
。用平衡分压(分压=总压×物质的量分数)代替平衡浓度表示该反应的平衡常数
(4)以二氧化钛表面覆盖
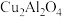 为催化剂,可以将
为催化剂,可以将 和
和 直接转化成乙酸。
直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率的变化情况如图Ⅲ所示。
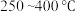 阶段,温度升高而乙酸的生成速率变化的原因是
阶段,温度升高而乙酸的生成速率变化的原因是②为了提高该反应中
 的转化率,可以采取的措施是
的转化率,可以采取的措施是(5)纳米二氧化钛膜中
 的电对吸附
的电对吸附 并将其还原。以纳米二氧化钛膜为工作电极,以一定浓度的硫酸为介质,在一定条件下通入
并将其还原。以纳米二氧化钛膜为工作电极,以一定浓度的硫酸为介质,在一定条件下通入 进行电解,在阴极可制得低密度聚乙烯(
进行电解,在阴极可制得低密度聚乙烯(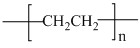 简称
简称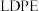 )。电解时,
)。电解时, 最终转化为
最终转化为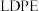 的电极反应式是
的电极反应式是(6)绿色植物进行光合作用的简易流程如下图:

①写出暗反应过程中
 发生转化的总反应方程式:
发生转化的总反应方程式:②下图为光电催化能源化利用
 制备太阳能燃料的示意图。下列说法正确的是
制备太阳能燃料的示意图。下列说法正确的是
A.阳极反应式为

B.
 还原产物可能为
还原产物可能为 等
等C.阳极、阴极材料互换对制备太阳能燃料影响不大
您最近一年使用:0次



