12-13高二下·湖北武汉·期中
名校
解题方法
1 . 甲烷分子(CH4)失去一个H+,形成甲基阴离子( ),在这个过程中,下列描述不合理的是
),在这个过程中,下列描述不合理的是
 ),在这个过程中,下列描述不合理的是
),在这个过程中,下列描述不合理的是| A.碳原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
您最近一年使用:0次
2020-10-24更新
|
258次组卷
|
10卷引用:2012-2013学年湖北省武汉二中高二下学期期中考试化学试卷
(已下线)2012-2013学年湖北省武汉二中高二下学期期中考试化学试卷2016届安徽省六安一中高三上第四次月考化学试卷河北省唐山市第一中学2016-2017学年高二下学期期中考试化学试题河北省唐山一中2016-2017学年高二下学期期中考试化学试题(已下线)2013-2014学年湖北省襄阳市四校高二下学期期中联考化学试卷(已下线)2014届江苏省启东中学第二学期期中考试高二化学试卷福建省晋江市季延中学2018-2019学年高二下学期期中考试化学试题福建省龙海市第二中学2019-2020学年高二下学期期末考试化学试题(已下线)第2章 微粒间相互作用与物质性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)福建省建瓯市芝华中学2021-2022学年高二下学期第一次阶段考化学试题
名校
解题方法
2 . 下列分子或离子中,VSEPR模型名称与分子或离子的立体构型名称不一致的是
| A.CO2 | B.H2O | C. | D.CCl4 |
您最近一年使用:0次
2020-09-07更新
|
797次组卷
|
32卷引用:2015-2016学年山西省大同一中高二下3月月考化学试卷
2015-2016学年山西省大同一中高二下3月月考化学试卷2014-2015学年陕西西北大学附中高二下期末化学试卷2015-2016学年云南省德宏州芒一中高二下学期期末化学试卷2015-2016学年辽宁省葫芦岛市六校协作体联考高二下期中化学试卷2017-2018学年人教版高中化学选修三 模块综合质量检测陕西省黄陵中学2017-2018学年高二(重点班)下学期期末考试化学试题黑龙江省牡丹江市第三高级中学2018-2019学年高二上学期期末考试化学试题湖北省沙市中学2019-2020学年高二上学期期末考试化学试题内蒙古包头市包钢第四中学2018-2019学年高二下学期4月月考化学试题辽宁省凌源市第二高级中学2019-2020学年高二下学期第二次网测化学试题宁夏银川市长庆高级中学2019-2020学年高二下学期期中考试化学试题福建省福州第一中学2019-2020学年高二下学期期末考试化学试题(已下线)练习14 分子的空间结构-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)辽宁省大连市普兰店区第三十八中学2020-2021学年高二上学期期末考试化学试题新疆生产建设兵团第二中学2016-2017学年高二下学期第二次月考化学试题新疆呼图壁县第一中学2016-2017学年高二下学期期末考试化学试题【全国百强校】福建省三明市第一中学2019届高三第二次返校考试化学试题【全国百强校】福建省厦门第一中学2018-2019学年高二上学期期中考试化学试题山东省泰安市2020届高三第二次模拟考试化学试题安徽省安庆市太湖县2019-2020学年高二下学期期中质量调研考试化学试题新疆昌吉回族自治州呼图壁县第一中学2019-2020学年高二下学期期末考试化学试题(已下线)模块同步卷12 综合检测卷(提升卷)-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)四川省西昌市2020-2021学年高二下学期期中检测化学试题新疆莎车县第一中学2021-2022学年高二下学期期中考试化学试题天津市宁河区芦台第一中学2021-2022学年高二下学期线上第一次月考化学试题新疆疏勒县实验学校2021-2022学年高二下学期期中考试化学试题湖北省武汉西藏中学2023-2024学年高二下学期4月月考化学试题山东省临沂市平邑县第一中学西校区2023-2024学年高二下学期四月份阶段性考试化学试题福建省建瓯市芝华中学2020-2021学年高二下学期第一阶段考试化学试题海南省东方中学2021-2022学年高二下学期第一次月考化学试题贵州省凯里学院附属中学2021-2022学年高二下学期3月月考化学试题广东省湛江市第二中学2021-2022学年高二下学期第14周(5.21)周练化学试题
名校
解题方法
3 . 下列中心原子的杂化轨道类型和分子几何构型不正确的是( )
| A.PCl3中P 原子sp3杂化,为三角锥形 |
| B.BC13中B原子sp2杂化, 为平面三角形 |
| C.CS2中C原子sp杂化,为直线形 |
| D.H2S分子中,S为sp杂化,为直线形 |
您最近一年使用:0次
2020-09-02更新
|
605次组卷
|
30卷引用:河南省开封市兰考县第一高级中学2018-2019学年高二下学期3月月考化学试题
河南省开封市兰考县第一高级中学2018-2019学年高二下学期3月月考化学试题【全国百强校】甘肃省兰州市第一中学2018-2019学年高二下学期3月月考化学试题山西省运城市新绛县第二中学2018-2019学年高二下学期期中考试化学试题四川省绵阳市三台中学实验学校2019-2020学年高二上学期9月月考化学试题(已下线)练习14 分子的空间结构-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)天津市天外大附属北辰光华外国语学校2019-2020学年高二下学期期末测试化学试题2014-2015吉林省吉林市第五十五中学高二下学期期中考试化学试卷2014-2015学年吉林省汪清县第六中学高二下学期期末考试化学试卷2015-2016学年福建省四地六校高二下第二次联考化学试卷2015-2016学年吉林东北师大附属实验高二下期末化学试卷2015-2016吉林东北师大附属实验学校净月实验学校高二下期末化学卷甘肃省玉门市第一中学2018-2019学年高二上学期期中考试化学试题贵州省毕节纳雍县一中2018-2019学年高二下学期期末考试化学试题云南省金平县第一中学2019-2020学年高二上学期期末考试化学试题吉林省汪清县第六中学2019-2020学年高二下学期期中考试化学试题吉林省通化市通化县综合高级中学2019-2020学年高二下学期期中考试化学试题宁夏回族自治区吴忠市吴忠中学2019-2020学年高二下学期期中考试化学试题(已下线)模块同步卷05 分子的立体构型及分子的性质-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)宁夏长庆高级中学2020-2021学年高二上学期期中考试化学试卷(已下线)考点34 分子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点47 分子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)四川省绵阳第一中学2022-2023学年高二上学期9月教学质量监测理科化学试题宁夏银川市景博中学2021-2022学年高二下学期第二次月考化学试题黑龙江省伊春市伊美区第二中学2021-2022学年高二下学期6月月考化学试题四川省科学城第一中学2022-2023学年高二上学期期中考试化学试题(已下线)考点42 分子结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)吉林省松原市乾安县第七中学2020-2021学年高二下学期第五次质量检测化学试题新疆生产建设兵团第六师芳草湖农场中学2021-2022学年高二上学期期末考试化学试题新疆克拉玛依市高级中学2021-2022学年高二下学期期末考试化学试题江苏省灌南高级中学2023-2024学年高三上学期第一次月考化学试题
解题方法
4 . 氮化硼(BN)是-种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
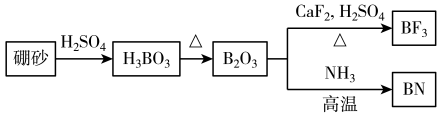
请回答下列问题:
(1) 在BF3分子中,F-B-F的键角是_____ ,B原子的杂化轨道类型为_____ ,BF3和过量NaF作用可生成NaBF4, 的立体结构为
的立体结构为______ 。
(2)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为_____ (填“极性键”或“非极性键”),层间作用力为_____ 。

请回答下列问题:
(1) 在BF3分子中,F-B-F的键角是
 的立体结构为
的立体结构为(2)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
您最近一年使用:0次
解题方法
5 . 根据所学物质结构知识,回答下列问题:
(1)氮元素是植物生长所需的元素,常见氮肥有铵盐(NH4+)、尿素 (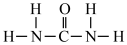 )等,NH4+中H-N-H键角
)等,NH4+中H-N-H键角_______ (填“>”“<”或“=”)。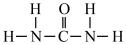 中N-C-N键角。
中N-C-N键角。
(2)硫元素和人类的生存与发展联系密切,在战国时期,我国的炼丹家们就开始了对硫单质及含硫化合物的研究应用。硫单质有多种同素异形体,其中一种单质分子(S8)的结构为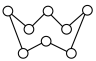 ,其熔点和沸点要比二氧化硫的高很多,主要原因为
,其熔点和沸点要比二氧化硫的高很多,主要原因为___________ 。气态三氧化硫以单分子形式存在,其分子的立体构型为____ 形,实验测得三种氧化物的熔沸点如下,推测固态三氧化硫的分子式为____________ 。
(3)在气体分析中,常用CuCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2CuCl+2CO+2H2O=Cu2Cl2·2CO·2H2O;Cu2Cl2·2CO·2H2O是一种配合物,其结构如图所示:
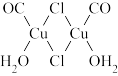
①H2O中氧原子的杂化方式为_____________ ;
②该配合物中,CO作配体时配位原子是C而不是O的原因是______________ 。
(1)氮元素是植物生长所需的元素,常见氮肥有铵盐(NH4+)、尿素 (
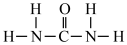 )等,NH4+中H-N-H键角
)等,NH4+中H-N-H键角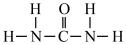 中N-C-N键角。
中N-C-N键角。(2)硫元素和人类的生存与发展联系密切,在战国时期,我国的炼丹家们就开始了对硫单质及含硫化合物的研究应用。硫单质有多种同素异形体,其中一种单质分子(S8)的结构为
 ,其熔点和沸点要比二氧化硫的高很多,主要原因为
,其熔点和沸点要比二氧化硫的高很多,主要原因为| P4O10 | 三氧化硫 | Cl2O7 | |
| 熔点 | 613K | 289K | 182K |
| 沸点 | 633K | 317K | 355K |
(3)在气体分析中,常用CuCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2CuCl+2CO+2H2O=Cu2Cl2·2CO·2H2O;Cu2Cl2·2CO·2H2O是一种配合物,其结构如图所示:

①H2O中氧原子的杂化方式为
②该配合物中,CO作配体时配位原子是C而不是O的原因是
您最近一年使用:0次
解题方法
6 . 已知Al、Mg、Na为第三周期元素,其原子的第一至第四电离能如下表:
(1)则Al、Mg、Na的电负性从大到小的顺序为_____________ 。
(2) C、N、O、H是周期表中前10号元素,它们的原子半径依次减小,H能分别与C、N、O形成电子总数相等的分子CH4、NH3、H2O。
①在CH4、NH3、H2O分子中,C、N、O三原子都采取_______ 杂化;
②CH4是含有_____ 键(填“极性”或“非极性”)的____ 分子(填“极性”或“非极性”);
③NH3是一种易液化的气体,请简述其易液化的原因_______ 。
④H2O分子的VSEPR模型的空间构型为_____ ;H2O分子的空间构型为______ 。
(3) K、Cr、 Cu三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4s1。
①K元素组成的单质的晶体堆积模型为______ (填代号);
a.简单立方堆积 b.体心立方堆积 c.六方最密堆积 d.面心立方最密堆积
②Cr元素在其化合物中最高化合价为_____ ;
③Cu2+离子的核外电子排布式为______ ;
| 电离能/kJ‧mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
(1)则Al、Mg、Na的电负性从大到小的顺序为
(2) C、N、O、H是周期表中前10号元素,它们的原子半径依次减小,H能分别与C、N、O形成电子总数相等的分子CH4、NH3、H2O。
①在CH4、NH3、H2O分子中,C、N、O三原子都采取
②CH4是含有
③NH3是一种易液化的气体,请简述其易液化的原因
④H2O分子的VSEPR模型的空间构型为
(3) K、Cr、 Cu三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4s1。
①K元素组成的单质的晶体堆积模型为
a.简单立方堆积 b.体心立方堆积 c.六方最密堆积 d.面心立方最密堆积
②Cr元素在其化合物中最高化合价为
③Cu2+离子的核外电子排布式为
您最近一年使用:0次
7 . 人们长期以来一直认为氟的含氧酸不存在。但是1971年斯图尔杰和阿佩曼成功地合成次氟酸后,这种论点被剧烈地动摇了。他们是在0℃以下将氟化物从细冰末的上面通过,得到毫克量的次氟酸。
(1)以下两种结构式,能正确地表示次氟酸的结构的是___________ ;
A. B.
B.
(2)次氟酸中氧元素的化合价是_____ ,次氟酸的电子式为_____ ,次氟酸的分子中共价键的键角____ (填“>”“<”或“=”)180°。
(1)以下两种结构式,能正确地表示次氟酸的结构的是
A.
 B.
B.
(2)次氟酸中氧元素的化合价是
您最近一年使用:0次
名校
解题方法
8 . 下列分子中的中心原子的杂化方式为sp杂化,分子的空间构型为直线形且分子中没有形成π键的是
| A.CH≡CH | B.CH2=CH2 | C.BeCl2 | D.NH3 |
您最近一年使用:0次
名校
解题方法
9 . 用价层电子对互斥理论判断NO 的立体构型
的立体构型
 的立体构型
的立体构型| A.正四面体 | B.V形 | C.三角锥形 | D.平面三角形 |
您最近一年使用:0次
2020-08-19更新
|
116次组卷
|
5卷引用:河北省唐山市路北区第十一中学2019-2020学年高二下学期期末考试化学试题
河北省唐山市路北区第十一中学2019-2020学年高二下学期期末考试化学试题(已下线)练习14 分子的空间结构-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)新疆疏勒县第一中学2020--2021学年高二下学期期末考试化学试题四川省雅安中学2022-2023学年高二上学期10月月考化学试题广东省湛江市第二中学2021-2022学年高二下学期第14周(5.21)周练化学试题
2020高三·全国·专题练习
解题方法
10 . 碳、氮和磷元素是几乎所有的生物体中均含有的生命元素。回答下列问题:
(1)叠氮酸(HN3)是一种弱酸,在水中能微弱电离出H+和 ,分子中的大Π键可用符号
,分子中的大Π键可用符号 表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为
表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为 ,则
,则 中的大Π键应表示为
中的大Π键应表示为__________________ 。
(2)2001年德国专家从硫酸铵中检出一种组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以 和
和 两种离子的形式存在。
两种离子的形式存在。 中N原子均为sp3杂化,请推测
中N原子均为sp3杂化,请推测 的结构式:
的结构式:_______________________ 。
(3)氨(NH3)和膦(PH3)是两种三角锥形气态氢化物,其键角分别为107°和93.6°,试分析PH3的键角小于NH3的原因:____________________________ 。
(4)ATP(三磷酸腺苷)是一种高能磷酸化合物,在细胞中,它与ADP的相互转化实现贮能和放能,从而保证了细胞各项生命活动的能量供应。ATP的结构简式如图1所示。
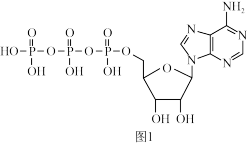 分子中属于sp2杂化的N原子有
分子中属于sp2杂化的N原子有_______________ 个。
(5)某种磁性氮化铁的晶胞结构如图2所示。
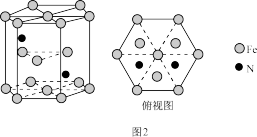
①基态Fe原子的电子排布式为______________________ 。
②该化合物的化学式为___________________________ 。
③若晶胞底边长为anm,高为cnm,NA为阿伏加 德罗常数的值,则该磁性氮化铁的晶体密度为__________________ g.cm-3(用含a、c、NA的代数式表示)。
(1)叠氮酸(HN3)是一种弱酸,在水中能微弱电离出H+和
 ,分子中的大Π键可用符号
,分子中的大Π键可用符号 表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为
表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为 ,则
,则 中的大Π键应表示为
中的大Π键应表示为(2)2001年德国专家从硫酸铵中检出一种组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以
 和
和 两种离子的形式存在。
两种离子的形式存在。 中N原子均为sp3杂化,请推测
中N原子均为sp3杂化,请推测 的结构式:
的结构式:(3)氨(NH3)和膦(PH3)是两种三角锥形气态氢化物,其键角分别为107°和93.6°,试分析PH3的键角小于NH3的原因:
(4)ATP(三磷酸腺苷)是一种高能磷酸化合物,在细胞中,它与ADP的相互转化实现贮能和放能,从而保证了细胞各项生命活动的能量供应。ATP的结构简式如图1所示。
 分子中属于sp2杂化的N原子有
分子中属于sp2杂化的N原子有(5)某种磁性氮化铁的晶胞结构如图2所示。

①基态Fe原子的电子排布式为
②该化合物的化学式为
③若晶胞底边长为anm,高为cnm,NA为阿伏加 德罗常数的值,则该磁性氮化铁的晶体密度为
您最近一年使用:0次



