名校
解题方法
1 . 下列分子或离子的空间结构和中心原子的杂化方式均正确的是
A. 平面三角形 平面三角形  杂化 杂化 | B. 平面三角形 平面三角形  杂化 杂化 |
C. V形 V形  杂化 杂化 | D. 三角锥形 三角锥形  杂化 杂化 |
您最近一年使用:0次
2024-04-21更新
|
243次组卷
|
7卷引用:四川省内江市第六中学2022-2023学年高二上学期期中考试化学试题
四川省内江市第六中学2022-2023学年高二上学期期中考试化学试题天津市静海区四校2022-2023学年高二下学期3月阶段性检测化学试题(已下线)期中模拟预测卷02(测试范围:选择性必修2+选择性必修3第1章)-2022-2023学年高二化学下学期期中期末考点大串讲(人教版2019)天津市第三中学2022-2023学年高二下学期期中质量检测化学试题陕西省渭南市华州区咸林中学2023-2024学年高二下学期第一次月考化学试题浙江省舟山中学2023-2024学年高二下学期4月月考化学试题福建省南安市侨光中学2023-2024学年高二下学期4月月考化学试题
名校
解题方法
2 . 我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为___________ ;单晶硅的晶体类型为___________ 。SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为___________ 。
(2)SiCl4可发生水解反应,机理如下:
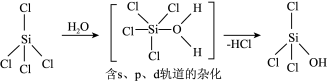
含s、p、d轨道的杂化类型有:①dsp2②sp3d③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为___________ (填标号)。
(3)CS2分子中存在___________ 个σ键和___________ 个π键。
(4)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是___________ 。
(5)FeCO3的阴离子的空间构型为___________ ,写出一种与该阴离子互为等电子体的分子的化学式___________ 。
(6)工业上常用羰基镍[Ni(CO)4]制备高纯镍,其熔点-19°C,沸点43℃,试分析晶体中σ键与π键数目的比值为___________ ,羰基镍属于___________ 晶体。已知钛和铝的相对原子半径分别是1.45和1.43,钛的硬度比铝大的原因是___________ 。
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为
(2)SiCl4可发生水解反应,机理如下:

含s、p、d轨道的杂化类型有:①dsp2②sp3d③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为
(3)CS2分子中存在
(4)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是
(5)FeCO3的阴离子的空间构型为
(6)工业上常用羰基镍[Ni(CO)4]制备高纯镍,其熔点-19°C,沸点43℃,试分析晶体中σ键与π键数目的比值为
您最近一年使用:0次
名校
解题方法
3 .  能吸收有害紫外线,保护人类赖以生存的空间。
能吸收有害紫外线,保护人类赖以生存的空间。 的分子结构如图,呈V形,两个键的夹角为116.5°,三个原子以一个O原子为中心,与另外两个O原子分别构成一个共价键;中间O原子提供两个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键——三个O原子均等地享有这些电子。
的分子结构如图,呈V形,两个键的夹角为116.5°,三个原子以一个O原子为中心,与另外两个O原子分别构成一个共价键;中间O原子提供两个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键——三个O原子均等地享有这些电子。 ,新生状态的“O”具有极强氧化性,请回答:
,新生状态的“O”具有极强氧化性,请回答:

(1)下列分子与 分子的结构最相似的是___________。
分子的结构最相似的是___________。
(2)分子中某原子有一对或几对没有跟其他原子共用的价电子叫孤对电子,那么 分子有
分子有___________ 对孤对电子。
(3) 中“特殊的化学键”是
中“特殊的化学键”是___________ 键(填“ ”或“
”或“ ”)。中心原子的杂化方式为
”)。中心原子的杂化方式为___________ 。
(4)配平反应___________ :_______PbS+_______ _______
_______ _______
_______
 能吸收有害紫外线,保护人类赖以生存的空间。
能吸收有害紫外线,保护人类赖以生存的空间。 的分子结构如图,呈V形,两个键的夹角为116.5°,三个原子以一个O原子为中心,与另外两个O原子分别构成一个共价键;中间O原子提供两个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键——三个O原子均等地享有这些电子。
的分子结构如图,呈V形,两个键的夹角为116.5°,三个原子以一个O原子为中心,与另外两个O原子分别构成一个共价键;中间O原子提供两个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键——三个O原子均等地享有这些电子。 ,新生状态的“O”具有极强氧化性,请回答:
,新生状态的“O”具有极强氧化性,请回答:
(1)下列分子与
 分子的结构最相似的是___________。
分子的结构最相似的是___________。A. | B. | C. | D. |
 分子有
分子有(3)
 中“特殊的化学键”是
中“特殊的化学键”是 ”或“
”或“ ”)。中心原子的杂化方式为
”)。中心原子的杂化方式为(4)配平反应
 _______
_______ _______
_______
您最近一年使用:0次
名校
解题方法
4 . 将少量硫酸铜溶液滴入氨基乙酸钠溶液(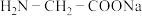 )中即可得到结构如图所示的产物。下列叙述错误的是
)中即可得到结构如图所示的产物。下列叙述错误的是
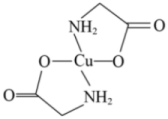
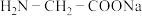 )中即可得到结构如图所示的产物。下列叙述错误的是
)中即可得到结构如图所示的产物。下列叙述错误的是
A.氨基乙酸钠中的氮原子采取 杂化 杂化 |
B.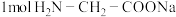 中含有 中含有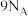 个 个 键 键 |
C.产物中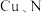 原子VSEPR模型均为四面体形结构 原子VSEPR模型均为四面体形结构 |
| D.该反应产物为配合物,只有内界而无外界 |
您最近一年使用:0次
名校
解题方法
5 . 下列分子中的中心原子杂化轨道的类型相同的是
| A.CO2与SO2 | B.CH4与NH3 |
| C.BeCl2与BF3 | D.C2H6与C2H2 |
您最近一年使用:0次
2022-11-30更新
|
1148次组卷
|
24卷引用:四川省江油中学2022-2023学年高二上学期期中测试化学试题
四川省江油中学2022-2023学年高二上学期期中测试化学试题四川省成都市蒲江县蒲江中学2020-2021学年高二3月月考化学试题内蒙古赤峰市元宝山区第一中学2021-2022学年高二下学期4月月考化学试题专题4 分子空间结构与物质性质 第一单元 分子的空间结构 第1课时 分子的空间结构模型第二节 分子的空间结构 第2课时 杂化轨道理论福建省福州市格致中学2018-2019学年高二下学期期中考试化学试题福建省南安市侨光中学2019-2020学年高二下学期第一次阶段考化学试题吉林省通化市通化县综合高级中学2019-2020学年高二下学期期中考试化学试题河北省衡水市桃城区第十四中学2019-2020学年高二下学期摸底考试化学试题新疆生产建设兵团第四师第一中学2019-2020学年高二下学期期中考试化学试题江苏省盐城市东台市创新学校2019-2020学年高二下学期5月份月检测化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第二节 分子的空间结构(人教版2019)选择性必修2 第二章 分子结构与性质 学科素养提升鲁科版2019选择性必修2第2章 微粒间相互作用与物质性质 第2章学科素养提升(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第2节 共价键与分子的空间结构高二选择性必修2(人教版2019)第二章 分子结构与性质 第二节 分子的空间结构 课时2 杂化轨道理论(已下线)2.2.1 分子空间结构的理论分析-2020-2021学年高二化学课时同步练(鲁科2019选择性必修2)福建省莆田第二十五中学2020-2021学年高二下学期第一次月考化学试题黑龙江省齐齐哈尔市第一中学2020-2021学年高二下学期4月月考化学试题新疆维吾尔自治区乌鲁木齐市第四中学2020-2021学年高二年级下学期期中考试化学试题吉林省长春市榆树高级中学2020-2021学年高二下学期期中考试化学试题福建省福州市金山中学2020-2021学年高二下期中考试化学试题(已下线)2.2 分子空间结构-同步学习必备知识4.1.1杂化轨道理论 课中
名校
6 . 用价层电子对互斥理论预测H2S和AlCl3的立体结构,两个结论都正确的是
| A.直线形;三角锥形 | B.V形;三角锥形 |
| C.直线形;平面三角形 | D.V形;平面三角形 |
您最近一年使用:0次
名校
解题方法
7 . 核电荷数依次增大的A、B、C、D、E、F都是周期表中前四周期的元素,其中A、B、C是同一周期的非金属元素。化合物 的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,
的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,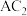 为非极性分子,B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高,E原子的一种核素的质量数为49,中子数为27。F元素是第四周期元素中未成对电子数最多的元素,
为非极性分子,B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高,E原子的一种核素的质量数为49,中子数为27。F元素是第四周期元素中未成对电子数最多的元素, 能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,1
能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,1 配合物与足量的
配合物与足量的 溶液反应能立即生成3
溶液反应能立即生成3
 。请根据以上情况,回答下列问题:
。请根据以上情况,回答下列问题:
(1)B氢化物与 反应生成的含有B元素粒子的空间构型是
反应生成的含有B元素粒子的空间构型是_______ 。
(2) 的空间构型为
的空间构型为____________ ; 还可以和某一价阴离子互为等电子体,该阴离子化学式为
还可以和某一价阴离子互为等电子体,该阴离子化学式为_______ ,这种阴离子常用于检验日常生活中的一种金属阳离子,则金属阳离子符号为__________ 。
(3)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应中氧化剂与还原剂的物质的量之比是_______ 。
(4) 的核外电子排布式是
的核外电子排布式是__________ , 形成的六配位的配合物化学式为
形成的六配位的配合物化学式为____________ 。
(5)E的一种氧化物晶胞结构(长方体)如图所示,该氧化物的化学式为_____________ ;若该晶胞的三个晶胞参数分别为:a 、b
、b 、c
、c ,则该氧化物的密度为
,则该氧化物的密度为__________  (写出表达式即可)
(写出表达式即可)

 的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,
的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,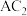 为非极性分子,B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高,E原子的一种核素的质量数为49,中子数为27。F元素是第四周期元素中未成对电子数最多的元素,
为非极性分子,B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高,E原子的一种核素的质量数为49,中子数为27。F元素是第四周期元素中未成对电子数最多的元素, 能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,1
能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,1 配合物与足量的
配合物与足量的 溶液反应能立即生成3
溶液反应能立即生成3
 。请根据以上情况,回答下列问题:
。请根据以上情况,回答下列问题:(1)B氢化物与
 反应生成的含有B元素粒子的空间构型是
反应生成的含有B元素粒子的空间构型是(2)
 的空间构型为
的空间构型为 还可以和某一价阴离子互为等电子体,该阴离子化学式为
还可以和某一价阴离子互为等电子体,该阴离子化学式为(3)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应中氧化剂与还原剂的物质的量之比是
(4)
 的核外电子排布式是
的核外电子排布式是 形成的六配位的配合物化学式为
形成的六配位的配合物化学式为(5)E的一种氧化物晶胞结构(长方体)如图所示,该氧化物的化学式为
 、b
、b 、c
、c ,则该氧化物的密度为
,则该氧化物的密度为 (写出表达式即可)
(写出表达式即可)
您最近一年使用:0次
名校
解题方法
8 . 短周期主族元素R、X、Y、Z、W的原子序数依次增大,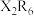 、
、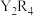 和
和 都是18电子微粒。
都是18电子微粒。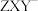 常用于检验
常用于检验 的存在。下列判断正确的是
的存在。下列判断正确的是
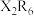 、
、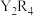 和
和 都是18电子微粒。
都是18电子微粒。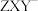 常用于检验
常用于检验 的存在。下列判断正确的是
的存在。下列判断正确的是A. 分子的空间构型为直线形 分子的空间构型为直线形 |
B.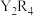 为非极性分子 为非极性分子 |
C.元素的氧化物对应的水化物酸性: |
D. 分子中 分子中 键和 键和 键数之比为4∶5 键数之比为4∶5 |
您最近一年使用:0次
名校
9 . 如表为长式周期表的一部分,其中的编号代表对应的元素。
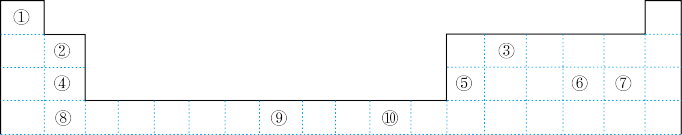
请回答下列问题:
(1)表中属于d区的元素是_______ (填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为_______ 。
(3)④⑤⑥⑦四种元素的第一电离能由大到小的顺序是_______ (用元素符号表示)。
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的未成对电子数为_______ ;该元素与元素①形成的分子X的立体构型为_______ ,与⑧在同一周期的元素中的未成对电子数目最多的元素的价电子排布式是_______ 。
(5)某些不同族元素的性质也有一定的相似性,如表中元素⑤与元素②的氢氧化物有相似的性质,请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:_______ 。

请回答下列问题:
(1)表中属于d区的元素是
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为
(3)④⑤⑥⑦四种元素的第一电离能由大到小的顺序是
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的未成对电子数为
(5)某些不同族元素的性质也有一定的相似性,如表中元素⑤与元素②的氢氧化物有相似的性质,请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:
您最近一年使用:0次
名校
10 . W、X、M、Y、Z四种短周期元素的原子序数依次增大。其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;X原子的L电子层中未成对电子数与Y相同,但还有空轨道;W、Z的原子序数相差10,且Z原子的第一电离能在同周期中最小。
(1)写出下列元素的元素名称:W_______ , Z_______ 。
(2)元素X的一种同位素可测定文物年代,这种同位素的符号是_______ 。
(3)M元素可形成很多重要的化合物,比较MH 和MH3的键角∠HMH的大小:MH
和MH3的键角∠HMH的大小:MH
_______ MH3(填“>”或“<”或“=”),请用价层电子对互斥理论解释_______ 。
(4)W2、W2Y、XY2三种分子中,以极性键结合的非极性分子与Z2Y2反应的化学方程式_______ 。
(1)写出下列元素的元素名称:W
(2)元素X的一种同位素可测定文物年代,这种同位素的符号是
(3)M元素可形成很多重要的化合物,比较MH
 和MH3的键角∠HMH的大小:MH
和MH3的键角∠HMH的大小:MH
(4)W2、W2Y、XY2三种分子中,以极性键结合的非极性分子与Z2Y2反应的化学方程式
您最近一年使用:0次



