解题方法
1 .  是人体必需微量元素之一、研究表明硒代蛋氨酸(结构简式如下图)有抗氧化作用,对肿瘤细胞增殖有显著抑制作用。
是人体必需微量元素之一、研究表明硒代蛋氨酸(结构简式如下图)有抗氧化作用,对肿瘤细胞增殖有显著抑制作用。_______ 。
(2)N、O、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为_______ , 的空间结构为
的空间结构为_______ 。
(3)固态硒代蛋氨酸晶体类型为_______ ,硒代蛋氨酸分子中 的杂化方式为
的杂化方式为_______ 。
(4)比较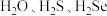 的沸点大小:
的沸点大小:_______ ,原因是_______ 。
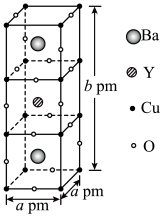
(5)某种具有氧原子缺陷的超导材料的长方体晶胞结构如图所示。晶胞参数分别为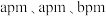 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。已知该晶体中
。已知该晶体中 为
为 价,Y为
价,Y为 价,O为
价,O为 价,则
价,则
_______ ,该晶体的密度为_______  。
。
 是人体必需微量元素之一、研究表明硒代蛋氨酸(结构简式如下图)有抗氧化作用,对肿瘤细胞增殖有显著抑制作用。
是人体必需微量元素之一、研究表明硒代蛋氨酸(结构简式如下图)有抗氧化作用,对肿瘤细胞增殖有显著抑制作用。
(2)N、O、
 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为 的空间结构为
的空间结构为(3)固态硒代蛋氨酸晶体类型为
 的杂化方式为
的杂化方式为(4)比较
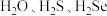 的沸点大小:
的沸点大小:(5)某种具有氧原子缺陷的超导材料的长方体晶胞结构如图所示。晶胞参数分别为
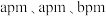 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。已知该晶体中
。已知该晶体中 为
为 价,Y为
价,Y为 价,O为
价,O为 价,则
价,则
 。
。
您最近一年使用:0次
名校
2 . NH3分子的空间结构为_____ ,其中N原子的杂化轨道类型为_____ 。
您最近一年使用:0次
3 . 2021年9月Science杂志发表了我国科学家利用CO2合成人工淀粉(ASAP)的论文。据介绍,该方法合成速率是玉米的8.5倍,能量转化效率是玉米的3.5倍。
已知人工合成淀粉的代谢途径(ASAP)可以简化表示为:
(2)写出符合下列条件的DHA的一种同分异构体_____ 。
①属于链状化合物②含有两种官能团③含有手性碳原子
已知人工合成淀粉的代谢途径(ASAP)可以简化表示为:
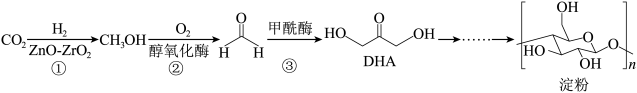
| A.碳原子采用sp3、sp2杂化 |
| B.每个链节含一个平面六边形 |
| C.每个链节中含有的官能团为羟基和醚键 |
| D.淀粉可以发生酯化反应 |
(2)写出符合下列条件的DHA的一种同分异构体
①属于链状化合物②含有两种官能团③含有手性碳原子
您最近一年使用:0次
4 . 利用CH4超干重整CO2技术,可以得到富含CO和H2的化工原料气,对碳达峰和碳中和有重要意义,反应如下:CH4(g)+CO2(g) 2CO(g)+2H2(g)
2CO(g)+2H2(g)  =+247.4kJ·mol−1
=+247.4kJ·mol−1
(1)反应过程中断裂的化学键属于______。
(2)该反应的熵变∆S___________ 0(填“>”“=”或“<”),需要在___________ 条件下进行(填“低温”或“高温”)。
(3)CO2的电子式为___________ ;CO2分子中碳原子的杂化方式为___________ 杂化,1molCO2中含有___________ molπ键。
(4)已知部分化学键的键能如下:
由此计算断裂1molCO分子中的共价键需要吸收___________ kJ能量。
 2CO(g)+2H2(g)
2CO(g)+2H2(g)  =+247.4kJ·mol−1
=+247.4kJ·mol−1(1)反应过程中断裂的化学键属于______。
| A.离子键 | B.极性共价键 |
| C.非极性共价键 | D.氢键 |
(2)该反应的熵变∆S
(3)CO2的电子式为
(4)已知部分化学键的键能如下:
| 共价键 | C-H | H-H | C=O |
| 键能(kJ/mol) | 413 | 436 | 745 |
您最近一年使用:0次
5 . 氮、磷、硫、氯等非金属元素的单质和化合物在工农业生产中有重要应用。回答下列问题:
(1)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为___________ 。某厂废液中含有2%∼5%的 ,直接排放会造成污染,下列物质能使
,直接排放会造成污染,下列物质能使 转化为
转化为 的是
的是___________ (填标号)。
A. B.
B. C.
C.
(2) 及正盐
及正盐 均可将溶液中的
均可将溶液中的 还原为银,从而可用于化学镀银。
还原为银,从而可用于化学镀银。
① 为
为___________ 元酸(填“一”二”或“三”),磷原子的杂化方式为___________ 。
②利用 进行化学镀银,反应中氧化剂与还原剂的物质的量之比为
进行化学镀银,反应中氧化剂与还原剂的物质的量之比为 ,则氧化产物为
,则氧化产物为___________ (填化学式)。
(3)硫代硫酸钠晶体( ),又名大苏打、海波,是一种用途非常广泛的化学试剂,遇酸立即分解,生成淡黄色沉淀,放出的气体能使品红溶液褪色,试写出硫代硫酸钠溶液与稀硫酸反应的离子方程式:
),又名大苏打、海波,是一种用途非常广泛的化学试剂,遇酸立即分解,生成淡黄色沉淀,放出的气体能使品红溶液褪色,试写出硫代硫酸钠溶液与稀硫酸反应的离子方程式:___________ 。
(4)氯气与氢氧化钠在70℃时反应,生成物中 和
和 的物质的量之比为
的物质的量之比为 ,其离子方程式为
,其离子方程式为___________ 。
(1)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为
 ,直接排放会造成污染,下列物质能使
,直接排放会造成污染,下列物质能使 转化为
转化为 的是
的是A.
 B.
B. C.
C.
(2)
 及正盐
及正盐 均可将溶液中的
均可将溶液中的 还原为银,从而可用于化学镀银。
还原为银,从而可用于化学镀银。①
 为
为②利用
 进行化学镀银,反应中氧化剂与还原剂的物质的量之比为
进行化学镀银,反应中氧化剂与还原剂的物质的量之比为 ,则氧化产物为
,则氧化产物为(3)硫代硫酸钠晶体(
 ),又名大苏打、海波,是一种用途非常广泛的化学试剂,遇酸立即分解,生成淡黄色沉淀,放出的气体能使品红溶液褪色,试写出硫代硫酸钠溶液与稀硫酸反应的离子方程式:
),又名大苏打、海波,是一种用途非常广泛的化学试剂,遇酸立即分解,生成淡黄色沉淀,放出的气体能使品红溶液褪色,试写出硫代硫酸钠溶液与稀硫酸反应的离子方程式:(4)氯气与氢氧化钠在70℃时反应,生成物中
 和
和 的物质的量之比为
的物质的量之比为 ,其离子方程式为
,其离子方程式为
您最近一年使用:0次
2024高三·全国·专题练习
6 . NA为阿伏加德罗常数的值。下列说法正确的是_______ 。
A.(2023·全国卷)标准状况下,2.24LSO3中电子的数目为4.00NA
B.(2023·广东卷)NaCl和NH4Cl的混合物中含1molCl-,则混合物中质子数为28NA
C.(2022·辽宁卷)1.8g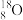 中含有的中子数为NA
中含有的中子数为NA
D.(2022·浙江6月)8g CH4含有中子数为3NA
E.(2022·海南卷)2.8g56Fe含有的中子数为1.3NA
F.(2021·天津卷)180g葡萄糖中,C原子的数目为6NA
G.(2021·广东卷)23gNa与足量H2O反应生成的H2分子数目为NA
H.(2021·河北卷)22.4L(标准状况)氟气所含的质子数为18NA
I.(2021·湖北卷)23gCH3CH2OH中sp3杂化的原子数为NA
J.(2021·湖北卷)0.5molXeF4中氙的价层电子对数为3NA
K.(2021·湖南卷)18gH218O含有的中子数为10NA
L.(2021·海南卷)0.1mol 27Al3+中含有的电子数为1.3NA
M.(2021·海南卷)0.1mol肼(H2N-NH2)含有的孤电子对数为0.2NA
N.(2021·全国甲卷)18g重水(D2O)中含有的质子数为10NA
A.(2023·全国卷)标准状况下,2.24LSO3中电子的数目为4.00NA
B.(2023·广东卷)NaCl和NH4Cl的混合物中含1molCl-,则混合物中质子数为28NA
C.(2022·辽宁卷)1.8g
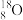 中含有的中子数为NA
中含有的中子数为NAD.(2022·浙江6月)8g CH4含有中子数为3NA
E.(2022·海南卷)2.8g56Fe含有的中子数为1.3NA
F.(2021·天津卷)180g葡萄糖中,C原子的数目为6NA
G.(2021·广东卷)23gNa与足量H2O反应生成的H2分子数目为NA
H.(2021·河北卷)22.4L(标准状况)氟气所含的质子数为18NA
I.(2021·湖北卷)23gCH3CH2OH中sp3杂化的原子数为NA
J.(2021·湖北卷)0.5molXeF4中氙的价层电子对数为3NA
K.(2021·湖南卷)18gH218O含有的中子数为10NA
L.(2021·海南卷)0.1mol 27Al3+中含有的电子数为1.3NA
M.(2021·海南卷)0.1mol肼(H2N-NH2)含有的孤电子对数为0.2NA
N.(2021·全国甲卷)18g重水(D2O)中含有的质子数为10NA
您最近一年使用:0次
2023高三·全国·专题练习
7 . 周期表中VIIA族元素及其化合物应用广泛。Cl2是一种重要的化工原料,大量用于制造盐酸、有机溶剂、农药、燃料和药品等;ClO2用作自来水消毒剂;NaClO、Ca(ClO)2既可用作漂白棉麻、纸张的漂白剂,又可用作游泳池等场所的消毒剂;氯可形成多种含氧酸HClO、HClO2、HClO3、HClO4;AgBr可用作感光材料;AgI可用于人工降雨;KIO3常用作食盐中的补碘剂。
已知下列离子反应自发进行:
①CO2+Ca2++2ClO-+H2O=CaCO3↓+2HClO
② +HClO=
+HClO= +ClO-
+ClO-
下列说法正确的是____________ 。
A.由反应①可推断:Ka2(H2CO3)>Ka(HClO)
B.向新制饱和氯水中加入少量碳酸钙,固体不会溶解
C.向等物质的量浓度NaHCO3和NaClO混合液中加入CaCl2(s),可生成HClO
D.将CO2通入NaClO溶液中,发生反应:CO2+2NaClO+H2O=Na2CO3+HClO
E.AgBr呈淡黄色,可用作感光材料
F.Cl2易液化,可用作生产漂白液
G.ClO2具有强氧化性,可用作自来水消毒
H.KIO3易溶于水,可用作食盐中加碘
J. 中O-Cl-O夹角大于
中O-Cl-O夹角大于 中O-Cl-O夹角
中O-Cl-O夹角
K.ClO2是由极性键构成的非极性分子
M.碘原子(53I)基态核外电子排布式为5s25p5
N.前五周期的ⅦA族元素单质的晶体类型相同
已知下列离子反应自发进行:
①CO2+Ca2++2ClO-+H2O=CaCO3↓+2HClO
②
 +HClO=
+HClO= +ClO-
+ClO-下列说法正确的是
A.由反应①可推断:Ka2(H2CO3)>Ka(HClO)
B.向新制饱和氯水中加入少量碳酸钙,固体不会溶解
C.向等物质的量浓度NaHCO3和NaClO混合液中加入CaCl2(s),可生成HClO
D.将CO2通入NaClO溶液中,发生反应:CO2+2NaClO+H2O=Na2CO3+HClO
E.AgBr呈淡黄色,可用作感光材料
F.Cl2易液化,可用作生产漂白液
G.ClO2具有强氧化性,可用作自来水消毒
H.KIO3易溶于水,可用作食盐中加碘
J.
 中O-Cl-O夹角大于
中O-Cl-O夹角大于 中O-Cl-O夹角
中O-Cl-O夹角K.ClO2是由极性键构成的非极性分子
M.碘原子(53I)基态核外电子排布式为5s25p5
N.前五周期的ⅦA族元素单质的晶体类型相同
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
8 . 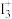 离子的中心原子的杂化形式为
离子的中心原子的杂化形式为___________ 。
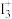 离子的中心原子的杂化形式为
离子的中心原子的杂化形式为
您最近一年使用:0次
名校
解题方法
9 . NH3、H2O 以及分子 PH3的空间结构和相应的键角如下图所示。
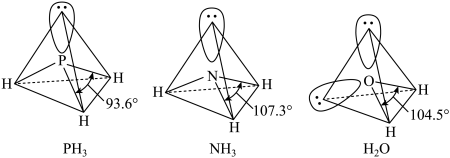
(1)PH3中P的杂化类型是___________ ,H2O 的键角小于 NH3,分析原因___________ 。
(2)H2O、PH3、KH按熔点由高到低的顺序排列为___________ 。
(3)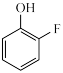 的分子内部存在氢键,画出含氢键的分子结构:
的分子内部存在氢键,画出含氢键的分子结构:___________ ,形成分子内氢键一般会使得熔点___________ 。(填“升高”或“降低”)

(1)PH3中P的杂化类型是
(2)H2O、PH3、KH按熔点由高到低的顺序排列为
(3)
 的分子内部存在氢键,画出含氢键的分子结构:
的分子内部存在氢键,画出含氢键的分子结构:
您最近一年使用:0次
名校
解题方法
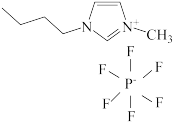
10 . 离子液体熔点很低,常温下呈液态,正负离子可自由移动,因此离子液体在电池中可作为______ ,某离子液体的结构如图所示,其中碳原子杂化方式为______ 。

您最近一年使用:0次



