解题方法
1 . 下列分子是非极性分子且中心原子采取sp2杂化的是
| A.CS2 | B.NH3 | C.SO2 | D.SO3 |
您最近一年使用:0次
2023-01-12更新
|
129次组卷
|
2卷引用:海南省华东师范大学第二附属中学乐东黄流中学2022-2023学年高二上学期期中检测化学试题
解题方法
2 . 锗石含有人体所需的硒、锌、镍、钴、锰、镁、铁等三十多种对人体有益的微量元素。
(1)基态铁原子的价电子排布式 为_______ 。
(2)Ni(CO)4常温下为无色液体,沸点42.1°C,熔点−19.3°C,难溶于水,易溶于有机溶剂。推测Ni(CO)4是_______ 分子(“极性”或“非性极”)。
(3)Co2+可与 形成配离子[Co(NO3)4]2−,该配离子中各元素的第一电离能由小到大的顺序为
形成配离子[Co(NO3)4]2−,该配离子中各元素的第一电离能由小到大的顺序为_______ (用元素符号表示), 中N的杂化方式为
中N的杂化方式为_______ 。
(4)氨气中H−N−H键的键角为107.3°,[Zn(NH3)6]2+离子中H−N−H键的键角_______ 107.3°(填“大于”“小于”或“等于”),原因是:_______ 。
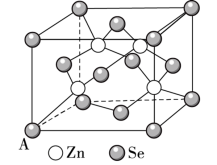
(5)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,已知晶胞边长为apm,阿伏加德罗常数的值为NA,该晶胞密度ρ为_______ g·cm-3(只列出计算式,1pm=10-10cm)。
(1)基态铁原子的
(2)Ni(CO)4常温下为无色液体,沸点42.1°C,熔点−19.3°C,难溶于水,易溶于有机溶剂。推测Ni(CO)4是
(3)Co2+可与
 形成配离子[Co(NO3)4]2−,该配离子中各元素的第一电离能由小到大的顺序为
形成配离子[Co(NO3)4]2−,该配离子中各元素的第一电离能由小到大的顺序为 中N的杂化方式为
中N的杂化方式为(4)氨气中H−N−H键的键角为107.3°,[Zn(NH3)6]2+离子中H−N−H键的键角
(5)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,已知晶胞边长为apm,阿伏加德罗常数的值为NA,该晶胞密度ρ为

您最近一年使用:0次
3 . 中草药黄芩对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是
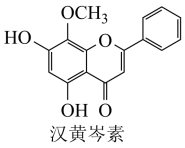

| A.含有3种含氧官能团 |
| B.遇FeCl3溶液能显色 |
| C.分子中碳原子均采用sp2杂化 |
| D.与足量H2发生完全加成反应,1mol该物质最多消耗7molH2 |
您最近一年使用:0次
解题方法
4 . 钴(Co)及其化合物是一种应用广泛的金属及其化合物,可用做催化剂、半导体等;草酸铵(NH4)2C2O4用于制取草酸钴的反应为(NH4)2C2O4+CoCl=CoC2O4+2NH4Cl。
(1)27Co在元素周期表的位置是_______ 。其基态原子的价层电子排布式_______ 。
(2)NH 中的氮原子的杂化轨道类型是
中的氮原子的杂化轨道类型是_______ 。NH 的空间构型是
的空间构型是_______ 。
(1)27Co在元素周期表的位置是
(2)NH
 中的氮原子的杂化轨道类型是
中的氮原子的杂化轨道类型是 的空间构型是
的空间构型是
您最近一年使用:0次
5 . 我国科学家研究发现,在KOH催化下,CO(NH2)2和LiTPSI还原形成稳定的LiF/高分子双层SEI,使LiMn2O4//Li4T15O12电池稳定工作。请回答下列问题:
(1)基态Mn2+的电子排布式为[Ar]____ 。基态K原子核外电子云轮廓图呈球形的能级上占据的电子总数为____ 。
(2)Mn的第三电离能大于Fe的第三电离能的主要原因是____ 。
(3)CO(NH2)2中元素电负性由大到小的顺序为____ (用元素符号表示)。CO(NH2)2分子中碳原子的杂化方式为____ 。
(4)几种钛的卤化物的熔点如表所示:
钛的卤化物熔点呈上述变化的主要原因是____ 。
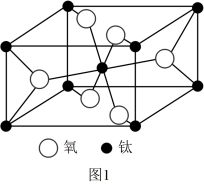
(5)一种钛的氧化物晶胞如图1所示,其化学式为____ 。
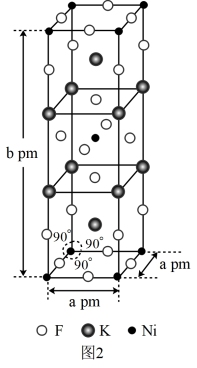
(6)由钾、镍、氟组成的一种晶体结构如图2所示,该晶体密度为____ g·cm-3(只列计算式即可)。
(1)基态Mn2+的电子排布式为[Ar]
(2)Mn的第三电离能大于Fe的第三电离能的主要原因是
(3)CO(NH2)2中元素电负性由大到小的顺序为
(4)几种钛的卤化物的熔点如表所示:
| 卤化物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -25 | 39 | 150 |
(5)一种钛的氧化物晶胞如图1所示,其化学式为

(6)由钾、镍、氟组成的一种晶体结构如图2所示,该晶体密度为

您最近一年使用:0次
名校
解题方法
6 . 银氨溶液是检验醛基的重要试剂之一。配制银氨溶液的操作是向稀硝酸银溶液中滴加稀氨水至浊液刚好变澄清,发生的反应有AgNO3+NH3·H2O=AgOH↓+NH4NO3,AgOH+2NH3=[Ag(NH3)2]++OH-。下列说法错误的是
| A.NH4NO3中N原子分别采取sp3、sp2杂化 |
| B.[Ag(NH3)2]OH中存在共价键、配位键和离子键 |
| C.NH3与H2O均是极性分子 |
| D.1mol甲醛与银氨溶液反应时最多消耗2mol[Ag(NH3)2]OH |
您最近一年使用:0次
2022-04-26更新
|
223次组卷
|
2卷引用:海南省海口市2021-2022学年高三下学期学生学科能力诊断化学试题
解题方法
7 . 下列分子中心原子是 sp2 杂化的是
| A.H2O | B.CH4 | C.SO2 | D.CS2 |
您最近一年使用:0次
2022-04-24更新
|
59次组卷
|
2卷引用:海南省儋州川绵中学2021-2022学年高二下学期期中考试化学试题
名校
解题方法
8 . 下列描述中,正确的是
A. 是空间结构为V形的极性分子 是空间结构为V形的极性分子 |
B. 的空间结构为平面三角形 的空间结构为平面三角形 |
C. 中所有的原子不都在一个平面上 中所有的原子不都在一个平面上 |
D. 和 和 的中心原子的杂化轨道类型均为 的中心原子的杂化轨道类型均为 杂化 杂化 |
您最近一年使用:0次
2021-12-03更新
|
2204次组卷
|
15卷引用:海南省儋州川绵中学2021-2022学年高二下学期期中考试化学试题
海南省儋州川绵中学2021-2022学年高二下学期期中考试化学试题重庆市万州纯阳中学校2021-2022学年高二下学期期中考试化学试题重庆市巫山县官渡中学2021-2022学年高二下学期期末考试化学试题广东省佛山市顺德区第一中学2022-2023学年高二下学期4月期中考试化学试题人教2019选择性必修2第二章 分子结构与性质复习与提高湖北省潜江市华中师范大学潜江附属中学高二上学期12月月考化学试题辽宁省大石桥市第三高级中学2021-2022学年高二12月月考化学试题吉林省吉林市田家炳高级中学2022-2023学年高二上学期期末线上考试化学试题浙江省宁波市奉化区2022-2023学年高二上学期期末联考化学试题北京市顺义区第一中学2022-2023学年高二下学期3月月考化学试题广东省云浮市罗定中学2022-2023学年高二下学期第2周周测(分子结构与性质)化学试题广东省深圳市盐田高级中学2023-2024学年高二上学期1月期末化学试题(已下线)热点04 分子的空间结构贵州省安龙县第一中学2023-2024学年高二下学期第一次阶段考试化学试题内蒙古赤峰新城红旗中学2023-2024学年高二下学期4月月考化学试题
名校
9 . 三价铬离子( )是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、HO、N、S、Cr等。回答下列问题:
)是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、HO、N、S、Cr等。回答下列问题:
(1)Cr的价层电子排布式为_______ 。
(2)O、N、S的原子半径由大到小的顺序为_______ 。
(3) 分子的 VSEPR模型名称为
分子的 VSEPR模型名称为_______ ,其中心原子的杂化方式为_______ 。
(4)化学式为 的化合物有多种结构,其中一种可表示为
的化合物有多种结构,其中一种可表示为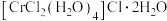 ,该物质的配离子中提供孤电子对的原子为
,该物质的配离子中提供孤电子对的原子为_______ ,配位数为_______ 。
(5) 分子可以与
分子可以与 结合生成
结合生成 ,这个过程发生改变的是
,这个过程发生改变的是_______ (填序号)。
a.微粒的空间结构 b.N原子的杂化类型 c.H-N-H键角 d.微粒的电子数
 )是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、HO、N、S、Cr等。回答下列问题:
)是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、HO、N、S、Cr等。回答下列问题:(1)Cr的价层电子排布式为
(2)O、N、S的原子半径由大到小的顺序为
(3)
 分子的 VSEPR模型名称为
分子的 VSEPR模型名称为(4)化学式为
 的化合物有多种结构,其中一种可表示为
的化合物有多种结构,其中一种可表示为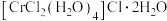 ,该物质的配离子中提供孤电子对的原子为
,该物质的配离子中提供孤电子对的原子为(5)
 分子可以与
分子可以与 结合生成
结合生成 ,这个过程发生改变的是
,这个过程发生改变的是a.微粒的空间结构 b.N原子的杂化类型 c.H-N-H键角 d.微粒的电子数
您最近一年使用:0次
2021-06-19更新
|
194次组卷
|
2卷引用:海南省东方市东方中学2021-2022学年高二下学期期中考试化学试题
名校
10 . 金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为____________ ;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO______ FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为________ 、_________ ;
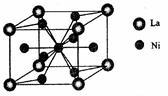
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_________ ;
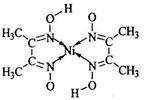
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是________ ,氮镍之间形成的化学键是______ ;
②该结构中,氧氢之间除共价键外还可存在__________ ;
③该结构中,碳原子的杂化轨道类型有______________ 。
(1)Ni原子的核外电子排布式为
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO
(3)NiO晶胞中Ni和O的配位数分别为
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为


(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是
②该结构中,氧氢之间除共价键外还可存在
③该结构中,碳原子的杂化轨道类型有
您最近一年使用:0次
2019-01-30更新
|
1035次组卷
|
5卷引用:海南省儋州市鑫源中学2021-2022学年高二下学期期中考试化学试题
海南省儋州市鑫源中学2021-2022学年高二下学期期中考试化学试题(已下线)2011届江苏省无锡一中高三上学期期中考试化学卷(已下线)2014高考名师推荐化学--预测16贵州省遵义正安县一中2020届高三上学期开学考试化学试题江苏省无锡市市北高级中学2023-2024学年高二上学期期末检测化学试卷



