名校
解题方法
1 . 氮、氧、磷、砷及其化合物在工农业生产等方面有着重要应用。请按要求回答下列问题。
(1)基态砷原子价电子排布图不能写为 ,是因为该排布方式违背了
,是因为该排布方式违背了__________ 这一原理。
(2)元素第一电离能N______ O(填“>”或“<”或“=”,下同),电负性P______  。
。
(3)肼 可用作火箭燃料等,它的沸点远高于乙烯的原因是:
可用作火箭燃料等,它的沸点远高于乙烯的原因是:__________ 。
(4)尿素( )中碳原子杂化类型
)中碳原子杂化类型__________ ; 离子的立体构型(即空间构型)为
离子的立体构型(即空间构型)为__________ 。
(5) 的熔点为1238℃可作半导体材料;而
的熔点为1238℃可作半导体材料;而 的熔点为77.9℃。
的熔点为77.9℃。
①预测 的晶体类型为
的晶体类型为__________ 。
② 晶胞结构如图所示,晶胞边长为
晶胞结构如图所示,晶胞边长为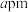 。则晶胞中每个
。则晶胞中每个 原子周围有
原子周围有__________ 个紧邻等距的 原子;该晶体的密度为
原子;该晶体的密度为__________  (列出计算式)。
(列出计算式)。

(1)基态砷原子价电子排布图不能写为
 ,是因为该排布方式违背了
,是因为该排布方式违背了(2)元素第一电离能N
 。
。(3)肼
 可用作火箭燃料等,它的沸点远高于乙烯的原因是:
可用作火箭燃料等,它的沸点远高于乙烯的原因是:(4)尿素(
 )中碳原子杂化类型
)中碳原子杂化类型 离子的立体构型(即空间构型)为
离子的立体构型(即空间构型)为(5)
 的熔点为1238℃可作半导体材料;而
的熔点为1238℃可作半导体材料;而 的熔点为77.9℃。
的熔点为77.9℃。①预测
 的晶体类型为
的晶体类型为②
 晶胞结构如图所示,晶胞边长为
晶胞结构如图所示,晶胞边长为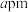 。则晶胞中每个
。则晶胞中每个 原子周围有
原子周围有 原子;该晶体的密度为
原子;该晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2022-11-20更新
|
1002次组卷
|
6卷引用:天津市河北区2022-2023学年高三上学期期中质量检测化学试题
天津市河北区2022-2023学年高三上学期期中质量检测化学试题(已下线)2022年天津市普通高中学业水平等级性考试化学试题变式题(结构与性质)(已下线)北京市海淀区2022届高三一模(结构与性质)(已下线)期中模拟预测卷03(测试范围:选择性必修2+选择性必修3第1-2章)-2022-2023学年高二化学下学期期中期末考点大串讲(人教版2019)宁夏青铜峡市宁朔中学2022-2023学年高二下学期期中考试化学试题吉林省吉林松花江中学2022-2023学年高二上学期1月期末考试化学试题
名校
2 . 下列关于 的分子结构说法不正确的是
的分子结构说法不正确的是
 的分子结构说法不正确的是
的分子结构说法不正确的是| A.分子中最多有12个碳原子在同一平面内 | B.该结构中的碳原子有两种杂化方式 |
| C.分子中最多有6个碳原子在同一直线上 | D.1mol该物质最多能与6mol氢气加成 |
您最近一年使用:0次
2022-05-18更新
|
243次组卷
|
2卷引用:天津市第二十一中学2021-2022学年高二下学期期中考试化学试题
3 . HCHO与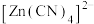 在水溶液中发生反应:
在水溶液中发生反应: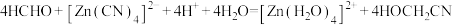 (
( 结构类似氮气),下列说法正确的是
结构类似氮气),下列说法正确的是
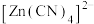 在水溶液中发生反应:
在水溶液中发生反应: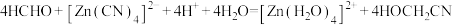 (
( 结构类似氮气),下列说法正确的是
结构类似氮气),下列说法正确的是| A.甲醛(HCHO)的键角约为120°,分子之间存在氢键 |
B.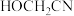 碳原子的杂化方式相同 碳原子的杂化方式相同 |
C.与 的配位能力: 的配位能力: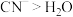 |
D.1mol配离子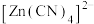 中,σ键和π键的数目之比为1∶1 中,σ键和π键的数目之比为1∶1 |
您最近一年使用:0次
名校
解题方法
4 . Mn和Ni是构成合金钢金(即铁合金)的主要元素。请回答下列问题:
(1)Mn在元素周期表中的位置_______ ,
(2)Ni的价电子排布式为_______ ,属于_______ 区的元素;
(3)过硫酸盐(S2O )氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示,H2S2O8中S的轨道杂化方式为
)氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示,H2S2O8中S的轨道杂化方式为_______ ;

(4)NiO、FeO属于_______ 晶体,已知r(Ni2+)>r(Fe2+),则熔点NiO_______ FeO(填“<"或“>’’),原因是_______ 。
(5)铜盐是自然界中重要的盐,向CuSO4溶液中加入过量稀氨水,所涉及的化学反应有_______ ,_______ ;
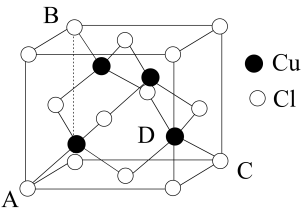
(6)已知CuCl的晶胞结构如图所示:晶胞中边长为688pm,阿伏加德罗常数的值为NA,则该晶体密度为_______ g·cm-3(列出计算式即可)。
(1)Mn在元素周期表中的位置
(2)Ni的价电子排布式为
(3)过硫酸盐(S2O
 )氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示,H2S2O8中S的轨道杂化方式为
)氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示,H2S2O8中S的轨道杂化方式为
(4)NiO、FeO属于
(5)铜盐是自然界中重要的盐,向CuSO4溶液中加入过量稀氨水,所涉及的化学反应有
(6)已知CuCl的晶胞结构如图所示:晶胞中边长为688pm,阿伏加德罗常数的值为NA,则该晶体密度为

您最近一年使用:0次
2022-04-02更新
|
222次组卷
|
2卷引用:天津市西青区杨柳青第一中学2021-2022学年高二下学期期中考试化学试题
名校
解题方法
5 . 下列分子的中心原子的杂化轨道类型为sp3杂化的是
| A.CO2 | B.SO2 | C.BF3 | D.NH3 |
您最近一年使用:0次
2021-06-29更新
|
342次组卷
|
4卷引用:天津市西青区杨柳青第一中学2021-2022学年高二下学期期中考试化学试题
天津市西青区杨柳青第一中学2021-2022学年高二下学期期中考试化学试题天津市崇化中学2022-2023学年高二下学期阶段性质量监测化学试题天津市河北区2020-2021学年高二下学期期末质量检测化学试题(已下线)题型01 分子的空间构型及杂化类型的判断-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(天津专用)
名校
6 . 表为周期表的一部分,其中的编号代表对应的元素,请用元素符号 回答下列问题
(1)上述元素中,属于ds区的是_______ (填元素符号)。
(2)不能 说明⑨的金属性比⑩强的是_______ 。
A.⑨与稀盐酸反应比⑩与同条件稀盐酸反应剧烈;
B.⑨单质的熔、沸点比⑩的低;
C.⑨的最高价氧化物对应水化物的碱性比⑩的最高价氧化物对应水化物的碱性强;
D.与非金属单质反应时,⑨原子失电子数目比⑩原子失电子数目少;
(3)④与元素①形成的最简单化合物X是_______ 分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______ 分子的空间构型为_______ 。
(4)元素⑫与 可形成
可形成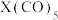 型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于
型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于_______ 晶体(填晶体类型)。
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ||||||||||||||||
| ⑨ | ⑩ | ⑪ | ⑫ | ⑬ | ⑭ |
(2)
A.⑨与稀盐酸反应比⑩与同条件稀盐酸反应剧烈;
B.⑨单质的熔、沸点比⑩的低;
C.⑨的最高价氧化物对应水化物的碱性比⑩的最高价氧化物对应水化物的碱性强;
D.与非金属单质反应时,⑨原子失电子数目比⑩原子失电子数目少;
(3)④与元素①形成的最简单化合物X是
(4)元素⑫与
 可形成
可形成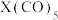 型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于
型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于
您最近一年使用:0次
2021-04-28更新
|
654次组卷
|
4卷引用:天津北京师范大学静海附属学校2021-2022学年高二下学期期中考试化学试题
天津北京师范大学静海附属学校2021-2022学年高二下学期期中考试化学试题天津市耀华中学2020-2021学年高二下学期期中检测化学试题专题4 综合检测(基础卷)(已下线)【知识图鉴】单元讲练测选择性必修2第二章03单元测
名校
解题方法
7 . 下列关于物质结构的命题中,错误的项数有( )
①CH3COOH分子中碳原子的杂化类型有sp2和sp3两种
②元素Ge位于周期表第四周期IVA族,核外电子排布式为 [Ar]4s24p2,属于p区
③非极性分子往往具有高度对称性,如BF3、PCl5、H2O2、CO2这样的分子
④Na2O、Na2O2、NaHSO4晶体中的阴、阳离子个数比均为1 :2
⑤Cu(OH)2是一种蓝色絮状沉淀,既能溶于硝酸、也能溶于氨水,是两性氢氧化物
⑥氨水中大部分NH3与H2O以氢键(用“...”表示)结合成NH3·H2O分子,根据氨水的性质可知NH3·H2O的结构式可记为: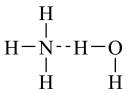
⑦HF沸点高于HCl,是因为 HCl共价键键能小于HF
⑧可燃冰中甲烷分子与水分子之间存在氢键
①CH3COOH分子中碳原子的杂化类型有sp2和sp3两种
②元素Ge位于周期表第四周期IVA族,核外电子排布式为 [Ar]4s24p2,属于p区
③非极性分子往往具有高度对称性,如BF3、PCl5、H2O2、CO2这样的分子
④Na2O、Na2O2、NaHSO4晶体中的阴、阳离子个数比均为1 :2
⑤Cu(OH)2是一种蓝色絮状沉淀,既能溶于硝酸、也能溶于氨水,是两性氢氧化物
⑥氨水中大部分NH3与H2O以氢键(用“...”表示)结合成NH3·H2O分子,根据氨水的性质可知NH3·H2O的结构式可记为:

⑦HF沸点高于HCl,是因为 HCl共价键键能小于HF
⑧可燃冰中甲烷分子与水分子之间存在氢键
| A.4项 | B.5项 | C.6项 | D.7项 |
您最近一年使用:0次
2020-07-16更新
|
2739次组卷
|
9卷引用:天津北京师范大学静海附属学校2021-2022学年高二下学期期中考试化学试题
天津北京师范大学静海附属学校2021-2022学年高二下学期期中考试化学试题辽宁省沈阳市东北育才学校科学高中2021-2022学年高二下学期线上4月测试化学试题专题4 分子空间结构与物质性质 本专题达标检测天津市五校2023届高三一模联考化学试题山西省太原市山西大学附属中学2019-2020学年高二下学期5月化学试题山西省朔州市怀仁市第一中学校云东校区2019-2020学年高二下学期期末考试化学试题山东省潍坊市诸城一中2021届高三11月份模拟化学试题辽宁省东北育才学校2021-2022学年高三上学期( 高中部) 第三次模拟考试化学试题(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破
名校
8 . 下列说法正确的是( )
A. ( ( ,且 ,且 为整数)型分子中,若中心原子没有孤对电子,则 为整数)型分子中,若中心原子没有孤对电子,则 为空间对称结构,属于非极性分子 为空间对称结构,属于非极性分子 |
| B.水很稳定是因为水中含有大量的氢键 |
C. 、 、 、 、 分子中的 分子中的 分别形成2个、3个、4个键,故 分别形成2个、3个、4个键,故 分别采取 分别采取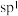 、 、 、 、 杂化 杂化 |
D.配合物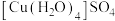 中,中心离子是 中,中心离子是 ,配体是 ,配体是 ,配位数是1 ,配位数是1 |
您最近一年使用:0次
2020-04-10更新
|
567次组卷
|
19卷引用:天津北京师范大学静海附属学校2021-2022学年高二下学期期中考试化学试题
天津北京师范大学静海附属学校2021-2022学年高二下学期期中考试化学试题福建省永春县第一中学2018-2019学年高二下学期期中考试化学试题天津市第二十中学2019-2020学年高二下学期阶段性检测化学试题辽宁省沈阳市东北育才学校双语学校2022-2023学年高二下学期期中考试化学试题2016-2017学年河北省衡水中学高二上学期五调考试化学试卷河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第二章 综合检测2河北省唐山市开滦第二中学2017-2018学年高二4月月考化学试题河南省开封市兰考县第一高级中学2018-2019学年高二下学期3月月考化学试题吉林省扶余市第一中学2018-2019学年高二下学期第一次月考化学试题江苏省徐州市第一中学2019-2020学年高二下学期第三次在线检测化学试题第2章 化学键与分子间作用力——C挑战区模拟高考(鲁科版选修3)湖北省襄阳市第一中学2019-2020学年高二下学期四月月考化学试题河北省石家庄市启明中学2019-2020学年高二四月月考化学试题河北省宣化区第一中学2019-2020学年高二4月月考化学试题安徽省六安市舒城中学2019-2020学年高二下学期第一次月考化学试题河北省遵化市2019-2020学年高二下学期期末考试化学试题(已下线)第二单元 化学键与分子间作用力(能力提升卷)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练宁夏银川市第六中学2020-2021学年高二下学期期末考试化学试题



