名校
解题方法
1 . 下列分子或离子的空间结构和中心原子的杂化方式均正确的是
A. 平面三角形 平面三角形  杂化 杂化 | B. 平面三角形 平面三角形  杂化 杂化 |
C. V形 V形  杂化 杂化 | D. 三角锥形 三角锥形  杂化 杂化 |
您最近一年使用:0次
2024-04-21更新
|
266次组卷
|
7卷引用:四川省内江市第六中学2022-2023学年高二上学期期中考试化学试题
四川省内江市第六中学2022-2023学年高二上学期期中考试化学试题(已下线)期中模拟预测卷02(测试范围:选择性必修2+选择性必修3第1章)-2022-2023学年高二化学下学期期中期末考点大串讲(人教版2019)天津市第三中学2022-2023学年高二下学期期中质量检测化学试题天津市静海区四校2022-2023学年高二下学期3月阶段性检测化学试题陕西省渭南市华州区咸林中学2023-2024学年高二下学期第一次月考化学试题浙江省舟山中学2023-2024学年高二下学期4月月考化学试题福建省南安市侨光中学2023-2024学年高二下学期4月月考化学试题
名校
2 . [Zn(CN)4]2-在水溶液中可与HCHO发生反应生成[Zn(H2O)4]2+和HOCH2CN,下列说法错误的是
| A.Zn2+基态核外电子排布式为[Ar]3d10 |
| B.1molHCHO分子中含有σ键的数目为3mol |
| C.HOCH2CN分子中碳原子轨道的杂化类型是sp3 |
D.[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,可表示为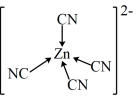 |
您最近一年使用:0次
2024-03-19更新
|
153次组卷
|
2卷引用:福建省漳州市东山第二中学2021-2022学年高二下学期期中考试化学试题
名校
3 . NH3具有易液化、含氢密度高、应用广泛等优点,NH3的合成及应用一直是科学研究的重要课题。
(1)以H2、N2合成NH3,Fe是常用的催化剂。
①基态Fe原子的电子排布式为_____ 。
②我国科学家开发出Fe-LiH等双中心催化剂,在合成NH3中显示出高催化活性。第一电离能(I1):I1(H)>I1(Li)>I1(Na),原因是_____ 。
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱。
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
①1体积水可溶解1体积CO2,1体积水可溶解约700体积NH3,NH3极易溶于水的原因是_____ 。
②NaHCO3分解得Na2CO3., 空间结构为
空间结构为_____ 。
(3)NH3、NH3BH3(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
①NH3的中心原子的杂化轨道类型为_____ 。
②比较熔点:NH3BH3_____ CH3CH3(填“>”或“<”)。
(4)NF3的结构与NH3类似,但是性质差异较大。
①NF3的空间结构名称为_____ 。
②NH3BH3具有碱性(可与H+结合)而NF3没有碱性。原因是_____ 。
(1)以H2、N2合成NH3,Fe是常用的催化剂。
①基态Fe原子的电子排布式为
②我国科学家开发出Fe-LiH等双中心催化剂,在合成NH3中显示出高催化活性。第一电离能(I1):I1(H)>I1(Li)>I1(Na),原因是
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱。
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
①1体积水可溶解1体积CO2,1体积水可溶解约700体积NH3,NH3极易溶于水的原因是
②NaHCO3分解得Na2CO3.,
 空间结构为
空间结构为(3)NH3、NH3BH3(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
| 元素 | H | B | N | F |
| 电负性 | 2.1 | 2.0 | 3.0 | 4.0 |
②比较熔点:NH3BH3
(4)NF3的结构与NH3类似,但是性质差异较大。
①NF3的空间结构名称为
②NH3BH3具有碱性(可与H+结合)而NF3没有碱性。原因是
您最近一年使用:0次
2024-03-03更新
|
281次组卷
|
2卷引用:北京市第十九中学2021-2022学年高二下学期期中考试化学试题
23-24高二下·全国·课后作业
名校
解题方法
4 . 下列分子中的中心原子杂化轨道的类型相同的是
| A.CO2与SO2 | B.C2H4与C2H2 | C.BeCl2与BF3 | D.H2O与H3O+ |
您最近一年使用:0次
2024-03-03更新
|
598次组卷
|
7卷引用:北京市第十九中学2021-2022学年高二下学期期中考试化学试题
5 . 硅和卤素单质反应可以得到 。
。
 的熔沸点
的熔沸点
(1)①沸点依次升高的原因是______ ,②气态 分子的空间构型是
分子的空间构型是______ ;
(2) 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如图甲所示。
的空间结构和相应的键角如图甲所示。 中P的杂化类型是
中P的杂化类型是______ 。
② 的沸点比
的沸点比 的
的______ (高或者低),原因是______ 。
(3)① 的空间构型为
的空间构型为______ (用文字描述);抗坏血酸的分子结构如图乙所示,分子中碳原子的轨道杂化类型为②______ ;③推测抗坏血酸在水中的溶解性______ (填“难溶于水”或“易溶于水”)。
 。
。 的熔沸点
的熔沸点
|
|
|
| |
熔点/K | 183.0 | 203.2 | 278.6 | 393.7 |
沸点/K | 187.2 | 330.8 | 427.2 | 560.7 |
(1)①沸点依次升高的原因是
 分子的空间构型是
分子的空间构型是(2)
 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如图甲所示。
的空间结构和相应的键角如图甲所示。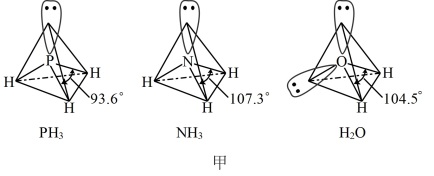
 中P的杂化类型是
中P的杂化类型是②
 的沸点比
的沸点比 的
的(3)①
 的空间构型为
的空间构型为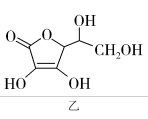
您最近一年使用:0次
2024-02-25更新
|
227次组卷
|
2卷引用:广东省惠州市惠东县惠东荣超中学2021-2022学年高二下学期期中考试 化学试题
名校
解题方法
6 . 下列离子的VSEPR模型与离子的空间立体构型一致的是
A. | B. | C. | D. |
您最近一年使用:0次
2023-12-21更新
|
587次组卷
|
42卷引用:浙江省湖州市三贤联盟2021-2022学年高二下学期期中联考化学试题
浙江省湖州市三贤联盟2021-2022学年高二下学期期中联考化学试题四川省乐山市峨眉第二中学2022-2023学年高二上学期期中考试化学试题黑龙江省大庆市第四中学2018-2019学年高二下学期期中考试化学试题广西壮族自治区崇左市天等县高级中学2019-2020学年高二下学期期中考试理科综合化学试题山西省太原市2020-2021学年高二下学期期中质量监测理科化学试题黑龙江省绥化市第九中学2021-2022学年高二4月月考化学试题重庆市九龙坡区2021~2022学年高二下学期期末统考化学试题安徽省滁州市九校2021-2022学年高二下学期3月月考化学试题云南省玉溪市江川区第一中学2021-2022学年高二下学期3月月考化学试题第二节 分子的空间结构 第1课时 分子结构的测定 多样的分子空间结构 价层电子对互斥模型云南省富宁县第一中学校2021-2022学年高二下学期开学考试化学题宁夏贺兰县景博中学2021-2022学年高二下学期第一次月考化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第二章02练基础广东省肇庆市封开县广信中学等几校2022-2023学年高二下学期期中联考化学试题天津市第四十七中学2022-2023学年高二下学期期中考试化学试题 湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题浙江省台州市三门启超中学2023-2024学年高二上学期期中考试化学试题 宁夏育才中学勤行校区2016-2017学年高二下学期第一次(3月)月考化学试题【全国百强校】天津市静海区第一中学2018-2019学年高二下学期5月月考化学试题宁夏海原县第一中学2019-2020学年高二下学期期末考试化学试题(已下线)第二单元 化学键与分子间作用力(基础过关)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)福建省莆田第十五中学2019-2020学年高二下学期期末考试化学试题人教2019选择性必修2第二章第二节 分子的空间结构课后习题黑龙江省绥化市第二中学2022-2023年高三上学期第一次月考化学试题重庆市第一中学2022-2023学年高二上学期期末考试化学试题湖南省长沙市湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题北京市顺义区第一中学2022-2023学年高二下学期3月月考化学试题广东省韶关市新丰县第一中学2022-2023学年高二3月月考化学试题四川省自贡市2022-2023学年高二下学期期末考试化学试题北京师范大学第二附属中学2023-2024学年高二上学期12月月考化学试题 江西省宜春市宜丰中学2023-2024学年高二上学期12月月考化学试题(已下线)第04讲 分子的空间结构-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)辽宁省葫芦岛市普通高中2023-2024学年高二上学期学业质量监测考试化学试题江西省宜春市上高中学2023-2024学年高二上学期第二次月考化学试卷 (已下线)热点04 分子的空间结构(已下线)广东省深圳中学2023-2024学年高二上学期期末考试化学试题(已下线)广东省深圳市深圳中学2023-2024学年高二上学期期末考试化学试题四川省达州市高级中学校2023-2024学年高二下学期3月月考化学试题广东省潮州市饶平县第二中学2023-2024学年高二下学期第一次月考化学试题天津市红桥区2020-2021学年高三上学期期末考试化学试题浙江省绍兴市柯桥区2022-2023学年高一下学期期末教学质量检测化学(实验班)试题(已下线)第4讲 空间构型
名校
解题方法
7 . 某温泉富含珍稀“锗”元素。其中锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等30多种对人体有益的微量元素。回答下列问题:
(1)锗与碳同族,性质和结构有一定的相似性,锗元素能形成无机化合物(如锗酸钠:Na2GeO3;二锗酸钠:Na2Ge2O5等),也能形成类似于烷烃的锗烷(GenH2n+2)。
①Na2GeO3中锗原子的杂化方式是_____ 。
②推测1molGenH2n+2中含有的σ键的数目是_____ (用NA表示阿伏加德罗常数值)。
(2)利用离子液体[EMIM][AlCl4]可电沉积还原金属Ge,其熔点只有7℃,其中EMIM+结构如图所示。

①该物质的晶体类型是_____ 。
②EMIM+离子中组成元素的电负性由小到大的顺序是_____ 。
(3)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,该晶胞中硒原子的配位数是_____ ;已知晶胞边长为apm,乙图为甲图的俯视图,A点坐标为(0,0,0),B点坐标为 ,则D点坐标为
,则D点坐标为_____ ;若该晶胞密度为ρg·cm-3,则阿伏加德罗常数NA为_____ (列出计算式)。

(1)锗与碳同族,性质和结构有一定的相似性,锗元素能形成无机化合物(如锗酸钠:Na2GeO3;二锗酸钠:Na2Ge2O5等),也能形成类似于烷烃的锗烷(GenH2n+2)。
①Na2GeO3中锗原子的杂化方式是
②推测1molGenH2n+2中含有的σ键的数目是
(2)利用离子液体[EMIM][AlCl4]可电沉积还原金属Ge,其熔点只有7℃,其中EMIM+结构如图所示。

①该物质的晶体类型是
②EMIM+离子中组成元素的电负性由小到大的顺序是
(3)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,该晶胞中硒原子的配位数是
 ,则D点坐标为
,则D点坐标为
您最近一年使用:0次
2023-10-06更新
|
69次组卷
|
2卷引用:江西省宜春市宜丰中学2022-2023学年高二上学期11月期中(第二次月考)化学试题
名校
解题方法
8 . 我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为___________ ;单晶硅的晶体类型为___________ 。SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为___________ 。
(2)SiCl4可发生水解反应,机理如下:
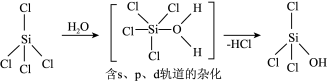
含s、p、d轨道的杂化类型有:①dsp2②sp3d③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为___________ (填标号)。
(3)CS2分子中存在___________ 个σ键和___________ 个π键。
(4)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是___________ 。
(5)FeCO3的阴离子的空间构型为___________ ,写出一种与该阴离子互为等电子体的分子的化学式___________ 。
(6)工业上常用羰基镍[Ni(CO)4]制备高纯镍,其熔点-19°C,沸点43℃,试分析晶体中σ键与π键数目的比值为___________ ,羰基镍属于___________ 晶体。已知钛和铝的相对原子半径分别是1.45和1.43,钛的硬度比铝大的原因是___________ 。
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为
(2)SiCl4可发生水解反应,机理如下:

含s、p、d轨道的杂化类型有:①dsp2②sp3d③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为
(3)CS2分子中存在
(4)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是
(5)FeCO3的阴离子的空间构型为
(6)工业上常用羰基镍[Ni(CO)4]制备高纯镍,其熔点-19°C,沸点43℃,试分析晶体中σ键与π键数目的比值为
您最近一年使用:0次
名校
解题方法
9 . 磷及其化合物在工业生产中起着重要的作用。
(1)基态磷原子的价层电子排布图为
___________ 。
(2)磷元素有白磷、黑磷等常见的单质。黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体具有与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是
___________ (填字母序号)。
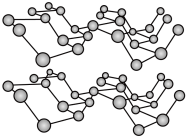
a.黑磷与白磷互为同素异形体 b.层与层之间的作用力是共价键
c.黑磷晶体属于混合型晶体 d.分子中磷原子杂化类型为 杂化
杂化
(3) 与水会形成黄色的配离子
与水会形成黄色的配离子
 ,为避免颜色干扰,常在
,为避免颜色干扰,常在
 溶液中加入
溶液中加入
 形成无色的
形成无色的
 。由此推测,与
。由此推测,与
 能形成更稳定配离子的配体是
能形成更稳定配离子的配体是
___________ ,其空间结构是
___________ 。
(4)第IIIA族磷化物均为共价化合物,被广泛用于高温技术、新型电子产品等领域。
①实验测定磷化铝和磷化铟(InP)的熔点分别为2000、1070℃,二者属于___________ 晶体,其熔点差异的主要原因是___________ 。
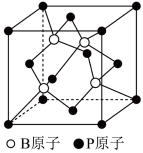
②磷化硼是一种半导体材料,其晶胞结构如图所示。已知晶胞边长apm,阿伏加德罗常数为 ,则磷化硼晶体的密度是
,则磷化硼晶体的密度是___________  (列出表达式)。
(列出表达式)。
(1)基态磷原子的价层电子排布图为
(2)磷元素有白磷、黑磷等常见的单质。黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体具有与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是

a.黑磷与白磷互为同素异形体 b.层与层之间的作用力是共价键
c.黑磷晶体属于混合型晶体 d.分子中磷原子杂化类型为
 杂化
杂化(3)
 与水会形成黄色的配离子
与水会形成黄色的配离子 ,为避免颜色干扰,常在
,为避免颜色干扰,常在 溶液中加入
溶液中加入 形成无色的
形成无色的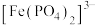 。由此推测,与
。由此推测,与 能形成更稳定配离子的配体是
能形成更稳定配离子的配体是(4)第IIIA族磷化物均为共价化合物,被广泛用于高温技术、新型电子产品等领域。
①实验测定磷化铝和磷化铟(InP)的熔点分别为2000、1070℃,二者属于
②磷化硼是一种半导体材料,其晶胞结构如图所示。已知晶胞边长apm,阿伏加德罗常数为
 ,则磷化硼晶体的密度是
,则磷化硼晶体的密度是 (列出表达式)。
(列出表达式)。
您最近一年使用:0次
名校
解题方法
10 . 原子序数依次增大的 A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子 2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素; E和 C位于同一主族,F的原子序数为29。
(1)F原子基态的价层电子排布式为_______ 。
(2)元素B的简单气态氢化物的沸点_______ (填“高于”或“低于”)元素A的简单气态氢化物的沸点,其主要原因是_______ 。
(3)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为_______ 。
(4)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为_______ 。
(5)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为_______ 。

(6)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因:_______ 。
(1)F原子基态的价层电子排布式为
(2)元素B的简单气态氢化物的沸点
(3)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为
(4)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为
(5)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为

(6)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因:
您最近一年使用:0次