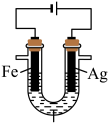
解题方法
1 . 实验室以活性炭为催化剂,由 制备三氯化六氨合钴(Ⅲ)
制备三氯化六氨合钴(Ⅲ)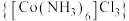 的装置如图所示:
的装置如图所示:

已知: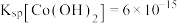 ;
; 具有较强还原性,
具有较强还原性, 不易被氧化。
不易被氧化。
回答下列问题:
(1)仪器c的名称是___________ ;d中无水 的作用是
的作用是___________ 。
(2)向混合液中先加入浓氨水,目的是___________ ,混合液中 的作用是
的作用是___________ ;充分反应后再加入双氧水,水浴加热,控制温度为55℃的原因是___________ 。
(3) 制备
制备 的化学方程式为
的化学方程式为___________ ;将反应后的混合物趁热过滤,待滤液冷却后加入适量浓盐酸,冰水冷却、抽滤、乙醇洗涤、干燥,得到 晶体,抽滤的优点是
晶体,抽滤的优点是___________ 。
(4)为测定产品中钴的含量,进行下列实验:
Ⅰ.称取3.5400g产品,加入足量NaOH溶液蒸出 ,再加入稀硫酸,使
,再加入稀硫酸,使 全部转化为
全部转化为 ,然后将溶液配制成250mL,取25.00mL于锥形瓶中,加入过量的KI溶液,用
,然后将溶液配制成250mL,取25.00mL于锥形瓶中,加入过量的KI溶液,用 标准溶液滴定至终点,消耗标准溶液13.30mL。
标准溶液滴定至终点,消耗标准溶液13.30mL。
Ⅱ.另取与步骤Ⅰ中等量的KI溶液于锥形瓶中,用上述标准溶液进行滴定,消耗 标准溶液1.30mL。
标准溶液1.30mL。
①样品中钴元素的质量分数为___________ 。
②若步骤Ⅱ滴定前滴定管内无气泡,滴定后有气泡,会使测定结果___________ (填“偏大”“偏小”或“不变”)。
 制备三氯化六氨合钴(Ⅲ)
制备三氯化六氨合钴(Ⅲ)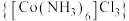 的装置如图所示:
的装置如图所示:
已知:
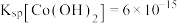 ;
; 具有较强还原性,
具有较强还原性, 不易被氧化。
不易被氧化。回答下列问题:
(1)仪器c的名称是
 的作用是
的作用是(2)向混合液中先加入浓氨水,目的是
 的作用是
的作用是(3)
 制备
制备 的化学方程式为
的化学方程式为 晶体,抽滤的优点是
晶体,抽滤的优点是(4)为测定产品中钴的含量,进行下列实验:
Ⅰ.称取3.5400g产品,加入足量NaOH溶液蒸出
 ,再加入稀硫酸,使
,再加入稀硫酸,使 全部转化为
全部转化为 ,然后将溶液配制成250mL,取25.00mL于锥形瓶中,加入过量的KI溶液,用
,然后将溶液配制成250mL,取25.00mL于锥形瓶中,加入过量的KI溶液,用 标准溶液滴定至终点,消耗标准溶液13.30mL。
标准溶液滴定至终点,消耗标准溶液13.30mL。Ⅱ.另取与步骤Ⅰ中等量的KI溶液于锥形瓶中,用上述标准溶液进行滴定,消耗
 标准溶液1.30mL。
标准溶液1.30mL。①样品中钴元素的质量分数为
②若步骤Ⅱ滴定前滴定管内无气泡,滴定后有气泡,会使测定结果
您最近一年使用:0次
名校
2 . 配位化合物广泛应用于物质分离、定量测定、医药、催化等方面。利用氧化法可制备某些配位化合物,如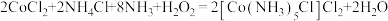 。设
。设 是阿伏加德罗常数的值,下列叙述正确的是
是阿伏加德罗常数的值,下列叙述正确的是
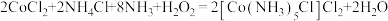 。设
。设 是阿伏加德罗常数的值,下列叙述正确的是
是阿伏加德罗常数的值,下列叙述正确的是A. 中含有 中含有 键的数目为 键的数目为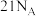 |
B. 的 的 溶液中, 溶液中, 的数目为 的数目为 |
C.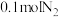 与足量 与足量 在催化剂作用下合成氨,生成的 在催化剂作用下合成氨,生成的 分子数为 分子数为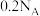 |
D. 质量分数为 质量分数为 的 的 溶液中,氧原子总数为 溶液中,氧原子总数为 |
您最近一年使用:0次
2022-11-17更新
|
696次组卷
|
6卷引用:山东省济南市章丘区2022-2023学年高三上学期诊断性测试化学试题
山东省济南市章丘区2022-2023学年高三上学期诊断性测试化学试题辽宁省葫芦岛市协作校2022-2023学年高三上学期第二次考试化学试题(已下线)专题卷04 阿伏加德罗常数及其应用-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)湖南省长沙市雅礼中学2023-2024学年高三上学期一模化学试题福建省厦门外国语学校石狮分校、泉港第一中学2022-2023学年高三上学期期中考试化学试题2024届广西2024年“贵百河”高三下学期4月新高考模拟二模化学试题
名校
解题方法
3 . 甘氨酸亚铁晶体是一种新型的固体整合补铁剂。其实验室合成路线为:
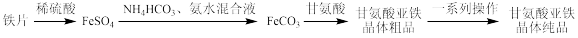
已知:
①相关物质的信息如下表所示
②含有多个配位原子的配体与同一中心离子通过整合配位成环而形成的配合物称为整合物。
(一)FeCO3固体的制备
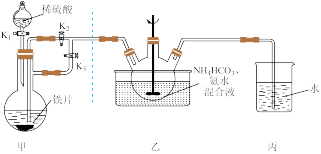
(1)实验开始时应先开K1和___________ ,关___________ (填“K2”或“K3”);一段时间后,改变开关状态,生成FeCO3。
(2)三颈瓶中生成FeCO3沉淀的离子方程式为___________ 。
(二)甘氨酸亚铁的制备
(3)用如图装置制备甘氨酸亚铁。反应开始时,先通过滴液口滴入适量的NaOH溶液调节pH为5左右,pH过高或过低都会使产率下降,原因是___________ 。
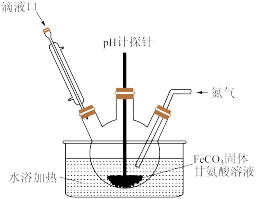
(4)当FeCO3固体完全溶解后,再通过滴液口加入乙醇,其作用是___________ 。
(5)反应结束后,过滤出产品粗品,依次用___________ 、___________ (填序号)洗涤,再经过一系列操作得纯品。
a. 热水 b. 冰水 c. 乙醇
(三)甘氨酸亚铁晶体结构的分析
步骤1:准确称取甘氨酸亚铁晶体纯品0.4800 g于锥形瓶中,加3mol/LH2SO4溶液15 mL将样品溶解完全后,加入指示剂,立即用0.1000 mol/L(NH4)2Ce(SO4)3标准液滴定至终点,用去标准液20.20 mL(反应为Ce4++Fe2+=Ce3++Fe3+)。
步骤2:不加产品,重复步骤1操作,滴定至终点,用去标准液0.20 mL。
回答下列问题:
(6)滴定时应选择___________ 滴定管。
(7)甘氨酸亚铁晶体中Fe的质量分数为___________ %(保留小数点后一位)。
(8)进一步分析表明:甘氨酸亚铁晶体中,阴阳离子只有H2NCH2COO-和Fe2+;Fe2+的配位数为6,且存在五元螯合环;该配合物整体量中心对称,甘氨酸亚铁晶体的结构简式为___________ 。
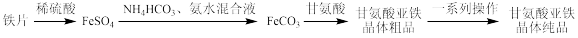
已知:
①相关物质的信息如下表所示
| 物质 | 化学式 | 摩尔质量 | 性质 |
| 甘氨酸 | H2NCH2COOH | 75g/mol | 两性物质,易溶于水,微溶于乙醇 |
| 甘氨酸亚铁晶体 | 易溶于水,溶解度随温度升高而增大;难溶于乙醇,在潮湿的空气中易被氧化 |
(一)FeCO3固体的制备

(1)实验开始时应先开K1和
(2)三颈瓶中生成FeCO3沉淀的离子方程式为
(二)甘氨酸亚铁的制备
(3)用如图装置制备甘氨酸亚铁。反应开始时,先通过滴液口滴入适量的NaOH溶液调节pH为5左右,pH过高或过低都会使产率下降,原因是

(4)当FeCO3固体完全溶解后,再通过滴液口加入乙醇,其作用是
(5)反应结束后,过滤出产品粗品,依次用
a. 热水 b. 冰水 c. 乙醇
(三)甘氨酸亚铁晶体结构的分析
步骤1:准确称取甘氨酸亚铁晶体纯品0.4800 g于锥形瓶中,加3mol/LH2SO4溶液15 mL将样品溶解完全后,加入指示剂,立即用0.1000 mol/L(NH4)2Ce(SO4)3标准液滴定至终点,用去标准液20.20 mL(反应为Ce4++Fe2+=Ce3++Fe3+)。
步骤2:不加产品,重复步骤1操作,滴定至终点,用去标准液0.20 mL。
回答下列问题:
(6)滴定时应选择
(7)甘氨酸亚铁晶体中Fe的质量分数为
(8)进一步分析表明:甘氨酸亚铁晶体中,阴阳离子只有H2NCH2COO-和Fe2+;Fe2+的配位数为6,且存在五元螯合环;该配合物整体量中心对称,甘氨酸亚铁晶体的结构简式为
您最近一年使用:0次
解题方法
4 . 硫代硫酸钠的制备和应用相关流程如图所示,下列有关离子方程式书写正确的是 。
。
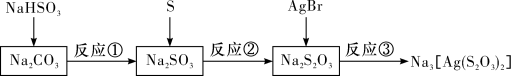
 。
。A.反应③: |
B.向 溶液中加入稀硫酸: 溶液中加入稀硫酸: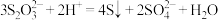 |
C.用 溶液测定碘单质的含量时生成 溶液测定碘单质的含量时生成 ,其离子反应方程式为 ,其离子反应方程式为 |
D.反应①: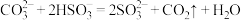 |
您最近一年使用:0次
解题方法
5 . 某兴趣小组探究电镀银实验。回答下列问题:
I.实验准备。
(1)用 固体配制
固体配制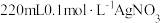 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是___________ (填字母)。___________ 。
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与 浓度有关。
浓度有关。
【查阅资料】
络合反应: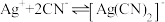 ,
,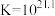 。
。
【设计实验】
【问题讨论】
(3)实验a中,溶液变红色的可能原因是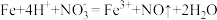 和
和___________ (用离子方程式表示,已知氧化性: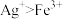 )。
)。
(4)①实验a、b的阴极都伴随有气泡,其原因是___________ (写电极反应式)。
②实验b比实验a产生的镀层光亮、致密,其原理是___________ 。
③一段时间后,实验b中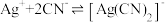 平衡不移动,其原因是
平衡不移动,其原因是___________ 。
【实验结论】
其他条件不变, 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。
Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与
 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。
表2:其他条件不变,温度对镀层外观的影响。
(5)表1中 含量为
含量为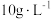 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是___________ ;
表2中温度为 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是___________ 。
Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由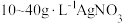 溶液和
溶液和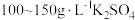 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。
(6)使用新配方可以达到同样的目的,其原理是___________ 。已知: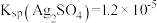 。
。
I.实验准备。
(1)用
 固体配制
固体配制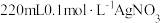 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是A. B.
B. C.
C. D.
D. E.
E.
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与
 浓度有关。
浓度有关。【查阅资料】
络合反应:
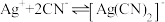 ,
,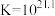 。
。【设计实验】
| 实验 | 装置 | 现象 |
| a |
 的 的 溶液(含少量 溶液(含少量 ) ) | 阴极表面有疏松的黑色物质生成并伴随有无色气泡,一段时间后,取阴极区电解质溶液于试管,滴加 溶液,溶液变为红色。 溶液,溶液变为红色。 |
| b |
 的 的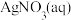 与过量 与过量 混合(含少量 混合(含少量 ) ) | 阴极表面有光亮、致密的银白色物质生成,仍然有少量无色气泡。一段时间后,取少量阴极区溶液于试管,滴加 溶液,溶液不变红。 溶液,溶液不变红。 |
(3)实验a中,溶液变红色的可能原因是
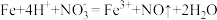 和
和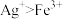 )。
)。(4)①实验a、b的阴极都伴随有气泡,其原因是
②实验b比实验a产生的镀层光亮、致密,其原理是
③一段时间后,实验b中
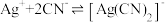 平衡不移动,其原因是
平衡不移动,其原因是【实验结论】
其他条件不变,
 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与

 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。 含量( 含量(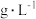 ) ) | 镀层外观表象 |
| 10 | 镀层模糊,无光泽 |
| 25 | 镀层呈雾状,光泽不足 |
| 50 | 镀层光亮、致密 |
温度/ | 镀层外观表象 |
| 25 | 光亮 |
| 35 | 光亮 |
| 40 | 光亮 |
| 55 | 光亮不均匀 |
(5)表1中
 含量为
含量为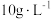 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是表2中温度为
 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由
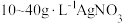 溶液和
溶液和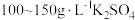 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。(6)使用新配方可以达到同样的目的,其原理是
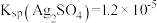 。
。
您最近一年使用:0次
2024-04-16更新
|
318次组卷
|
5卷引用:2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学
2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学2024届青海省西宁市大通县高三下学期第二次模拟考试理科综合试题-高中化学2024届河南省TOP二十名校联考高三下学期5月猜题(一)理科综合试卷-高中化学(已下线)压轴题12?化学实验综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)2024届青海省玉树州高三下学期第四次联考理综试题-高中化学
2023高三·全国·专题练习
解题方法
6 . 碳元素在自然界中分布很广,是存在形式最复杂的元素。实验室可用邻二氮菲(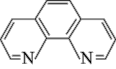 )与
)与 形成的红色配合物(如图)测定铁的含量。
形成的红色配合物(如图)测定铁的含量。
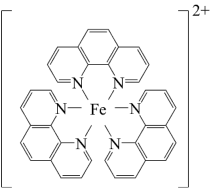
回答下列问题:
(1)基态 原子核外电子的空间运动状态有
原子核外电子的空间运动状态有_______ 种。
(2)红色配合物中H、C、N、 四种元素的电负性从大到小的顺序为
四种元素的电负性从大到小的顺序为_______ 。
(3)邻二氮菲分子中C、N两种元素原子的杂化方式分别为_______ 、_______ 。
(4)红色配离子的中心原子的配位数为_______ 。
(5)红色配离子中不存在的作用力有_______ (填字母)。
A. 键 B.
键 B. 键 C.离子键 D.氢键 E.配位键
键 C.离子键 D.氢键 E.配位键
(6)临床建议服用维生素C促进“亚铁”的吸收,避免生成 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是_______ 。
(7)三甲胺[ ]和乙二胺(
]和乙二胺( )均属于胺,但三甲胺比乙二胺的沸点低得多,原因是
)均属于胺,但三甲胺比乙二胺的沸点低得多,原因是_______ 。
(8)汽车安全气囊产生气体的功臣是叠氮化钠(NaN3), 的空间结构为
的空间结构为_______ 。
 )与
)与 形成的红色配合物(如图)测定铁的含量。
形成的红色配合物(如图)测定铁的含量。
回答下列问题:
(1)基态
 原子核外电子的空间运动状态有
原子核外电子的空间运动状态有(2)红色配合物中H、C、N、
 四种元素的电负性从大到小的顺序为
四种元素的电负性从大到小的顺序为(3)邻二氮菲分子中C、N两种元素原子的杂化方式分别为
(4)红色配离子的中心原子的配位数为
(5)红色配离子中不存在的作用力有
A.
 键 B.
键 B. 键 C.离子键 D.氢键 E.配位键
键 C.离子键 D.氢键 E.配位键(6)临床建议服用维生素C促进“亚铁”的吸收,避免生成
 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是(7)三甲胺[
 ]和乙二胺(
]和乙二胺( )均属于胺,但三甲胺比乙二胺的沸点低得多,原因是
)均属于胺,但三甲胺比乙二胺的沸点低得多,原因是(8)汽车安全气囊产生气体的功臣是叠氮化钠(NaN3),
 的空间结构为
的空间结构为
您最近一年使用:0次
名校
解题方法
7 . 以Cu(NO3)2、氨水、NaOH乙醇溶液为原料制备的纳米CuO催化剂,可用于脱除废气中的AsH3.纳米CuO催化剂的制备、催化氧化、再生可表示为:

(1)As元素在周期表中的位置为___________ 。
(2)流程中“反应”步骤加入过量的氨水,“沉淀”步骤的反应在加热下进行,写出“沉淀”步骤中生成纳米CuO的化学方程式:___________ 。
(3)“沉淀”步骤中加入乙醇的作用是___________ 。
(4)“催化氧化”时,废气中AsH3主要被氧化成As2O3固体除去,温度低于100℃时,生成的固体中砷含量会升高,原因是___________ 。
(5)“再生”时需除去纳米CuO催化剂上的As2O3和少量As2O5,可采用在氮气氛围中加热分解的方法。已知:250℃时催化剂上的As2O3完全升华,350℃时催化剂上的As2O5完全分解为As2O3和O2,将处理过10L废气的纳米CuO催化剂进行加热再生处理,加热到250℃时,催化剂质量减轻了1.9800g,加热到350℃,催化剂质量又减轻了0.4600g。计算10L废气中AsH3的含量是___________ mg·L−1(已知M(As2O3)=198g/mol,M(As2O5)=230g/mol,M(AsH3)=78g/mol,写出计算过程)。
(6)砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料。砷化镓晶胞结构如图所示,晶体中As原子周围与其距离最近的As原子的个数为_______ ;若该晶胞的边长为anm,则砷化镓晶体的密度为___________ g•cm-3.(用含a的式子表示,阿伏加德罗常数的值用NA表示)


(1)As元素在周期表中的位置为
(2)流程中“反应”步骤加入过量的氨水,“沉淀”步骤的反应在加热下进行,写出“沉淀”步骤中生成纳米CuO的化学方程式:
(3)“沉淀”步骤中加入乙醇的作用是
(4)“催化氧化”时,废气中AsH3主要被氧化成As2O3固体除去,温度低于100℃时,生成的固体中砷含量会升高,原因是
(5)“再生”时需除去纳米CuO催化剂上的As2O3和少量As2O5,可采用在氮气氛围中加热分解的方法。已知:250℃时催化剂上的As2O3完全升华,350℃时催化剂上的As2O5完全分解为As2O3和O2,将处理过10L废气的纳米CuO催化剂进行加热再生处理,加热到250℃时,催化剂质量减轻了1.9800g,加热到350℃,催化剂质量又减轻了0.4600g。计算10L废气中AsH3的含量是
(6)砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料。砷化镓晶胞结构如图所示,晶体中As原子周围与其距离最近的As原子的个数为

您最近一年使用:0次
8 . Ag+能与NH3、SCN-、CH3NH2等配体结合。为了探究含银配合物、硝酸银能否发生银镜反应,进行如下实验:
Ⅰ.含银配合物溶液的配制
(1)配制质量分数为10%的NaOH溶液,下列仪器不需要用到的是______ (填仪器名称)。
(2)配制含[Ag(SCN)2]-溶液:向洁净的试管中加入1mL10%NaOH溶液,随后加入1mL2%______ 溶液,再逐滴加入______ 溶液至生成的AgSCN沉淀恰好溶解。
Ⅱ.探究配合物稳定性与银镜反应的关系
不同含银配合物发生银镜反应的对比实验结果如表:
(3)写出实验①中[Ag(SCN)2]-与乙醛反应的离子方程式_______ 。
(4)实验出现银镜时间:①<②<③,可以得出的结论是_______ 。
Ⅲ.探究硝酸银的银镜反应
取一定量AgNO3溶液于试管中,滴入用氢氧化钠碱化的乙醛溶液。
(5)AgOH是白色物质,因此有观点认为该黑色沉淀可能是Ag,或者是二者混合物。立即产生黑色沉淀。也可能是_______ 。
(6)取黑色沉淀于试管中,加入足量的_______ ,若观察到_______ 的现象,则说明黑色沉淀中存在单质Ag。
Ⅰ.含银配合物溶液的配制
(1)配制质量分数为10%的NaOH溶液,下列仪器不需要用到的是

(2)配制含[Ag(SCN)2]-溶液:向洁净的试管中加入1mL10%NaOH溶液,随后加入1mL2%
Ⅱ.探究配合物稳定性与银镜反应的关系
不同含银配合物发生银镜反应的对比实验结果如表:
| 序号 | 配体 | 配位反应 | 温度 | 现象 |
| ① | SCN- | Ag++2SCN- [Ag(SCN)2]- K=2.04×108 [Ag(SCN)2]- K=2.04×108 | 室温 | 1min出现银镜 |
| ② | NH3 | Ag++2NH3 [Ag(NH3)2]+ K=1.6×107 [Ag(NH3)2]+ K=1.6×107 | 室温 | 无明显现象 |
| 60℃ | 8min出现银镜 | |||
| ③ | CH3NH2 | Ag++2CH3NH2 [Ag(CH3NH2)2]+ K=7.8×106 [Ag(CH3NH2)2]+ K=7.8×106 | 室温 | 无明显现象 |
| 60℃ | 15min出现银镜 |
(4)实验出现银镜时间:①<②<③,可以得出的结论是
Ⅲ.探究硝酸银的银镜反应
取一定量AgNO3溶液于试管中,滴入用氢氧化钠碱化的乙醛溶液。
(5)AgOH是白色物质,因此有观点认为该黑色沉淀可能是Ag,或者是二者混合物。立即产生黑色沉淀。也可能是
(6)取黑色沉淀于试管中,加入足量的
您最近一年使用:0次
名校
解题方法
9 . X、Y、Z、W是原子序数依次增大的短周期主族元素,其中X、W元素的价电子数等于其周期数,Z是地壳中含量最多的元素。它们形成的一种化合物M结构式如右图,下列说法正确的是:


A.化合物M中,W、Z、Y的均为 杂化 杂化 |
| B.X和Z的单质都属于非极性分子 |
| C.氢化物的沸点:Y<Z |
D.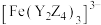 中 中 配位数为6 配位数为6 |
您最近一年使用:0次
10 . 翡翠的主要成分为NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅,是决定翡翠品质的重要因素之一
(1)基态Cr3+最外电子层的电子排布图(轨道表示式)为_______ 。
(2)NaAlSi2O6所含元素中,第一电离能最小的是_______ ,原因是_______
(3)配合物K[Cr(C2O4)2(H2O)]中的配体是_______ ,H2O的沸点比CO2的高了许多,主要原因是_______ 。
(4)已知某FeSO4·xH2O的结构如图所示。

粒子内部的键角SO
_______ H2O(填“>”“<”或“=”),从杂化类型及斥力大小角度说明判断的理由:_______ 。
(5)Ca、O、Cr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中Ca2+、O2-采用面心立方最密堆积方式。
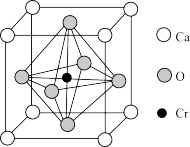
①该晶体的化学式为_______ 。
②已知钙离子、氧离子半径分别为100pm、140pm,晶胞中Cr4+位于O2-所形成的正八面体的体心,该正八面体的边长为_______ pm。
(1)基态Cr3+最外电子层的电子排布图(轨道表示式)为
(2)NaAlSi2O6所含元素中,第一电离能最小的是
(3)配合物K[Cr(C2O4)2(H2O)]中的配体是
(4)已知某FeSO4·xH2O的结构如图所示。

粒子内部的键角SO
(5)Ca、O、Cr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中Ca2+、O2-采用面心立方最密堆积方式。

①该晶体的化学式为
②已知钙离子、氧离子半径分别为100pm、140pm,晶胞中Cr4+位于O2-所形成的正八面体的体心,该正八面体的边长为
您最近一年使用:0次