名校
解题方法
1 . 根据科学人员探测,在海洋深处的沉积物中含有可燃冰,主要成分是甲烷水合物。有关其组成的两种分子的下列说法正确的是
| A.它们之间以氢键结合在一起 | B.它们的中心原子杂化轨道类型相同 |
| C.它们都是极性键构成的极性分子 | D.它们的空间结构相同 |
您最近一年使用:0次
名校
解题方法
2 . 物质结构决定物质性质。下列性质差异与结构因素匹配错误的是
| 选项 | 性质差异 | 结构因素 |
| A | 酸性:三氟乙酸>三氯乙酸 | 电负性差异 |
| B | 熔点:SiO2>干冰 | 晶体类型差异 |
| C | 溶解性:I2在CCl4中的溶解度大于在水中的溶解度 | 相似相溶 |
| D | 稳定性:H2O的分解温度(3000℃)远大于H2S(900℃) | 有无氢键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-27更新
|
196次组卷
|
2卷引用:宁夏回族自治区银川一中2023-2024学年高二下学期期中考试化学试题
名校
解题方法
3 . 现有五种元素A、B、C、D、E,其中A、B、C为三个不同周期的短周期元素,E为第四周期元素。请根据下列相关信息,回答下列问题:
(1)C基态原子中能量最高的电子,其电子云在空间有___________ 个伸展方向,C简单离子核外有___________ 种运动状态不同的电子。
(2)A2B2难溶于CS2,简要说明理由:______________ 。
(3)ED3分子的VSEPR模型名称为____________ ,空间构型为____________ 。
(4)下列气态分子BCl3、CCl4、H2O和BeCl2中,其键角由大到小的顺序为_____________ 。
(5)键的极性对物质的化学性质有重要影响。已知一些常见电子基团的吸电子效应的强度:RCO﹣>﹣F>﹣Cl>﹣Br>﹣I>﹣C≡CH>﹣C6H5>﹣H,则下列物质酸性由强到弱的顺序是___________ (填序号)。
A.CH3COOH B.ClCH2COOH C.HC≡CCH2COOH D.C6H5CH2COOH
元素 | 相关信息 |
A | 核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B | 原子核外p电子数与s电子数相等 |
C | 基态原子的价电子排布为nsn-1npn+1 |
D | 能层数与C相同,且电负性比C大 |
E | 元素的主族序数与周期数的差为1,且第一电离能比同周期相邻两种元素都大 |
(2)A2B2难溶于CS2,简要说明理由:
(3)ED3分子的VSEPR模型名称为
(4)下列气态分子BCl3、CCl4、H2O和BeCl2中,其键角由大到小的顺序为
(5)键的极性对物质的化学性质有重要影响。已知一些常见电子基团的吸电子效应的强度:RCO﹣>﹣F>﹣Cl>﹣Br>﹣I>﹣C≡CH>﹣C6H5>﹣H,则下列物质酸性由强到弱的顺序是
A.CH3COOH B.ClCH2COOH C.HC≡CCH2COOH D.C6H5CH2COOH
您最近一年使用:0次
名校
4 . 现有下列几种常见物质:①CH3Cl、②O3、③P4、④C60、⑤CO2、⑥HCN、⑦H2O、⑧NH3、⑨BF3、⑩CH4。
(1)这几种物质中,含非极性共价键形成的是______________ (填序号,下同);属于非极性分子的是_______________ 。
(2)属于极性键形成的非极性分子是_______________ ;
(3)将 溶于水,破坏
溶于水,破坏 中的
中的_______________ 键,写出其电离方程式_______________ 。
(4)已知铁的电离能数据如下:
则,铁的第四电离能( )大于第三电离能(
)大于第三电离能( )的可能原因是:
)的可能原因是:_______________ 。
(1)这几种物质中,含非极性共价键形成的是
(2)属于极性键形成的非极性分子是
(3)将
 溶于水,破坏
溶于水,破坏 中的
中的(4)已知铁的电离能数据如下:
电离能/( |
|
|
|
| …… |
Fe | 759 | 1561 | 2597 | 5290 | …… |
 )大于第三电离能(
)大于第三电离能( )的可能原因是:
)的可能原因是:
您最近一年使用:0次
名校
5 . 下列说法正确的是

A. 是由极性键构成的非极性分子 是由极性键构成的非极性分子 |
B.分子中的中心原子若通过 杂化轨道成键,则该分子一定为正四面体结构 杂化轨道成键,则该分子一定为正四面体结构 |
| C.如图可以确定某物质的相对分子量为46 |
D.可燃冰(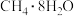 )中甲烷分子和水分子间形成了氢键 )中甲烷分子和水分子间形成了氢键 |
您最近一年使用:0次
名校
解题方法
6 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
(1)表中元素,电负性最强的是___________ (填元素符号);J的元素名称为___________ ;N基态原子价电子层上有___________ 个未成对电子。
(2)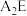 的稳定性比
的稳定性比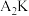
___________ (填写“大”或“小”):原因是___________ 。
(3)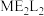 常温下为深红色液体,能与
常温下为深红色液体,能与 、
、 等互溶,据此可判断
等互溶,据此可判断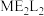 是
是___________ (填“极性”或“非极性”)分子。
(4)① ②
② ③
③ ④
④ ,这四种物质中碳原子采取
,这四种物质中碳原子采取 杂化的是
杂化的是___________ (填序号);乳酸分子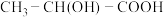 中有
中有___________ 个手性碳原子。
(5)J、K、L元素的电负性由大到小的顺序为___________ (用元素符号表示); 的键角比
的键角比
___________ (填写“大”或“小”):原因是___________ 。

(1)表中元素,电负性最强的是
(2)
 的稳定性比
的稳定性比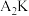
(3)
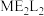 常温下为深红色液体,能与
常温下为深红色液体,能与 、
、 等互溶,据此可判断
等互溶,据此可判断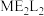 是
是(4)①
 ②
② ③
③ ④
④ ,这四种物质中碳原子采取
,这四种物质中碳原子采取 杂化的是
杂化的是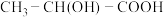 中有
中有(5)J、K、L元素的电负性由大到小的顺序为
 的键角比
的键角比
您最近一年使用:0次
名校
7 . 下列事实与元素的电负性无关的是
A. 分子中 分子中 元素显-1价, 元素显-1价, 元素显+1价 元素显+1价 | B. 分子中的键角小于 分子中的键角小于 分子中的键角 分子中的键角 |
C. 是极性分子,可溶于水 是极性分子,可溶于水 | D. 易形成分子间氢键 易形成分子间氢键 |
您最近一年使用:0次
名校
8 . 回答下列问题:
(1)下列分子中若有手性原子,请用“*”标出其手性碳原子。___________ ___________ H2SO3;HClO3___________ HClO4;
(3)根据价层电子对互斥理论判断下列问题:H2S分子的VSEPR构型为___________ ,立体构型为___________ 。
(4)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于___________ ;H2O比H2S更稳定,这是由于___________ 。
(5)下面是我们熟悉的物质:①O2 ②CH4 ③NaBr ④CO2 ⑤C2H4 ⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2 ⑩NaOH
①这些物质中,只含共价键的是___________ ;既含共价键又含离子键的是___________ ;不存在化学键的是___________ 。(填序号)
②只含极性键的非极性分子的是___________ 。
③将NaHSO4溶于水,破坏NaHSO4中的___________ 键,写出其电离方程式___________ 。
(1)下列分子中若有手性原子,请用“*”标出其手性碳原子。

(3)根据价层电子对互斥理论判断下列问题:H2S分子的VSEPR构型为
(4)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于
(5)下面是我们熟悉的物质:①O2 ②CH4 ③NaBr ④CO2 ⑤C2H4 ⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2 ⑩NaOH
①这些物质中,只含共价键的是
②只含极性键的非极性分子的是
③将NaHSO4溶于水,破坏NaHSO4中的
您最近一年使用:0次
名校
9 . 下列说法正确的是
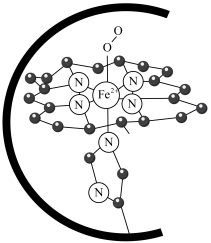
| A.血红蛋白的结构如图所示,Fe2+的配位数为4 |
B.气态SeO3分子的键角小于SeO 离子的键角 离子的键角 |
| C.AlF3的沸点(1040℃)高于AlCl3(178℃)的沸点,主要与晶体类型有关 |
| D.NH3在水中的溶解度小于苯在水中的溶解度 |
您最近一年使用:0次
2024-04-11更新
|
149次组卷
|
2卷引用:宁夏六盘山高级中学2023-2024学年高二下学期第一次月考化学试题
10 . 如图是元素周期表的一部分,根据元素在周期表中的位置,回答下列问题:

(1)⑩号元素最高能级的电子占据的原子轨道电子云轮廓为______ 形。
(2)第二周期所有元素中第一电离能介于①②之间的有______ 种。由②③④形成的简单离子半径由小到大顺序是______ (填化学用语)。
(3)元素⑥⑧可形成共价化合物,分子中各原子最外层均达到8电子的稳定结构,该分子为______ (填“极性分子”或“非极性分子”),晶体类型为______ 。
(4)下列有关性质的比较正确且能用元素周期律解释的是______ (填标号)。

(1)⑩号元素最高能级的电子占据的原子轨道电子云轮廓为
(2)第二周期所有元素中第一电离能介于①②之间的有
(3)元素⑥⑧可形成共价化合物,分子中各原子最外层均达到8电子的稳定结构,该分子为
(4)下列有关性质的比较正确且能用元素周期律解释的是
| A.电负性:②>③ |
| B.氢化物的稳定性:③>⑦ |
| C.最高价氧化物对应的水化物的碱性:④>⑤ |
| D.氢化物的沸点:③>⑦ |
您最近一年使用:0次

 )
)



