名校
解题方法
1 . 下列说法不正确 的是
A.相同条件下的酸性:邻苯二甲酸 对苯二甲酸 对苯二甲酸 |
B.键角: |
C. 和甲醚 和甲醚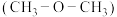 都是直线型非极性分子 都是直线型非极性分子 |
D.由三种元素构成的化合物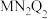 可能是极性分子,也可能是非极性分子 可能是极性分子,也可能是非极性分子 |
您最近一年使用:0次
名校
2 . 某物质的结构如图所示。短周期元素X、Y、Z、W、M、Q的原子序数依次增大,已知X和W同周期,W和Q同主族。下列说法错误的是
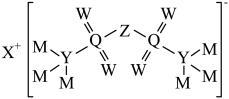
| A.电负性:M>W>Z>Y |
| B.Y、Z、W的简单氢化物的键角依次减小 |
| C.常温下,M的单质可以在水溶液中置换出W的单质 |
| D.W的单质一定为非极性分子 |
您最近一年使用:0次
名校
3 . 锰酸锂离子电池是第二代锂离子动力电池,性能优良。工业上以软锰矿浆(主要成分为 ,还有少量铁、铝、及硅的氧化物)为原料制备锰酸锂
,还有少量铁、铝、及硅的氧化物)为原料制备锰酸锂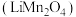 ,工业流程如下图所示:
,工业流程如下图所示:
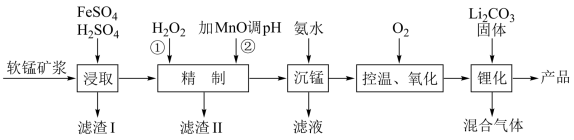
(1)基态 原子的价电子排布式为
原子的价电子排布式为______ 。
(2)“精制”过程中,实际加入 的量比理论用量多,主要原因是
的量比理论用量多,主要原因是______ ; 是含有
是含有______ 键(填“极性”或“非极性”,下同)和______ 键的______ 分子: 能与水混溶,却不能溶于
能与水混溶,却不能溶于 ,请予以解释
,请予以解释______ 。
(3)“沉锰”过程得到的是 和
和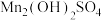 ,二者均可以被氧化为
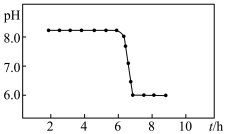
,二者均可以被氧化为 ,若“控温、氧化”过程中溶液的
,若“控温、氧化”过程中溶液的 随时间变化关系如下图所示,其中溶液的
随时间变化关系如下图所示,其中溶液的 明显下降的原因是
明显下降的原因是______ (用化学方程式表示)。
(4)“锂化”过程是将 和
和 按
按 的物质的量之比配料,反应3-5小时,然后升温至600-750℃,保温24小时,自然冷却至室温得到产品。该过程所得混合气体的成分是
的物质的量之比配料,反应3-5小时,然后升温至600-750℃,保温24小时,自然冷却至室温得到产品。该过程所得混合气体的成分是______ 。
 ,还有少量铁、铝、及硅的氧化物)为原料制备锰酸锂
,还有少量铁、铝、及硅的氧化物)为原料制备锰酸锂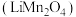 ,工业流程如下图所示:
,工业流程如下图所示:
(1)基态
 原子的价电子排布式为
原子的价电子排布式为(2)“精制”过程中,实际加入
 的量比理论用量多,主要原因是
的量比理论用量多,主要原因是 是含有
是含有 能与水混溶,却不能溶于
能与水混溶,却不能溶于 ,请予以解释
,请予以解释(3)“沉锰”过程得到的是
 和
和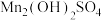 ,二者均可以被氧化为
,二者均可以被氧化为 ,若“控温、氧化”过程中溶液的
,若“控温、氧化”过程中溶液的 随时间变化关系如下图所示,其中溶液的
随时间变化关系如下图所示,其中溶液的 明显下降的原因是
明显下降的原因是
(4)“锂化”过程是将
 和
和 按
按 的物质的量之比配料,反应3-5小时,然后升温至600-750℃,保温24小时,自然冷却至室温得到产品。该过程所得混合气体的成分是
的物质的量之比配料,反应3-5小时,然后升温至600-750℃,保温24小时,自然冷却至室温得到产品。该过程所得混合气体的成分是
您最近一年使用:0次
解题方法
4 . W、X、Y、Z、R为原子序数依次增大的短周期主族元素,W的核外电子只有一种自旋方向;Y、Z、R在元素周期表中相邻,X的核外电子数与Y的价层电子数相等,R2是氧化性最强的单质,回答下列问题:
(1)由X原子核形成的三种微粒,电子排布式分别为:①1s22s2、②1s22s22p1、③1s22s12p2,有关这些微粒的叙述正确的是___________ (填标号)。
a.得电子能力:②>① b.表示基态原子(或离子)的是:①②
c.微粒半径:①>② d.电离一个电子所需最低能量:①>②>③
(2)YR3是一种重要的电子工业材料。分子的极性:YR3___________ XR3(填“>”或“<”或“=”);YR3与YW3结构相似,YW3易与过渡金属阳离子形成配离子而YR3不能,原因是___________ 。
(3)同周期元素中,第一电离能比Z大的元素有_________ 种;Z与Y形成的固态Y2Z5由YZ 和YZ
和YZ 两种离子组成,固态Y2Z5中Y原子的杂化方式为
两种离子组成,固态Y2Z5中Y原子的杂化方式为_________ ,YZ 的电子式为
的电子式为_________ 。
(4)X与Z可形成多种结构形式的阴离子,已知阴离子X3Z 结构中只有一个正六元环,则n=
结构中只有一个正六元环,则n=___________ ,该阴离子的结构式为___________ 。
(1)由X原子核形成的三种微粒,电子排布式分别为:①1s22s2、②1s22s22p1、③1s22s12p2,有关这些微粒的叙述正确的是
a.得电子能力:②>① b.表示基态原子(或离子)的是:①②
c.微粒半径:①>② d.电离一个电子所需最低能量:①>②>③
(2)YR3是一种重要的电子工业材料。分子的极性:YR3
(3)同周期元素中,第一电离能比Z大的元素有
 和YZ
和YZ 两种离子组成,固态Y2Z5中Y原子的杂化方式为
两种离子组成,固态Y2Z5中Y原子的杂化方式为 的电子式为
的电子式为(4)X与Z可形成多种结构形式的阴离子,已知阴离子X3Z
 结构中只有一个正六元环,则n=
结构中只有一个正六元环,则n=
您最近一年使用:0次
名校
解题方法
5 . 卤素在高分子材料及电子电气等领域都有广泛应用。
(1)卤族元素位于元素周期表的___________ 区,基态溴原子的价层电子排布式为___________ 。
(2)比较键角大小:NH3___________ NF3(填“>”“<”或“=”)。
(3)已知下列5种羧酸:①CF3COOH②CH3COOH③CH2FCOOH④CH2ClCOOH⑤CH3CH2COOH,其酸性由强到弱的顺序为①___________ (填序号)。
(4)已知:由于 中甲基的推电子诱导效应,π电子离1号碳更近,H+倾向于与电子密度更高的1号碳结合,丙烯与HCl加成的主产物为CH3CHClCH3.,CF3CH=CH2与HCl加成反应主产物的结构简式为
中甲基的推电子诱导效应,π电子离1号碳更近,H+倾向于与电子密度更高的1号碳结合,丙烯与HCl加成的主产物为CH3CHClCH3.,CF3CH=CH2与HCl加成反应主产物的结构简式为___________ 。
(5)图1为气态氯化铍,图2为固态氯化铍。
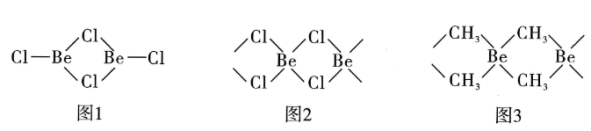
①气态氯化铍为___________ (填“极性”或“非极性”)分子。氯化铍由气态转化为固态,Be的杂化方式由___________ 转化为___________ 。
②若将固态氯化铍中的Cl原子替换为甲基,可形成如图3化合物。1个甲基与2个Be原子形成共价键时所提供的电子数为___________ 。
(1)卤族元素位于元素周期表的
(2)比较键角大小:NH3
(3)已知下列5种羧酸:①CF3COOH②CH3COOH③CH2FCOOH④CH2ClCOOH⑤CH3CH2COOH,其酸性由强到弱的顺序为①
(4)已知:由于
 中甲基的推电子诱导效应,π电子离1号碳更近,H+倾向于与电子密度更高的1号碳结合,丙烯与HCl加成的主产物为CH3CHClCH3.,CF3CH=CH2与HCl加成反应主产物的结构简式为
中甲基的推电子诱导效应,π电子离1号碳更近,H+倾向于与电子密度更高的1号碳结合,丙烯与HCl加成的主产物为CH3CHClCH3.,CF3CH=CH2与HCl加成反应主产物的结构简式为(5)图1为气态氯化铍,图2为固态氯化铍。

①气态氯化铍为
②若将固态氯化铍中的Cl原子替换为甲基,可形成如图3化合物。1个甲基与2个Be原子形成共价键时所提供的电子数为
您最近一年使用:0次
名校
6 . 二氯化二硫 是一种广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构与
是一种广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构与 类似,熔点为
类似,熔点为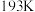 ,沸点为
,沸点为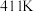 ,遇水很容易水解,产生的气体能使品红溶液褪色。
,遇水很容易水解,产生的气体能使品红溶液褪色。 可由干燥的氯气通入熔融的硫中制得。下列有关说法中正确的是
可由干燥的氯气通入熔融的硫中制得。下列有关说法中正确的是
 是一种广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构与
是一种广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构与 类似,熔点为
类似,熔点为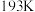 ,沸点为
,沸点为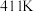 ,遇水很容易水解,产生的气体能使品红溶液褪色。
,遇水很容易水解,产生的气体能使品红溶液褪色。 可由干燥的氯气通入熔融的硫中制得。下列有关说法中正确的是
可由干燥的氯气通入熔融的硫中制得。下列有关说法中正确的是A. 是非极性分子 是非极性分子 |
B. 分子中所有原子在同一平面上 分子中所有原子在同一平面上 |
C. 与 与 反应的化学方程式可能为: 反应的化学方程式可能为: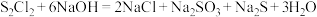 |
D. 中硫原子轨道杂化类型为 中硫原子轨道杂化类型为 杂化 杂化 |
您最近一年使用:0次
2024-02-03更新
|
359次组卷
|
4卷引用:湖南省邵阳市新邵县2023-2024学年高二上学期期末考试化学试题
名校
7 . 烟气脱硫可有效减少 引起的大气污染,同时还可得到有用产品。传统湿法脱硫多以碱性物质作吸收剂,新型脱硫方法选用离子液体(指在室温或接近室温时呈液态的盐类物质,由阴、阳离子组成)作吸收剂,通过物理和化学吸收实现脱硫。已知
引起的大气污染,同时还可得到有用产品。传统湿法脱硫多以碱性物质作吸收剂,新型脱硫方法选用离子液体(指在室温或接近室温时呈液态的盐类物质,由阴、阳离子组成)作吸收剂,通过物理和化学吸收实现脱硫。已知 时,几种酸的电离常数:
时,几种酸的电离常数:
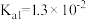 ,
,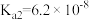 ;
;
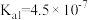 ,
,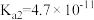 ;
;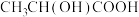 (乳酸)
(乳酸)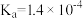 。研究发现:乳酸和乙醇胺(
。研究发现:乳酸和乙醇胺( )作用得到的离子液体——乙醇胺乳酸盐(
)作用得到的离子液体——乙醇胺乳酸盐(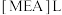 ),既可脱硫,也可吸收CO2。下列说法错误的是
),既可脱硫,也可吸收CO2。下列说法错误的是
 引起的大气污染,同时还可得到有用产品。传统湿法脱硫多以碱性物质作吸收剂,新型脱硫方法选用离子液体(指在室温或接近室温时呈液态的盐类物质,由阴、阳离子组成)作吸收剂,通过物理和化学吸收实现脱硫。已知
引起的大气污染,同时还可得到有用产品。传统湿法脱硫多以碱性物质作吸收剂,新型脱硫方法选用离子液体(指在室温或接近室温时呈液态的盐类物质,由阴、阳离子组成)作吸收剂,通过物理和化学吸收实现脱硫。已知 时,几种酸的电离常数:
时,几种酸的电离常数:
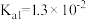 ,
,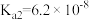 ;
;
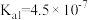 ,
,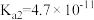 ;
;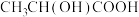 (乳酸)
(乳酸)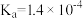 。研究发现:乳酸和乙醇胺(
。研究发现:乳酸和乙醇胺( )作用得到的离子液体——乙醇胺乳酸盐(
)作用得到的离子液体——乙醇胺乳酸盐(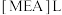 ),既可脱硫,也可吸收CO2。下列说法错误的是
),既可脱硫,也可吸收CO2。下列说法错误的是A.液态时的导电性: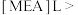 乳酸 乳酸 |
B.乳酸和乙醇胺中均含有 键、 键、 键和氢键 键和氢键 |
C. 是直线形非极性分子, 是直线形非极性分子, 是 是 形极性分子 形极性分子 |
D.相同条件下,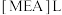 能吸收气体的体积: 能吸收气体的体积: |
您最近一年使用:0次
2024-01-22更新
|
1122次组卷
|
7卷引用:2024年1月安徽普通高等学校招生考试适应性测试化学试题
2024年1月安徽普通高等学校招生考试适应性测试化学试题(已下线)选择题6-10(已下线)2024年1月“九省联考”安徽真题完全解读与考后提升辽宁省沈阳市东北育才学校高中部2023-2024学年高三下学期第六次模拟考试化学试题(已下线)专题04 物质结构与性质-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)山西省大同市第一中学校2023-2024学年高二下学期3月月考化学试题安徽师范大学附属中学2023-2024学年高二下学期4月测试化学试题
名校
解题方法
8 . 下列有关物质结构和性质的说法错误的是
| A.含有手性碳原子的分子叫做手性分子 |
B. 和 和 均为非极性分子 均为非极性分子 |
| C.邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点 |
| D.单质硅和金刚石中的键能:Si-Si<C-C |
您最近一年使用:0次
名校
解题方法
9 . 一种回收锌电解阳极泥(主要成分为 、
、 和ZnO,还有少量锰铅氧化物
和ZnO,还有少量锰铅氧化物 和Ag)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题:
和Ag)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题:
已知:① 易溶于水,不溶于乙醇;
易溶于水,不溶于乙醇;
②在较高温度及酸性催化条件下,葡萄糖能发生如下反应:

(1)基态Mn原子核外电子的空间运动状态有___________ 种。
(2)“还原酸浸”过程中二氧化锰参与反应的化学方程式为___________ 。
(3)结合 溶解度曲线图分析,由
溶解度曲线图分析,由 溶液制得
溶液制得 晶体的“一系列操作”是
晶体的“一系列操作”是___________ 、___________ ,用___________ (填物质的名称)洗涤、干燥。

(4)实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,其原因是___________ 。
(5)“电解”时,加入 与水反应生成二元弱酸
与水反应生成二元弱酸 ,在阴极放电生成Se单质,有利于
,在阴极放电生成Se单质,有利于 电还原沉积,则
电还原沉积,则 放电的电极反应式为
放电的电极反应式为___________ 。
(6)关于流程中有关物质的说法正确的是___________(填标号)。
 、
、 和ZnO,还有少量锰铅氧化物
和ZnO,还有少量锰铅氧化物 和Ag)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题:
和Ag)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题:
已知:①
 易溶于水,不溶于乙醇;
易溶于水,不溶于乙醇;②在较高温度及酸性催化条件下,葡萄糖能发生如下反应:

(1)基态Mn原子核外电子的空间运动状态有
(2)“还原酸浸”过程中二氧化锰参与反应的化学方程式为
(3)结合
 溶解度曲线图分析,由
溶解度曲线图分析,由 溶液制得
溶液制得 晶体的“一系列操作”是
晶体的“一系列操作”是
(4)实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,其原因是
(5)“电解”时,加入
 与水反应生成二元弱酸
与水反应生成二元弱酸 ,在阴极放电生成Se单质,有利于
,在阴极放电生成Se单质,有利于 电还原沉积,则
电还原沉积,则 放电的电极反应式为
放电的电极反应式为(6)关于流程中有关物质的说法正确的是___________(填标号)。
| A.葡萄糖溶于水,葡萄糖分子能与水分子形成氢键 |
B.Ag和Cu是同族元素且相邻,基态Ag原子的价电子轨道表示式为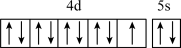 |
C. 与 与 均属于分子晶体, 均属于分子晶体, 为非极性分子,其空间结构为直线形 为非极性分子,其空间结构为直线形 |
| D.流程中的“滤液2”可循环利用 |
您最近一年使用:0次
10 . 苯乙烯是生产塑料和合成橡胶的重要有机原料,可由乙苯催化脱氢获得。
(1)科技工作者结合实验与计算机模拟结果,研究了一个乙苯分子在催化剂表面脱氢制苯乙烯的反应,其历程如图1所示(吸附在催化剂表面的物质用*标注):
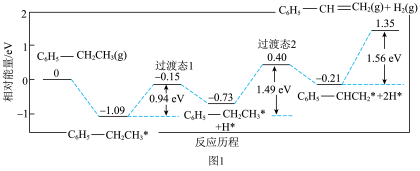
乙苯脱氢制苯乙烯反应的焓变
___________ (填“>”“<”或“=”)0,为提高乙苯的平衡转化率,应选择的反应条件为___________ (填标号)。
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
(2)有研究者发现,在 气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图2:
气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图2:
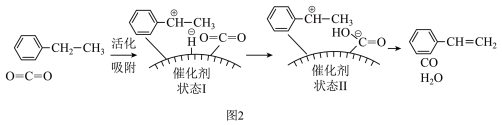
①该过程的总反应的化学方程式为___________ 。
② 属于
属于___________ (填“极性”或“非极性”)分子;干冰中每个 分子周围有
分子周围有___________ 个紧邻分子。
③从资源综合利用角度分析, 氧化乙苯脱氢制苯乙烯的优点是
氧化乙苯脱氢制苯乙烯的优点是___________ 。
(3)100kPa恒压下,将2mol乙苯蒸气通入体积可变的密闭容器中发生乙苯脱氢制苯乙烯反应。
① ℃时,反应经过10min达到平衡,此时苯乙烯的体积分数为0.375,则乙苯的转化率为
℃时,反应经过10min达到平衡,此时苯乙烯的体积分数为0.375,则乙苯的转化率为________ ,0~10min内的平均反应速率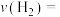
_______  ,该温度下的
,该温度下的
_______ kPa。
② ℃时,若再向体系中通入氮气,此时
℃时,若再向体系中通入氮气,此时
___________ (填“增大”“减小”或“不变”)。
(1)科技工作者结合实验与计算机模拟结果,研究了一个乙苯分子在催化剂表面脱氢制苯乙烯的反应,其历程如图1所示(吸附在催化剂表面的物质用*标注):

乙苯脱氢制苯乙烯反应的焓变

A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
(2)有研究者发现,在
 气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图2:
气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图2:
①该过程的总反应的化学方程式为
②
 属于
属于 分子周围有
分子周围有③从资源综合利用角度分析,
 氧化乙苯脱氢制苯乙烯的优点是
氧化乙苯脱氢制苯乙烯的优点是(3)100kPa恒压下,将2mol乙苯蒸气通入体积可变的密闭容器中发生乙苯脱氢制苯乙烯反应。
①
 ℃时,反应经过10min达到平衡,此时苯乙烯的体积分数为0.375,则乙苯的转化率为
℃时,反应经过10min达到平衡,此时苯乙烯的体积分数为0.375,则乙苯的转化率为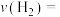
 ,该温度下的
,该温度下的
②
 ℃时,若再向体系中通入氮气,此时
℃时,若再向体系中通入氮气,此时
您最近一年使用:0次



