解题方法
1 . AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如下:
(1)基态硫原子中,核外电子占据最高能层的符号是______ ,硫元素在周期表中位于_____ 区。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态硒原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态硒原子,其价电子自旋磁量子数的代数和为_______ 。
(3)物质Ⅰ为______ (填“极性”或“非极性”)分子。物质Ⅰ、Ⅱ、Ⅲ在水中溶解度较大的是_____ (填序号),原因是___________ 。
(4)每个物质Ⅲ分子中采取 杂化的原子有
杂化的原子有___ 个。
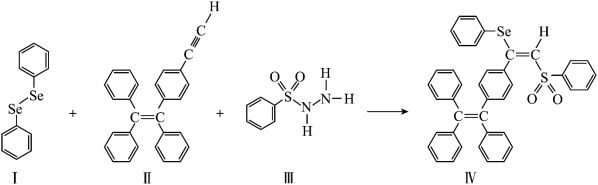
(1)基态硫原子中,核外电子占据最高能层的符号是
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态硒原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态硒原子,其价电子自旋磁量子数的代数和为(3)物质Ⅰ为
(4)每个物质Ⅲ分子中采取
 杂化的原子有
杂化的原子有
您最近一年使用:0次
2 . 研究发现,在 低压合成甲醇反应(
低压合成甲醇反应(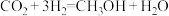 )中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)基态氧原子最高能级的原子轨道形状为___________ 。Mn与O中,电负性较大的是___________ 。
(2) 和
和 分子中C原子的杂化方式分别为
分子中C原子的杂化方式分别为___________ 和___________ 。
(3) 在水中的溶解度很大的原因是
在水中的溶解度很大的原因是___________ 。
(4)比较 和
和 沸点高低:
沸点高低:___________ ,原因是___________ 。
 低压合成甲醇反应(
低压合成甲醇反应(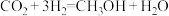 )中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:(1)基态氧原子最高能级的原子轨道形状为
(2)
 和
和 分子中C原子的杂化方式分别为
分子中C原子的杂化方式分别为(3)
 在水中的溶解度很大的原因是
在水中的溶解度很大的原因是(4)比较
 和
和 沸点高低:
沸点高低:
您最近一年使用:0次
名校
解题方法
3 . 在2022年冬奥会上滑冰运动场馆中使用了美丽的透光气囊材料,该材料由乙烯( )与四氟乙烯(
)与四氟乙烯( )的共聚物(
)的共聚物( )制成,同时采用了最新的环保技术——“二氧化碳跨临界直冷制冰”。回答下列问题:
)制成,同时采用了最新的环保技术——“二氧化碳跨临界直冷制冰”。回答下列问题:
(1)三氟乙酸( )的酸性
)的酸性___________ (填“强”或“弱”)于乙酸,原因是___________ 。
(2)利用该技术将 制成冰的过程中发生改变的是___________(填字母)。
制成冰的过程中发生改变的是___________(填字母)。
(3)适当条件下, 可以转化为
可以转化为 :
: ,
, 的相对分子质量比
的相对分子质量比 的大,但
的大,但 的沸点比水的低,主要原因是
的沸点比水的低,主要原因是___________ ,下列有关 与
与 的说法正确的是
的说法正确的是___________ (填字母)。
A.均含有 键 B.键角:
键 B.键角: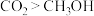 C.均是极性分子
C.均是极性分子
 )与四氟乙烯(
)与四氟乙烯( )的共聚物(
)的共聚物(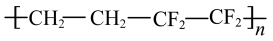 )制成,同时采用了最新的环保技术——“二氧化碳跨临界直冷制冰”。回答下列问题:
)制成,同时采用了最新的环保技术——“二氧化碳跨临界直冷制冰”。回答下列问题:(1)三氟乙酸(
 )的酸性
)的酸性(2)利用该技术将
 制成冰的过程中发生改变的是___________(填字母)。
制成冰的过程中发生改变的是___________(填字母)。| A.共价键数目 | B.范德华力大小 | C.氢键数目 | D.分子种类 |
 可以转化为
可以转化为 :
: ,
, 的相对分子质量比
的相对分子质量比 的大,但
的大,但 的沸点比水的低,主要原因是
的沸点比水的低,主要原因是 与
与 的说法正确的是
的说法正确的是A.均含有
 键 B.键角:
键 B.键角: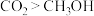 C.均是极性分子
C.均是极性分子
您最近一年使用:0次
名校
4 . 近年来我国科学家发现了一系列意义重大的铁系、铜系超导材料,其中一类为Fe-Sm-As-F-O组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为______ ,杂化类型为______ ,其沸点比 的
的______ (填“高”或“低”),其判断理由是____________ 。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成,第一电离能:
______ (填“大于”或“小于”) ,原因是
,原因是____________ 。
(3)研究发现,阳离子的颜色与未成对电子数有关。例如: 、
、 、
、 等。
等。 呈无色,其原因是
呈无色,其原因是____ 。
(1)元素As与N同族。预测As的氢化物分子的立体结构为
 的
的(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成,第一电离能:

 ,原因是
,原因是(3)研究发现,阳离子的颜色与未成对电子数有关。例如:
 、
、 、
、 等。
等。 呈无色,其原因是
呈无色,其原因是
您最近一年使用:0次
2023-04-03更新
|
125次组卷
|
2卷引用:山西省晋中市平遥县第二中学校2022-2023学年高二下学期3月月考化学试题
名校
解题方法
5 . 完成下列问题
(1)基态硫原子核外电子的空间运动状态有___________ 种;其核外电子运动最高能级的电子云轮廓图的形状为___________ 。
(2)基态砷原子的价层电子的轨道表示式为___________ 。
(3)元素Mg的第一电离能大于Al的第一电离能的原因是___________ 。
(4)硫化氢和水分子结构相似,硫化氢晶体中,一个硫化氢分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,原因为:___________ 。
(5) 是离子晶体,其晶格能可通过图(a)的Born−Haber循环计算得到。
是离子晶体,其晶格能可通过图(a)的Born−Haber循环计算得到。

可知,Li原子的第一电离能为___________  ,
, 键键能为
键键能为___________ 
(6) 、
、 、
、 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为___________ ,键角由大到小的顺序为___________ ,已知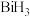 的沸点高于
的沸点高于 ,其原因是
,其原因是___________ 。
(1)基态硫原子核外电子的空间运动状态有
(2)基态砷原子的价层电子的轨道表示式为
(3)元素Mg的第一电离能大于Al的第一电离能的原因是
(4)硫化氢和水分子结构相似,硫化氢晶体中,一个硫化氢分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,原因为:
(5)
 是离子晶体,其晶格能可通过图(a)的Born−Haber循环计算得到。
是离子晶体,其晶格能可通过图(a)的Born−Haber循环计算得到。
可知,Li原子的第一电离能为
 ,
, 键键能为
键键能为
(6)
 、
、 、
、 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为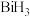 的沸点高于
的沸点高于 ,其原因是
,其原因是
您最近一年使用:0次
2023-03-30更新
|
254次组卷
|
3卷引用:山西省太原师范附属中学、太原市师苑中学校2022-2023学年高二下学期第一次月考化学(理)试题
名校
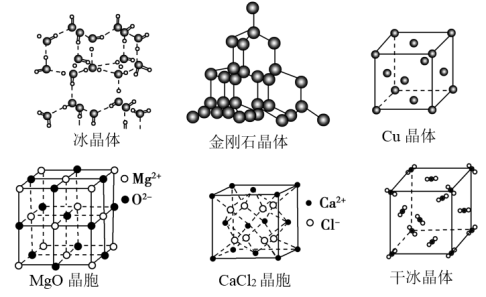
6 . Ⅰ.下图为几种晶体或晶胞的示意图,请回答下列问题:___________ 。
(2)冰、金刚石、MgO、干冰4种晶体的熔点由高到低的顺序为___________ 。
(3)MgO晶胞中,每个MgO晶胞中平均占有___________ 个 ,由与
,由与 最近的
最近的 围成的空间几何构型为
围成的空间几何构型为___________ 。
(4)铜晶体中一个Cu周围紧邻的Cu有___________ 个, 晶体中
晶体中 的配位数是
的配位数是___________ 。
(5)冰的熔点远高于干冰,除 是
是___________ 分子外(填“极性”或“非极性”),还有一个重要的原因是___________ 。
Ⅱ.以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
___________ 个Sn,找出距离Cd(0,0,0)最近的Sn___________ (用分数坐标表示)。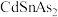 晶体中与单个Sn键合的As有
晶体中与单个Sn键合的As有___________ 个。
(2)冰、金刚石、MgO、干冰4种晶体的熔点由高到低的顺序为
(3)MgO晶胞中,每个MgO晶胞中平均占有
 ,由与
,由与 最近的
最近的 围成的空间几何构型为
围成的空间几何构型为(4)铜晶体中一个Cu周围紧邻的Cu有
 晶体中
晶体中 的配位数是
的配位数是(5)冰的熔点远高于干冰,除
 是
是Ⅱ.以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
| 坐标原子 | x | y | z |
| Cd | 0 | 0 | 0 |
| Sn | 0 | 0 | 0.5 |
| As | 0.25 | 0.25 | 0.125 |
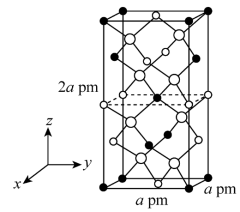
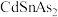 晶体中与单个Sn键合的As有
晶体中与单个Sn键合的As有
您最近一年使用:0次
2023-03-30更新
|
259次组卷
|
2卷引用:山西省太原师范附属中学、太原市师苑中学校2022-2023学年高二下学期第一次月考化学(理)试题
名校
7 . 硝基胍是固体火箭推进剂的重要组分,其结构简式如图所示(“→”是一种特殊的共价单键)。
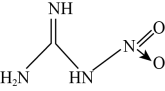
回答下列问题:
(1)硝基胍分子中C、H、O、N四种元素的电负性由小到大的顺序为_______ ,这四种元素_______ (填“能”或“不能”)形成离子化合物。
(2)硝基胍中N原子的杂化方式分别为_______ ,C-H键的极性_______ (填“强”或“弱”)于N-H键的极性。
(3)从结构上分析该物质_______ (填“易”或“不”)溶于水,原因是_______ 。
(4)下图中表示的碳原子能量最高的是_______(填字母)。
(5)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为_______ 。
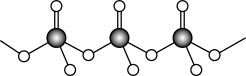

回答下列问题:
(1)硝基胍分子中C、H、O、N四种元素的电负性由小到大的顺序为
(2)硝基胍中N原子的杂化方式分别为
(3)从结构上分析该物质
(4)下图中表示的碳原子能量最高的是_______(填字母)。
A.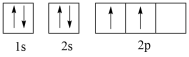 | B.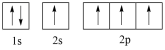 |
C.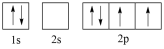 | D.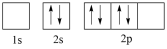 |

您最近一年使用:0次
2023-03-16更新
|
418次组卷
|
2卷引用:山西省介休市第一中学校2022-2023学年高二下学期3月月考化学试题
名校
8 . DF-31洲际弹道导弹是我国大国地位和国防实力的象征,其制作材料包含了Fe、Cr、Ni、C等多种元素。回答下列问题:
(1)基态铁原子的电子排布式为_______ , 具有较强的还原性,原因是
具有较强的还原性,原因是_______ 。
(2)基态Ni原子的核外能量不同的电子有_______ 种。
(3)Cr的第二电离能 和Mn的第二电离能
和Mn的第二电离能 分别为1590.6 kJ·mol
分别为1590.6 kJ·mol 、1509.0 kJ·mol
、1509.0 kJ·mol ,
, 的原因是
的原因是_______ ;过氧化铬 中Cr的化合价为+6,则分子中σ键、π键的数目之比为
中Cr的化合价为+6,则分子中σ键、π键的数目之比为_______ 。
(4)指出下列过程需要破坏的作用力:干冰熔化_______ ;氢氧化钠溶于水_______ ;氯化氢溶于水_______ ;冰的熔化_______ 。
①离子键②极性共价键③非极性共价键④氢键⑤范德华力
(1)基态铁原子的电子排布式为
 具有较强的还原性,原因是
具有较强的还原性,原因是(2)基态Ni原子的核外能量不同的电子有
(3)Cr的第二电离能
 和Mn的第二电离能
和Mn的第二电离能 分别为1590.6 kJ·mol
分别为1590.6 kJ·mol 、1509.0 kJ·mol
、1509.0 kJ·mol ,
, 的原因是
的原因是 中Cr的化合价为+6,则分子中σ键、π键的数目之比为
中Cr的化合价为+6,则分子中σ键、π键的数目之比为(4)指出下列过程需要破坏的作用力:干冰熔化
①离子键②极性共价键③非极性共价键④氢键⑤范德华力
您最近一年使用:0次
2023-03-16更新
|
266次组卷
|
2卷引用:山西省介休市第一中学校2022-2023学年高二下学期3月月考化学试题
名校
9 . 回答下列小题
(1)下列物质的结构或性质与氢键无关的是___________(填标号)。
(2)HCN是直线形分子,HCN是___________ (填“极性”或“非极性”)分子。
(3)金刚石、石墨、 和石墨烯都是碳的同素异形体
和石墨烯都是碳的同素异形体
①石墨晶体存在作用力有___________ ,还有金属键的特性。
② 的熔点比金刚石、石墨熔点低的原因是
的熔点比金刚石、石墨熔点低的原因是___________ 。
③石墨烯即单层石墨。石墨烯中碳原子的杂化轨道类型为___________ ;碳原子和碳碳键的个数比是___________ 。
(1)下列物质的结构或性质与氢键无关的是___________(填标号)。
| A.乙酸的沸点 | B.乙醇在水中的溶解度 |
| C.氢化镁的相对分子质量 | D.DNA的双螺旋结构 |
(3)金刚石、石墨、
 和石墨烯都是碳的同素异形体
和石墨烯都是碳的同素异形体①石墨晶体存在作用力有
②
 的熔点比金刚石、石墨熔点低的原因是
的熔点比金刚石、石墨熔点低的原因是③石墨烯即单层石墨。石墨烯中碳原子的杂化轨道类型为
您最近一年使用:0次
2023-03-12更新
|
300次组卷
|
3卷引用:山西省大同市浑源中学2021-2022学年高二下学期期中考试化学试题
10 . 绿芦笋中含有天门冬氨酸(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。回答下列问题:

(1)天门冬氨酸中C、N、O三种元素的第一电离能由大到小的顺序是____ ,电负性最大的元素的价层电子轨道表示式____ 。铬元素位于周期表第____ 周期____ 族,其基态原子的电子排布式为____ 。
(2)天门冬氨酸中的共价键类型为____ (填“σ键”、“π键”),其中N原子的杂化轨道类型为____ ,图中O—C—C的键角__ C—C—N的键角(填“大于”或“小于”)。
(3)H2S和H2Se热稳定性较好的是____ ,从分子结构角度解释其原因:____ 。
(4)分子结构修饰在药物设计与合成中有广泛的应用。若将天门冬氨酸中的—NH2,换成—NO2,得到的新物质的酸性会增强,原因是____ 。
(5)四个主族元素部分简单氢化物沸点随周期序数的变化如图所示。其中表示第VIA族元素简单氢化物沸点变化的是曲线____ (填字母),用分子间作用力解释该曲线:____ 。O—H…O的键能小于F—H…F,但水的沸点高于HF的原因可能是____ 。

某些氢键的键能和键长

(1)天门冬氨酸中C、N、O三种元素的第一电离能由大到小的顺序是
(2)天门冬氨酸中的共价键类型为
(3)H2S和H2Se热稳定性较好的是
(4)分子结构修饰在药物设计与合成中有广泛的应用。若将天门冬氨酸中的—NH2,换成—NO2,得到的新物质的酸性会增强,原因是
(5)四个主族元素部分简单氢化物沸点随周期序数的变化如图所示。其中表示第VIA族元素简单氢化物沸点变化的是曲线

某些氢键的键能和键长
| 氢键X—H…Y | 键能/(kJ·mol-1) | 键长/pm | 代表性例子 |
| F—H…F | 28.1 | 255 | (HF)n |
| O—H…O | 18.8 | 276 | 冰 |
| O—H…O | 25.9 | 266 | 甲醇,乙醇 |
| N—H…F | 20.9 | 268 | NH4F |
| N—H…O | 20.9 | 286 | CH3CONH2 |
| N—H…N | 5.4 | 338 | NH3 |
您最近一年使用:0次
2022-04-20更新
|
845次组卷
|
2卷引用:山西省太原市2021-2022学年高二下学期期中考试化学试题



