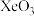名校
解题方法
1 . 元素周期表中第四周期的某些过渡元素(如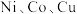 等)在生产、生活中有着广泛的应用.
等)在生产、生活中有着广泛的应用.
(1) 能与水杨醛缩对氯苯胺形成具有发光性的配合物,水杨醛缩对氯苯胺制备反应方程式如下:
能与水杨醛缩对氯苯胺形成具有发光性的配合物,水杨醛缩对氯苯胺制备反应方程式如下: 核外电子排布式
核外电子排布式_________ ;
② 元素的第一电离能由大到小的顺序为
元素的第一电离能由大到小的顺序为__________ . 的晶胞如图1所示,距离每个
的晶胞如图1所示,距离每个 最近的
最近的 的个数为
的个数为_________ .
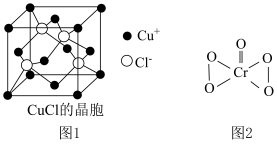
(3)已知: 结构如图2所示,该反应
结构如图2所示,该反应________ (选填“是”或“不是”)氧化还原反应,理由是__________ .
(4)有机净化剂的基本组分为大分子立体网格结构的聚合物,可用于工业废水“除钴镍”.其净化原理可表示为: ”表示出
”表示出 参与的配位键
参与的配位键_________ .
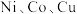 等)在生产、生活中有着广泛的应用.
等)在生产、生活中有着广泛的应用.(1)
 能与水杨醛缩对氯苯胺形成具有发光性的配合物,水杨醛缩对氯苯胺制备反应方程式如下:
能与水杨醛缩对氯苯胺形成具有发光性的配合物,水杨醛缩对氯苯胺制备反应方程式如下:
 核外电子排布式
核外电子排布式②
 元素的第一电离能由大到小的顺序为
元素的第一电离能由大到小的顺序为③对羟基苯甲醛( )的沸点为
)的沸点为 ,而水杨醛(
,而水杨醛(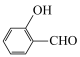 )的沸点为
)的沸点为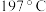 ,请从结构角度解释二者沸点差异原因
,请从结构角度解释二者沸点差异原因
 的晶胞如图1所示,距离每个
的晶胞如图1所示,距离每个 最近的
最近的 的个数为
的个数为(3)已知:
 结构如图2所示,该反应
结构如图2所示,该反应(4)有机净化剂的基本组分为大分子立体网格结构的聚合物,可用于工业废水“除钴镍”.其净化原理可表示为:
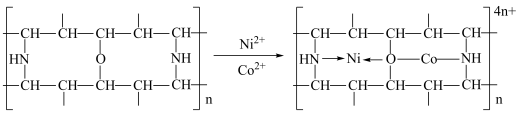
 ”表示出
”表示出 参与的配位键
参与的配位键
您最近一年使用:0次
2024-05-04更新
|
203次组卷
|
2卷引用:河南省郑州市宇华实验学校2023-2024学年高二下学期4月期中考试化学试题
2 . 氰化钾是一种剧毒的物质,贮存和使用时必须注意安全。已知: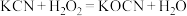 。回答下列问题:
。回答下列问题:
(1)KCN的电子式为______ 。
(2)KOCN中K、O、C、N的电负性由大到小的顺序为______ (用元素符号表示),1mol 中含有的
中含有的 键数目为
键数目为______ , 的空间结构为
的空间结构为______ 。
(3)① 与
与 相似,分子中的共价键类型为
相似,分子中的共价键类型为______ (填“ 键”或“
键”或“ 键”),
键”), 在水中的溶解度比
在水中的溶解度比 的小,其主要原因为
的小,其主要原因为______ 。
② 和
和 结构如图所示。
结构如图所示。

请说明 中
中 略大于
略大于 的原因:
的原因:______ 。
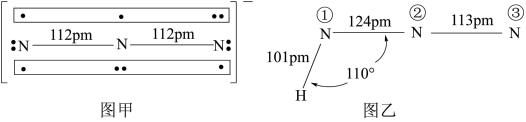
(4) 中
中 结构如图甲,
结构如图甲, 中存在两个大
中存在两个大 键可用符号
键可用符号 (3个原子共享4个电子)表示,一个
(3个原子共享4个电子)表示,一个 中键合电子(形成化学键的电子)总数为
中键合电子(形成化学键的电子)总数为______ 。叠氮酸( )结构如图乙,分子中②号N原子的杂化方式为
)结构如图乙,分子中②号N原子的杂化方式为______ ,叠氮酸( )在常温下是液体,沸点相对较高,为308.8K,主要原因是
)在常温下是液体,沸点相对较高,为308.8K,主要原因是______ 。
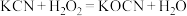 。回答下列问题:
。回答下列问题:(1)KCN的电子式为
(2)KOCN中K、O、C、N的电负性由大到小的顺序为
 中含有的
中含有的 键数目为
键数目为 的空间结构为
的空间结构为(3)①
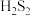 与
与 相似,分子中的共价键类型为
相似,分子中的共价键类型为 键”或“
键”或“ 键”),
键”),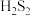 在水中的溶解度比
在水中的溶解度比 的小,其主要原因为
的小,其主要原因为②
 和
和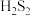 结构如图所示。
结构如图所示。
请说明
 中
中 略大于
略大于 的原因:
的原因:(4)
 中
中 结构如图甲,
结构如图甲, 中存在两个大
中存在两个大 键可用符号
键可用符号 (3个原子共享4个电子)表示,一个
(3个原子共享4个电子)表示,一个 中键合电子(形成化学键的电子)总数为
中键合电子(形成化学键的电子)总数为 )结构如图乙,分子中②号N原子的杂化方式为
)结构如图乙,分子中②号N原子的杂化方式为 )在常温下是液体,沸点相对较高,为308.8K,主要原因是
)在常温下是液体,沸点相对较高,为308.8K,主要原因是
您最近一年使用:0次
解题方法
3 . 回答下列问题:
(1)在下列表格中填写各物质的中心原子杂化轨道类型和空间构型:
(2)一定压强下,将HF和HCl混合气体降温时,首先液化的物质是__________ 。
(1)在下列表格中填写各物质的中心原子杂化轨道类型和空间构型:
|
|
|
|
| |
杂化方式 | |||||
空间构型 |
您最近一年使用:0次
2024-04-08更新
|
68次组卷
|
2卷引用:河南省南阳市六校联考2023-2024学年高二下学期3月月考化学试卷
名校
解题方法
4 . 已知C、N、O、H是元素周期表中前10号元素,它们的原子半径依次减小,H能分别与C、N、O形成电子总数相等的分子 、
、 、
、 。
。
(1)在 、
、 、
、 分子中,C、N、O三原子都采取
分子中,C、N、O三原子都采取___________ 杂化。
(2) 是
是___________ 分子(填“极性”或“非极性”)。
(3) 是一种易液化的气体,请简述其易液化的原因:
是一种易液化的气体,请简述其易液化的原因:___________ 。
(4) 分子的VSEPR模型的空间构型为
分子的VSEPR模型的空间构型为___________ ; 分子的空间构型为
分子的空间构型为___________ 。
 、
、 、
、 。
。(1)在
 、
、 、
、 分子中,C、N、O三原子都采取
分子中,C、N、O三原子都采取(2)
 是
是(3)
 是一种易液化的气体,请简述其易液化的原因:
是一种易液化的气体,请简述其易液化的原因:(4)
 分子的VSEPR模型的空间构型为
分子的VSEPR模型的空间构型为 分子的空间构型为
分子的空间构型为
您最近一年使用:0次
名校
解题方法
5 . 铜及其化合物在工农业生产中有广泛的应用。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有___________(填字母)。
(2)将CuO投入NH3、(NH4)2SO4的混合溶液中进行“氨浸”,控制温度为50℃至55℃,pH约为9.5,CuO转化为溶液。
①CuO被浸取的离子方程式为___________ 。
②[Cu(NH3)4]2+结构中,若用两个H2O分子代替两个NH3分子,可以得到两种不同结构的化合物,由此推测的[Cu(NH3)4]2+空间构型为___________ 。
(3)Cu2+可以与乙二胺(H2N-CH2-CH2-NH2) 形成配离子,结构如图所示:
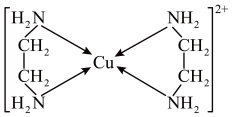
乙二胺分子中N原子成键时采取的VSEPR模型是___________ 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高很多,原因是___________ 。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有___________(填字母)。
| A.离子键 | B.金属键 | C.极性共价键 | D.非极性共价键 |
①CuO被浸取的离子方程式为
②[Cu(NH3)4]2+结构中,若用两个H2O分子代替两个NH3分子,可以得到两种不同结构的化合物,由此推测的[Cu(NH3)4]2+空间构型为
(3)Cu2+可以与乙二胺(H2N-CH2-CH2-NH2) 形成配离子,结构如图所示:

乙二胺分子中N原子成键时采取的VSEPR模型是
您最近一年使用:0次
6 . 呋喃(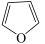 )、噻吩(
)、噻吩( )、吡咯(
)、吡咯(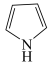 )和苯结构相似,所有的原子共平面,具有芳香性,是有机工业的重要基础原料。利用高粱秆生产呋喃过程中会用到锌、铬和锰的化合物作催化剂。请回答下列问题:
)和苯结构相似,所有的原子共平面,具有芳香性,是有机工业的重要基础原料。利用高粱秆生产呋喃过程中会用到锌、铬和锰的化合物作催化剂。请回答下列问题:
(1)基态Zn原子的价电子轨道表示式为_______ ;Cr在元素周期表中的位置是_______ ;Mn属于_______ 区。
(2)已知吡咯中含有大 键
键 (5个原子共用6个电子),则吡咯中N原子的价层孤电子对占据_______(填字母)。
(5个原子共用6个电子),则吡咯中N原子的价层孤电子对占据_______(填字母)。
(3) 、
、 的碱性随N原子电子云密度的增大而增强,其中碱性较强的是
的碱性随N原子电子云密度的增大而增强,其中碱性较强的是_______ 。
(4)呋喃的氢化饱和产物( )极易溶于水,可能的原因是
)极易溶于水,可能的原因是_______ 。
 )、噻吩(
)、噻吩( )、吡咯(
)、吡咯( )和苯结构相似,所有的原子共平面,具有芳香性,是有机工业的重要基础原料。利用高粱秆生产呋喃过程中会用到锌、铬和锰的化合物作催化剂。请回答下列问题:
)和苯结构相似,所有的原子共平面,具有芳香性,是有机工业的重要基础原料。利用高粱秆生产呋喃过程中会用到锌、铬和锰的化合物作催化剂。请回答下列问题:(1)基态Zn原子的价电子轨道表示式为
(2)已知吡咯中含有大
 键
键 (5个原子共用6个电子),则吡咯中N原子的价层孤电子对占据_______(填字母)。
(5个原子共用6个电子),则吡咯中N原子的价层孤电子对占据_______(填字母)。| A.2s轨道 | B.2p轨道 | C.sp杂化轨道 | D.sp2杂化轨道 |
 、
、 的碱性随N原子电子云密度的增大而增强,其中碱性较强的是
的碱性随N原子电子云密度的增大而增强,其中碱性较强的是(4)呋喃的氢化饱和产物(
 )极易溶于水,可能的原因是
)极易溶于水,可能的原因是
您最近一年使用:0次
7 . 现有下列7种物质
① ;②
;② ;③
;③ ;④
;④ ;⑤
;⑤ ;⑥
;⑥ ;⑦
;⑦
(1)用于制造炸药TNT的是___________ (填序号),写出用其制备TNT的化学方程式___________ 。
(2)具有两性的是___________ (填序号)。
(3)有机物①的沸点比②___________ (填“高”或“低”)。
(4)有机物④形成的高聚物结构简式为___________ 。
(5)写出用新制氢氧化铜检验有机物⑥中含有醛基的化学方程式___________ 。
(6)写出有机物②与足量的有机物⑦充分反应的化学反应方程式___________ 。
①
 ;②
;② ;③
;③ ;④
;④ ;⑤
;⑤ ;⑥
;⑥ ;⑦
;⑦
(1)用于制造炸药TNT的是
(2)具有两性的是
(3)有机物①的沸点比②
(4)有机物④形成的高聚物结构简式为
(5)写出用新制氢氧化铜检验有机物⑥中含有醛基的化学方程式
(6)写出有机物②与足量的有机物⑦充分反应的化学反应方程式
您最近一年使用:0次
2023-04-20更新
|
188次组卷
|
2卷引用:河南省南阳市2022-2023学年高二下学期4月期中化学试题
解题方法
8 . N、 P在元素周期表中属于同一族,回答下列问题:
(1)NCl3的VSEPR模型的名称是___________ ,中心原子的杂化轨道类型是___________ 。
(2)沸点比较:PH3___________ NH3(填“>”“=” 或“<”),理由是___________ 。
(3)已知: H- H键的键能为436kJ· mol-1, N- H键的键能为391 kJ· mol-1, N≡N键的键能为945.6kJ·mol-1则反应N2+3H2 2NH3生成2 molNH3时,共放热
2NH3生成2 molNH3时,共放热___________ kJ。
(1)NCl3的VSEPR模型的名称是
(2)沸点比较:PH3
(3)已知: H- H键的键能为436kJ· mol-1, N- H键的键能为391 kJ· mol-1, N≡N键的键能为945.6kJ·mol-1则反应N2+3H2
 2NH3生成2 molNH3时,共放热
2NH3生成2 molNH3时,共放热
您最近一年使用:0次
2022-06-28更新
|
100次组卷
|
2卷引用:河南省信阳市浉河区新时代学校2021-2022学年高二下学期期末化学试题
名校
9 . 已知H和O可以形成H2O和H2O2两种化合物,试根据有关信息完成下列问题:
(1)水是维持生命活动所必需的一种物质。
①H2O内的O—H、水分子间的范德华力和氢键,从强到弱依次为____ 。
②用球棍模型表示的水分子结构是____ 。____ 杂化。H3O+中的H—O—H键角比H2O中的____ 。
(2)已知H2O2分子的结构如图所示:H2O2分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角93°52′,而两个O—H键与O—O键的夹角均为96°52′。
①H2O2分子的电子式是___ ,结构式是___ 。
②H2O2分子是含有___ 键和___ 键的___ (填“极性”或“非极性”)分子。
③H2O2能与水混溶,却不溶于CCl4。请予以解释:___ 。
(1)水是维持生命活动所必需的一种物质。
①H2O内的O—H、水分子间的范德华力和氢键,从强到弱依次为
②用球棍模型表示的水分子结构是

(2)已知H2O2分子的结构如图所示:H2O2分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角93°52′,而两个O—H键与O—O键的夹角均为96°52′。

①H2O2分子的电子式是
②H2O2分子是含有
③H2O2能与水混溶,却不溶于CCl4。请予以解释:
您最近一年使用:0次
2022-05-09更新
|
239次组卷
|
2卷引用:河南省焦作市2022-2023学年第四中学高二下学期6月月考 化学试卷
10 . 氯元素具有多种化合价,可形成多种化合物。
(1)三氯化氮 是具有刺激性气味的液体,可用于漂白、消毒。它与水反应的化学方程式为
是具有刺激性气味的液体,可用于漂白、消毒。它与水反应的化学方程式为 。已知电负性:
。已知电负性: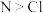 。
。
① 中N元素的化合价为
中N元素的化合价为_______ 。 分子的空间构型是
分子的空间构型是_______ 。
② 易液化的原因是
易液化的原因是_______ 。
(2) 中
中 原子的杂化方式为
原子的杂化方式为_______ , 模型的名称为
模型的名称为_______ 。
(3) 与
与 键角较小的是
键角较小的是_______ ,原因是_______ 。
(4) 与
与 可形成配离子
可形成配离子 ,配体是
,配体是_______ (填离子符号)。
(1)三氯化氮
 是具有刺激性气味的液体,可用于漂白、消毒。它与水反应的化学方程式为
是具有刺激性气味的液体,可用于漂白、消毒。它与水反应的化学方程式为 。已知电负性:
。已知电负性: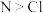 。
。①
 中N元素的化合价为
中N元素的化合价为 分子的空间构型是
分子的空间构型是②
 易液化的原因是
易液化的原因是(2)
 中
中 原子的杂化方式为
原子的杂化方式为 模型的名称为
模型的名称为(3)
 与
与 键角较小的是
键角较小的是(4)
 与
与 可形成配离子
可形成配离子 ,配体是
,配体是
您最近一年使用:0次