名校
1 . 黑火药的主要成分为木炭(C)、硫黄(S)和火硝(KNO3).请回答下列问题。
(1)基态碳原子的电子占据最高能级的电子云轮廓图为___________ 形。
(2)原子核外电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的自旋磁量子数。基态N原子的电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。基态N原子的电子自旋磁量子数的代数和为___________ 。
(3)C、N、O、K四种元素的第一电离能由大到小的顺序为___________ 。
(4)O、S、Se、Te同主族元素,Te位于第五周期
①基态Te原子价电子排布式为___________ ;
②H2Se的中心原子杂化类型是:___________ , SeO32-的立体构型是___________ ;
③比较H2S与H2O沸点高低,并说明原因:___________ 。
(1)基态碳原子的电子占据最高能级的电子云轮廓图为
(2)原子核外电子有两种相反的自旋状态,分别用
 和
和 表示,称为电子的自旋磁量子数。基态N原子的电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。基态N原子的电子自旋磁量子数的代数和为(3)C、N、O、K四种元素的第一电离能由大到小的顺序为
(4)O、S、Se、Te同主族元素,Te位于第五周期
①基态Te原子价电子排布式为
②H2Se的中心原子杂化类型是:
③比较H2S与H2O沸点高低,并说明原因:
您最近一年使用:0次
名校
解题方法
2 . 我国科学家构建了新型催化剂“纳米片”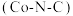 ,该“纳米片”可用于氧化
,该“纳米片”可用于氧化 和吸附
和吸附 。回答下列问题:
。回答下列问题:
(1)基态Co原子的价层电子排布式为_______ ,N、C、Co中第一电离能最大的是_______ (填元素符号)。
(2)在空气中 会被氧化成
会被氧化成 ,
, 中S原子采用
中S原子采用_______ 杂化。已知氧族元素氢化物的熔沸点高低顺序为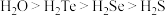 ,其原因是
,其原因是_______ 。
(3)氰 称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则
称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则 分子中σ键、π键个数之比为
分子中σ键、π键个数之比为_______ 。
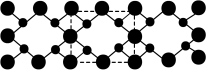
(4)氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如下图所示,它的化学式为_______ 。
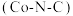 ,该“纳米片”可用于氧化
,该“纳米片”可用于氧化 和吸附
和吸附 。回答下列问题:
。回答下列问题:(1)基态Co原子的价层电子排布式为
(2)在空气中
 会被氧化成
会被氧化成 ,
, 中S原子采用
中S原子采用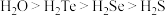 ,其原因是
,其原因是(3)氰
 称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则
称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则 分子中σ键、π键个数之比为
分子中σ键、π键个数之比为(4)氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如下图所示,它的化学式为

您最近一年使用:0次
2024-01-01更新
|
188次组卷
|
3卷引用:云南省昭通市等4地2023-2024学年高二上学期12月月考化学试题
名校
3 . 回答下列小题
(1)下列物质的结构或性质与氢键无关的是___________(填标号)。
(2)HCN是直线形分子,HCN是___________ (填“极性”或“非极性”)分子。
(3)金刚石、石墨、 和石墨烯都是碳的同素异形体
和石墨烯都是碳的同素异形体
①石墨晶体存在作用力有___________ ,还有金属键的特性。
② 的熔点比金刚石、石墨熔点低的原因是
的熔点比金刚石、石墨熔点低的原因是___________ 。
③石墨烯即单层石墨。石墨烯中碳原子的杂化轨道类型为___________ ;碳原子和碳碳键的个数比是___________ 。
(1)下列物质的结构或性质与氢键无关的是___________(填标号)。
| A.乙酸的沸点 | B.乙醇在水中的溶解度 |
| C.氢化镁的相对分子质量 | D.DNA的双螺旋结构 |
(3)金刚石、石墨、
 和石墨烯都是碳的同素异形体
和石墨烯都是碳的同素异形体①石墨晶体存在作用力有
②
 的熔点比金刚石、石墨熔点低的原因是
的熔点比金刚石、石墨熔点低的原因是③石墨烯即单层石墨。石墨烯中碳原子的杂化轨道类型为
您最近一年使用:0次
2023-03-12更新
|
300次组卷
|
3卷引用:云南省昆明师范专科学校附属中学2022-2023学年高二下学期4月月考化学试题
名校
解题方法
4 . X是合成碳酸二苯酯的一种有效的氧化还原催化助剂,可由EDTA与Fe3+反应得到。
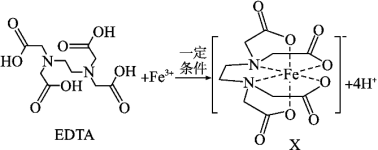
(1)基态Si原子的价层电子的运动状态有_______ 种,若其电子排布式表示为[Ne]3s2 违背了
违背了_______ 。
(2)EDTA中碳原子杂化轨道类型为_______ ,EDTA中四种元素的电负性由小到大的顺序为_______ 。C、N、O第一电离能由小到大的顺序为_______ 。
(3)Fe3+基态价层电子排布式为_______ 。
(4)EDTA与正二十一烷的相对分子质量非常接近,但EDTA的沸点比正二十一烷的沸点高的原因是_______ 。
(5)设NA代表阿伏加德罗常数的值,1mol碳酸分子中含有σ键的数目为_______ 。

(1)基态Si原子的价层电子的运动状态有
 违背了
违背了(2)EDTA中碳原子杂化轨道类型为
(3)Fe3+基态价层电子排布式为
(4)EDTA与正二十一烷的相对分子质量非常接近,但EDTA的沸点比正二十一烷的沸点高的原因是
(5)设NA代表阿伏加德罗常数的值,1mol碳酸分子中含有σ键的数目为
您最近一年使用:0次
5 . 氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置______ 。 的中子数为
的中子数为________ 。
已知:P(s,白磷)=P(s,黑磷) ΔH=-39.3 kJ·mol-1;P(s,白磷)=P(s,红磷) ΔH=-17.6 kJ·mol-1;由此推知,其中最稳定的磷单质是________ 。
(2)氮和磷氢化物性质的比较:热稳定性:NH3________ PH3(填“>”或“<”)。沸点:N2H4________ P2H4(填“>”或“<”),判断依据是____________ 。
(1)砷在元素周期表中的位置
 的中子数为
的中子数为已知:P(s,白磷)=P(s,黑磷) ΔH=-39.3 kJ·mol-1;P(s,白磷)=P(s,红磷) ΔH=-17.6 kJ·mol-1;由此推知,其中最稳定的磷单质是
(2)氮和磷氢化物性质的比较:热稳定性:NH3
您最近一年使用:0次
2020-01-17更新
|
116次组卷
|
3卷引用:云南省盈江县第一高级中学2019-2020学年高一上学期期末考试化学试题
名校
解题方法
6 . 如图为几种晶体或晶胞的示意图:
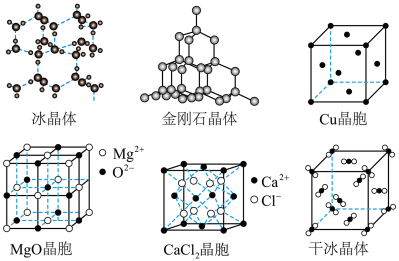
请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是____ 。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为:___ 。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能___ (填“大于”或“小于”)MgO晶体,原因是____ 。
(4)每个Cu晶胞中实际占有___ 个Cu原子,CaCl2晶体中Ca2+的配位数为__ 。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是_____ 。

请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为:
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能
(4)每个Cu晶胞中实际占有
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是
您最近一年使用:0次
2019-09-06更新
|
255次组卷
|
20卷引用:云南省景东一中2017-2018学年高二下学期6月份考试化学试题
云南省景东一中2017-2018学年高二下学期6月份考试化学试题云南省广南一中2019届高三上学期10月月考化学试题云南省丘北县第二中学2018-2019学年高二下学期6月份考试化学试题云南省广南县第三中学2020届高三上学期开学考试化学试题云南省金平县一中2020届高三上学期开学考试化学试题云南省屏边县第一中学2019-2020学年高二上学期12月月考化学试题云南省凤庆县第一中学2019-2020学年高二12月月考化学试题云南省耿马县民族中学2019-2020学年高二12月月考化学试题云南省永平县第二中学2019-2020学年高二上学期期末考试化学试题云南省陇川县第一中学2019-2020学年高二上学期期末考试化学试题云南省梁河县第一中学2019-2020学年高二上学期期末考试化学试题云南省剑川县第一中学2019-2020学年高二上学期期末考试化学试题云南省麻栗坡民族中学2019-2020学年高二上学期期末考试化学试题云南省金平县第一中学2019-2020学年高二上学期期末考试化学试题云南省施甸县第三中学2019-2020学年高二12月月考化学试题2018版化学(苏教版)高考总复习专题十一课时跟踪训练--微粒间作用力与物质性质甘肃省武威第十八中学2018-2019学年高二下学期期中考试化学试题贵州省独山县高级中学2020届高三上学期开学考试理综化学试题黑龙江省哈尔滨市第三十二中学2019-2020学年高二下学期期中考试化学试题山东省菏泽第一中学2021-2022学年高二下学期第一次月考化学试题
名校
7 . 地球上的物质不断变化,数10亿年来大气的成分也发生了很大的变化。下表是原始大气和目前空气的主要成分:
用上表所涉及的分子填写下列空白。
(1)含有10个电子的分子有(填化学式,下同)______________________ ;
(2)由极性键构成的非极性分子有____________________ ;
(3)与H+可直接形成配位键的分子有________ ;
(4)沸点最高的物质是________ ,用所学的知识解释其沸点最高的原因_____________ ;
(5)分子中不含孤电子对的分子(稀有气体除外)有________ ,它的立体构型为________ ;
(6)极易溶于水、且水溶液呈碱性的物质的分子是________ ,它之所以极易溶于水是因为它的分子和水分子之间形成________ ;
(7)CO的结构可表示为O C,与CO结构最相似的分子是
C,与CO结构最相似的分子是________ ,这两种结构相似的分子中,分子的极性________ (填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________ 。
| 目前空气的成分 | N2、O2、CO2、水蒸气及稀有气体(如He、Ne等) |
| 原始大气的主要成分 | CH4、NH3、CO、CO2等 |
(1)含有10个电子的分子有(填化学式,下同)
(2)由极性键构成的非极性分子有
(3)与H+可直接形成配位键的分子有
(4)沸点最高的物质是
(5)分子中不含孤电子对的分子(稀有气体除外)有
(6)极易溶于水、且水溶液呈碱性的物质的分子是
(7)CO的结构可表示为O
 C,与CO结构最相似的分子是
C,与CO结构最相似的分子是
您最近一年使用:0次
2019-06-15更新
|
186次组卷
|
9卷引用:云南省河口县一中2018-2019学年高二上学期期中考试化学试题
云南省河口县一中2018-2019学年高二上学期期中考试化学试题云南省元江民族中学2018-2019学年高二下学期5月月考化学试题云南省红河县一中2020-2021学年高二下学期6月份考试化学试题云南省宣威市第三中学2021-2022学年高二下学期3月份考试化学试题贵州省剑河县第二高级中学2018-2019学年高二上学期12月份考试化学试题吉林省乾安县第七中学2018-2019学年高二下学期第一次质量检测化学试题鲁科版2019选择性必修2第2章综合检测卷福建省建瓯市芝华中学2021-2022学年高二下学期第一次阶段考化学试题贵州省凯里学院附属中学2021-2022学年高二下学期3月月考化学试题
名校
8 . 已知A、B、C、D四种分子所含原子的数目依次为1、3、6、2,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1∶2。D物质能刻蚀玻璃。
(1)A的分子式是________ ,写出A原子的价层电子排布式________ 。
(2)B分子的中心原子的杂化类型是________ ,分子空间构型是________ ,该分子属于________ 分子(填“极性”或“非极性”)。
(3)C的化学式是________ ,分子中含有的化学键类型是________ 。
(4)D物质的沸点比HCl的沸点高,其主要原因是___________________ 。
(1)A的分子式是
(2)B分子的中心原子的杂化类型是
(3)C的化学式是
(4)D物质的沸点比HCl的沸点高,其主要原因是
您最近一年使用:0次
9 . 氯化铬酰(CrO3Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题。
(1)写出铬原子的基态电子排布式:____________________ ,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有________ (填元素符号)。
(2)CrO2Cl2常温下为深红色液体,能与CCl4,CS2等互溶,据此可判断CrO2Cl2是________ 分子(填“极性”或“非极性”)。
(3)在①苯、②CH3OH,③HCHO,④CS2,⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有________ (填序号),CS2分子的空间构型是________ ,易溶于水的有________ (填序号),理由是:_______________________________ 。
(1)写出铬原子的基态电子排布式:
(2)CrO2Cl2常温下为深红色液体,能与CCl4,CS2等互溶,据此可判断CrO2Cl2是
(3)在①苯、②CH3OH,③HCHO,④CS2,⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有
您最近一年使用:0次
2019-01-02更新
|
364次组卷
|
3卷引用:云南省盐津县三中2018-2019学年高二第一学期12月份考试化学试题
名校
10 . 有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知:A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍;E在同周期元素中原子半径最小。
(1)A2B和A2D的沸点较高者是________ (填化学式),其原因是_________ 。
(2)B形成的双原子分子里,从轨道重叠的角度来看共价键的类型有________ 。
(3)E原子的电子排布式为______________________________________________ 。
(1)A2B和A2D的沸点较高者是
(2)B形成的双原子分子里,从轨道重叠的角度来看共价键的类型有
(3)E原子的电子排布式为
您最近一年使用:0次
2018-12-17更新
|
64次组卷
|
2卷引用:云南省丘北县第一中学2021-2022学年高二下学期3月份考试 化学试题



