名校
解题方法
1 . 有机物是生命产生的物质基础,所有的生命体都含有机化合物,按要求回答下列问题。
(1)下列有机物互为同分异构体的是___________ ,互为同系物的是___________ 。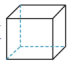 )中的碳原子的杂化类型为
)中的碳原子的杂化类型为___________ 。
(3)有机物的沸点: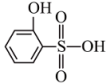
___________ 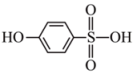 (填“>”、“<”或“=”),有机物
(填“>”、“<”或“=”),有机物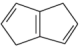 中σ键和π键的数目比为
中σ键和π键的数目比为___________ ,其一氯代物有___________ 种。
(4)碳酸H2CO3虽含有碳元素,但不是有机物。已知它的钾盐K2CO3在水中的溶解度大于KHCO3在水中的溶解度,根据其结构分析可能的原因是___________ 。
(1)下列有机物互为同分异构体的是
①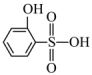 与
与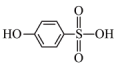 ②
②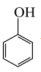 与
与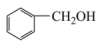 ③
③ 与
与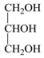
④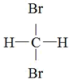 和
和 ⑤CH3COOH与CH3CH2CH2COOH
⑤CH3COOH与CH3CH2CH2COOH
 )中的碳原子的杂化类型为
)中的碳原子的杂化类型为(3)有机物的沸点:

 (填“>”、“<”或“=”),有机物
(填“>”、“<”或“=”),有机物 中σ键和π键的数目比为
中σ键和π键的数目比为(4)碳酸H2CO3虽含有碳元素,但不是有机物。已知它的钾盐K2CO3在水中的溶解度大于KHCO3在水中的溶解度,根据其结构分析可能的原因是
您最近一年使用:0次
名校
解题方法
2 . 我国科学家构建了新型催化剂“纳米片” ,该“纳米片”可用于氧化
,该“纳米片”可用于氧化 和吸附
和吸附 。回答下列问题:
。回答下列问题:
(1)基态Co原子的价层电子排布式为_______ ,N、C、Co中第一电离能最大的是_______ (填元素符号)。
(2)在空气中 会被氧化成
会被氧化成 ,
, 中S原子采用
中S原子采用_______ 杂化。已知氧族元素氢化物的熔沸点高低顺序为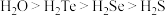 ,其原因是
,其原因是_______ 。
(3)氰 称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则
称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则 分子中σ键、π键个数之比为
分子中σ键、π键个数之比为_______ 。
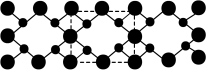
(4)氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如下图所示,它的化学式为_______ 。
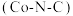 ,该“纳米片”可用于氧化
,该“纳米片”可用于氧化 和吸附
和吸附 。回答下列问题:
。回答下列问题:(1)基态Co原子的价层电子排布式为
(2)在空气中
 会被氧化成
会被氧化成 ,
, 中S原子采用
中S原子采用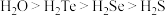 ,其原因是
,其原因是(3)氰
 称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则
称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则 分子中σ键、π键个数之比为
分子中σ键、π键个数之比为(4)氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如下图所示,它的化学式为

您最近一年使用:0次
2024-01-01更新
|
188次组卷
|
3卷引用:江西省景德镇市乐平中学2023-2024学年高二下学期3月月考化学试题
3 . 研究发现,在 低压合成甲醇的反应(
低压合成甲醇的反应(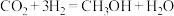 )中,钴氧化物负载的锰氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。根据要求回答下列问题:
)中,钴氧化物负载的锰氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。根据要求回答下列问题:
(1)该反应的产物甲醇和水中,沸点更高的是_______ ,原因是_______ 。
(2)液态水中,三种作用力① 键、②范德华力、③氢键从强到弱的顺序为
键、②范德华力、③氢键从强到弱的顺序为_______ (用标号进行排序)。
(3) 是一种无色液体,其结构如图所示。根据“相似相溶”原理,
是一种无色液体,其结构如图所示。根据“相似相溶”原理, 在水中的溶解度
在水中的溶解度_______ (填“大于”“小于”或“等于”)其在 中的溶解度,原因是
中的溶解度,原因是_______ 。

 低压合成甲醇的反应(
低压合成甲醇的反应(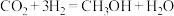 )中,钴氧化物负载的锰氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。根据要求回答下列问题:
)中,钴氧化物负载的锰氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。根据要求回答下列问题:(1)该反应的产物甲醇和水中,沸点更高的是
(2)液态水中,三种作用力①
 键、②范德华力、③氢键从强到弱的顺序为
键、②范德华力、③氢键从强到弱的顺序为(3)
 是一种无色液体,其结构如图所示。根据“相似相溶”原理,
是一种无色液体,其结构如图所示。根据“相似相溶”原理, 在水中的溶解度
在水中的溶解度 中的溶解度,原因是
中的溶解度,原因是
您最近一年使用:0次
名校
4 . 苯甲酸常作食品防腐剂。一种合成路线如下:

回答下列问题:
(1)A的分子式为___________ ,B中官能团名称是___________ 。
(2)上述五种有机物属于___________ (填字母)。
a.芳香烃 b.脂环化合物 c.芳香族化合物 d.脂肪烃衍生物
(3)在催化剂作用下,A与足量的 反应生成F,F的一溴代物有
反应生成F,F的一溴代物有___________ 种。
(4)C中碳原子杂化类型是___________ 。
(5)C、D的沸点依次为204.7℃、179℃,二者沸点差异的主要原因是___________ 。
(6) 与E互为
与E互为___________ (填字母)。
a.同位素 b.同素异形体 c.同系物 d.同分异构体

回答下列问题:
(1)A的分子式为
(2)上述五种有机物属于
a.芳香烃 b.脂环化合物 c.芳香族化合物 d.脂肪烃衍生物
(3)在催化剂作用下,A与足量的
 反应生成F,F的一溴代物有
反应生成F,F的一溴代物有(4)C中碳原子杂化类型是
(5)C、D的沸点依次为204.7℃、179℃,二者沸点差异的主要原因是
(6)
 与E互为
与E互为a.同位素 b.同素异形体 c.同系物 d.同分异构体
您最近一年使用:0次
2023-04-28更新
|
327次组卷
|
2卷引用:江西省南昌市等5地2022-2023学年高二下学期4月期中考试化学试题
名校
解题方法
5 . 按要求完成下列填空:
Cu2+能与NH3、H2O、OH-、Cl-等形成配位数为4的配合物
(1)向CuSO4溶液中加入过量NaOH溶液可生成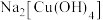 。
。
①画出配离子 的结构:
的结构:_______ 。
②写出该过程生成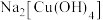 的化学方程式
的化学方程式_______ 。
③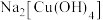 中除了配位键外,还存在的化学键类型有
中除了配位键外,还存在的化学键类型有_______ 。
A.离子键 B.金属键 C.极性共价键 D.非极性共价键
(2)Cu2+可以与乙二胺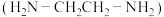 形成配离子(如图):
形成配离子(如图):
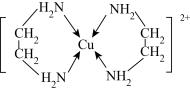
①乙二胺分子中N原子成键时采取的杂化类型是_______ 。
②乙二胺沸点高于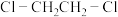 的主要原因是
的主要原因是_______ 。
Cu2+能与NH3、H2O、OH-、Cl-等形成配位数为4的配合物
(1)向CuSO4溶液中加入过量NaOH溶液可生成
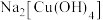 。
。①画出配离子
 的结构:
的结构:②写出该过程生成
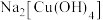 的化学方程式
的化学方程式③
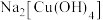 中除了配位键外,还存在的化学键类型有
中除了配位键外,还存在的化学键类型有A.离子键 B.金属键 C.极性共价键 D.非极性共价键
(2)Cu2+可以与乙二胺
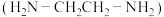 形成配离子(如图):
形成配离子(如图):
①乙二胺分子中N原子成键时采取的杂化类型是
②乙二胺沸点高于
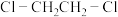 的主要原因是
的主要原因是
您最近一年使用:0次
2023-04-27更新
|
260次组卷
|
3卷引用:江西省高安市灰埠中学2022-2023学年高二下学期5月期中考试化学试题
名校
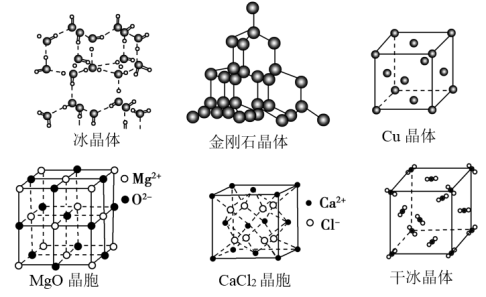
6 . Ⅰ.下图为几种晶体或晶胞的示意图,请回答下列问题:___________ 。
(2)冰、金刚石、MgO、干冰4种晶体的熔点由高到低的顺序为___________ 。
(3)MgO晶胞中,每个MgO晶胞中平均占有___________ 个 ,由与
,由与 最近的
最近的 围成的空间几何构型为
围成的空间几何构型为___________ 。
(4)铜晶体中一个Cu周围紧邻的Cu有___________ 个, 晶体中
晶体中 的配位数是
的配位数是___________ 。
(5)冰的熔点远高于干冰,除 是
是___________ 分子外(填“极性”或“非极性”),还有一个重要的原因是___________ 。
Ⅱ.以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
___________ 个Sn,找出距离Cd(0,0,0)最近的Sn___________ (用分数坐标表示)。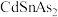 晶体中与单个Sn键合的As有
晶体中与单个Sn键合的As有___________ 个。
(2)冰、金刚石、MgO、干冰4种晶体的熔点由高到低的顺序为
(3)MgO晶胞中,每个MgO晶胞中平均占有
 ,由与
,由与 最近的
最近的 围成的空间几何构型为
围成的空间几何构型为(4)铜晶体中一个Cu周围紧邻的Cu有
 晶体中
晶体中 的配位数是
的配位数是(5)冰的熔点远高于干冰,除
 是
是Ⅱ.以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
| 坐标原子 | x | y | z |
| Cd | 0 | 0 | 0 |
| Sn | 0 | 0 | 0.5 |
| As | 0.25 | 0.25 | 0.125 |
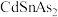 晶体中与单个Sn键合的As有
晶体中与单个Sn键合的As有
您最近一年使用:0次
2023-03-30更新
|
259次组卷
|
2卷引用:江西省南昌市第十九中学2022-2023学年高二下学期期中考试化学试卷
名校
解题方法
7 . 硒和铬元素都是人体必需的微量元素,请回答下列问题:
(1)硒与氧为同主族元素,硒的原子结构示意图为_______ 。
(2)由硒在周期表中的位置分析判断下列说法不正确的是_______(填标号)。
(3)人体内产生的活性氧能加速人体衰老,被称为“生命杀手”,化学家尝试用 及其他富硒物质清除人体内的活性氧,此时Na2SeO3表现出
及其他富硒物质清除人体内的活性氧,此时Na2SeO3表现出_______ 性。
(4)+6价铬的化合物毒性较大,用甲醇酸性燃料电池电解处理酸性含铬废水(主要含有 )的原理示意图如下图所示。
)的原理示意图如下图所示。

①M极的电极反应式为_______ ,N极附近的pH_______ (填“变大”或“变小”或“不变”)
②写出电解池中 转化为Cr3+的离子方程式
转化为Cr3+的离子方程式_______ 。
(1)硒与氧为同主族元素,硒的原子结构示意图为
(2)由硒在周期表中的位置分析判断下列说法不正确的是_______(填标号)。
| A.沸点:H2Se>H2S>H2O | B.热稳性:PH3>H2S>H2Se |
| C.还原性:H2Se>HBr>HF | D.原子半径:Ge>Se>Cl |
 及其他富硒物质清除人体内的活性氧,此时Na2SeO3表现出
及其他富硒物质清除人体内的活性氧,此时Na2SeO3表现出(4)+6价铬的化合物毒性较大,用甲醇酸性燃料电池电解处理酸性含铬废水(主要含有
 )的原理示意图如下图所示。
)的原理示意图如下图所示。
①M极的电极反应式为
②写出电解池中
 转化为Cr3+的离子方程式
转化为Cr3+的离子方程式
您最近一年使用:0次
2021-10-10更新
|
681次组卷
|
4卷引用:江西省景德镇市景德镇一中2022届高三10月月考化学试题
江西省景德镇市景德镇一中2022届高三10月月考化学试题(已下线)第五单元 物质结构与元素周期律(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)2021年北京高考化学试题变式题11-19新疆柯坪县柯坪湖州国庆中学2021-2022学年高二下学期期中考试化学试题
名校
解题方法
8 . 如图为元素周期表的一部分,请参照①-⑨在表中的位置,回答下列问题:(用元素符号或化学用语回答)
(1)由①②⑧三种元素形成的常见化合物的电子式为_____ ,其包含的化学键类型为_____ (填“离子键”、“共价键”)。
(2)⑦和⑨能以原子个数1:2形成化合物,用电子式表示其形成过程_____ 。
(3)金属性最强是_____ 。
(4)③的简单氢化物的沸点比⑦的简单氢化物的沸点_____ (填“高”或“低”),
(5)含氧酸酸性最强的是_____ 。(填分子式)
① | |||||||||||||||||
② | ③ | ||||||||||||||||
④ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||||||
⑨ |
(1)由①②⑧三种元素形成的常见化合物的电子式为
(2)⑦和⑨能以原子个数1:2形成化合物,用电子式表示其形成过程
(3)金属性最强是
(4)③的简单氢化物的沸点比⑦的简单氢化物的沸点
(5)含氧酸酸性最强的是
您最近一年使用:0次
名校
9 . 铝及其化合物在生产生活中具有重要的作用。
(1)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)___ 。
(2)铝电池性能优越,在现代生产、生活中有广泛的应用。铝—空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。
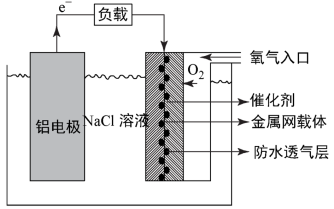
该电池的正极反应方程式为___ ,当铝电极质量减少9克,则另一极通入的氧气的体积在标准状况下为___ 。
(3)AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN),且生成N2。写出反应化学方程式为___ 。
(4)在元素周期表中,砷位于铝的下一周期,与氮元素同主族,写出AsH3分子的电子式为___ ,相同压强下,AsH3的沸点___ NH3(填“大于”或“小于”)。
(1)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)
(2)铝电池性能优越,在现代生产、生活中有广泛的应用。铝—空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。

该电池的正极反应方程式为
(3)AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN),且生成N2。写出反应化学方程式为
(4)在元素周期表中,砷位于铝的下一周期,与氮元素同主族,写出AsH3分子的电子式为
您最近一年使用:0次
名校
解题方法
10 . (1)下列物质变化,只与范德华力有关的是___ 。
A.干冰熔化 B.乙酸汽化 C.乙醇溶于水 D.碘溶于四氯化碳
(2)下面是s能级与p能级的原子轨道图:
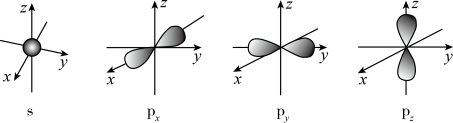
请回答下列问题:
s电子的原子轨道呈__ 形,每个s能级有__ 个原子轨道;p电子的原子轨道呈___ 形,每个p能级有___ 个原子轨道.
(3)Na、Mg、Al第一电离能的由大到小的顺序:___ 。
(4)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列:
①2s ②3d ③4s ④3s ⑤4p ⑥3p
轨道能量由低到高排列顺序是___ 。
A.干冰熔化 B.乙酸汽化 C.乙醇溶于水 D.碘溶于四氯化碳
(2)下面是s能级与p能级的原子轨道图:

请回答下列问题:
s电子的原子轨道呈
(3)Na、Mg、Al第一电离能的由大到小的顺序:
(4)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列:
①2s ②3d ③4s ④3s ⑤4p ⑥3p
轨道能量由低到高排列顺序是
您最近一年使用:0次



