1 . N元素能形成多种化合物,它们之间可以发生相互转化,如: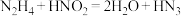 。请回答下列问题:
。请回答下列问题:
(1)N与O的第一电离能较小的是___________ 。
(2)N的基态原子的电子排布中,有___________ 个运动状态不同的未成对电子。
(3)叠氮酸 在常温下是液体,沸点相对较高,为308.8K,主要原因是
在常温下是液体,沸点相对较高,为308.8K,主要原因是___________ 。
(4) 中N原子的杂化类型是
中N原子的杂化类型是___________ 。
(5)① 是一种很好的配体,则能提供孤电子对的
是一种很好的配体,则能提供孤电子对的___________ (填字母)。
A.仅有氧原子
B.仅有氮原子
C.是氧原子或氮原子
② 与钴盐通过配位键形成的
与钴盐通过配位键形成的 能与
能与 结合生成黄色
结合生成黄色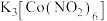 沉淀,此方法可用于检验溶液中的
沉淀,此方法可用于检验溶液中的 ,写出该配合物中钴离子的电子排布式:
,写出该配合物中钴离子的电子排布式:___________ 。
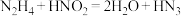 。请回答下列问题:
。请回答下列问题:(1)N与O的第一电离能较小的是
(2)N的基态原子的电子排布中,有
(3)叠氮酸
 在常温下是液体,沸点相对较高,为308.8K,主要原因是
在常温下是液体,沸点相对较高,为308.8K,主要原因是(4)
 中N原子的杂化类型是
中N原子的杂化类型是(5)①
 是一种很好的配体,则能提供孤电子对的
是一种很好的配体,则能提供孤电子对的A.仅有氧原子
B.仅有氮原子
C.是氧原子或氮原子
②
 与钴盐通过配位键形成的
与钴盐通过配位键形成的 能与
能与 结合生成黄色
结合生成黄色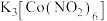 沉淀,此方法可用于检验溶液中的
沉淀,此方法可用于检验溶液中的 ,写出该配合物中钴离子的电子排布式:
,写出该配合物中钴离子的电子排布式:
您最近一年使用:0次
名校
解题方法
2 . 有机物是一类重要的化合物,不仅种类繁多,而且与我们的日常生活密切相关。
Ⅰ.下列有机物:_______ 、⑦_______ 。
(2)⑧被酸性高锰酸钾氧化的产物为_______ 。
(3)所有原子一定共面的是_______ (填序号,下同)。
(4)⑨的二氯代物有_______ 种同分异构体。
(5)水溶性最好的是_______ ,原因_______ 。
Ⅱ.烷烃主要来源是石油和天然气,是重要的化工原料和能源物资。
(6)表中烷烃的氢原子的化学环境只有一种,分析下表中各项的排布规律,按此规律排布第6项X应为_______ (选填编号)。
a.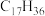 b.
b.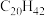 c.
c.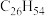 d.
d.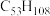
Ⅰ.下列有机物:
①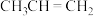 ;②
;②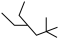 ;③
;③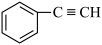 ;④
;④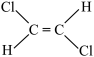 ;⑤
;⑤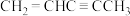 ;
;
⑥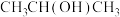 ;⑦
;⑦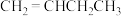 ;⑧
;⑧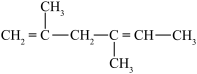 ;⑨
;⑨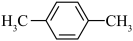 ;
;
(2)⑧被酸性高锰酸钾氧化的产物为
(3)所有原子一定共面的是
(4)⑨的二氯代物有
(5)水溶性最好的是
Ⅱ.烷烃主要来源是石油和天然气,是重要的化工原料和能源物资。
(6)表中烷烃的氢原子的化学环境只有一种,分析下表中各项的排布规律,按此规律排布第6项X应为
| 1 | 2 | 3 | 4 | 5 | 6 | … |
 |  | 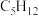 | 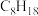 | X |
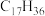 b.
b.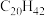 c.
c.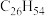 d.
d.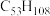
您最近一年使用:0次
2024-04-19更新
|
349次组卷
|
2卷引用:山东省青岛第五十八中学2023-2024学年高二下学期4月月考化学试卷
名校
解题方法
3 . 我国科学家构建了新型催化剂“纳米片”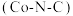 ,该“纳米片”可用于氧化
,该“纳米片”可用于氧化 和吸附
和吸附 。回答下列问题:
。回答下列问题:
(1)基态Co原子的价层电子排布式为_______ ,N、C、Co中第一电离能最大的是_______ (填元素符号)。
(2)在空气中 会被氧化成
会被氧化成 ,
, 中S原子采用
中S原子采用_______ 杂化。已知氧族元素氢化物的熔沸点高低顺序为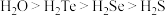 ,其原因是
,其原因是_______ 。
(3)氰 称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则
称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则 分子中σ键、π键个数之比为
分子中σ键、π键个数之比为_______ 。
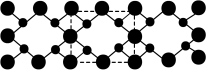
(4)氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如下图所示,它的化学式为_______ 。
 ,该“纳米片”可用于氧化
,该“纳米片”可用于氧化 和吸附
和吸附 。回答下列问题:
。回答下列问题:(1)基态Co原子的价层电子排布式为
(2)在空气中
 会被氧化成
会被氧化成 ,
, 中S原子采用
中S原子采用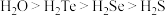 ,其原因是
,其原因是(3)氰
 称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则
称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则 分子中σ键、π键个数之比为
分子中σ键、π键个数之比为(4)氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如下图所示,它的化学式为

您最近一年使用:0次
2024-01-01更新
|
187次组卷
|
3卷引用:山东省菏泽市东明县第一中学2023-2024学年高二下学期开学化学试题
名校
解题方法
4 . 硼、砷、铁等元素可形成结构、性质各异的物质,在生产、科研中发挥着重要用途。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是___________ (填标号,下同),用光谱仪可捕捉到发射光谱的是___________ 。___________ 种。CH3As(OH)2与(CH3)2AsOH两种含砷有机酸中沸点较高的是___________ (填化学式),原因为___________ 。
(3)LiZnAs晶体的立方晶胞结构如图1所示,N点原子分数坐标为( ,
, ,
, );LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体LiZnmMnnAs,其立方晶胞结构如图2所示。
);LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体LiZnmMnnAs,其立方晶胞结构如图2所示。___________ 。
②m=_________
③已知NA为阿伏加德罗常数的值,LiZnmMnnAs的摩尔质量为Mg/mol,晶体密度为dg/cm3。晶胞中As原子与Mn原子之间的最短距离为___________ nm(列出计算式)。
(4)FeSO4·7H2O的结构如图所示。___________ (填序号)。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是
A.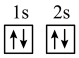 B.
B.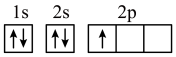
C. D.
D.
(3)LiZnAs晶体的立方晶胞结构如图1所示,N点原子分数坐标为(
 ,
, ,
, );LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体LiZnmMnnAs,其立方晶胞结构如图2所示。
);LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体LiZnmMnnAs,其立方晶胞结构如图2所示。
②m=
③已知NA为阿伏加德罗常数的值,LiZnmMnnAs的摩尔质量为Mg/mol,晶体密度为dg/cm3。晶胞中As原子与Mn原子之间的最短距离为
(4)FeSO4·7H2O的结构如图所示。

您最近一年使用:0次
2023-12-27更新
|
554次组卷
|
3卷引用:山东省实验中学2023-2024学年高三上学期11月二诊化学试题
5 . I、
(1)已知某温度时,KW=1.0×10-12,Na2CO3溶液的水解常数Kh=2.0×10—3,则当溶液中c(HCO ):c(CO
):c(CO )=2:1时,试求该溶液的pH=
)=2:1时,试求该溶液的pH=______ 。
(2)已知25℃时,NH3·H2O的电离平衡常数Kb=1.8×10-5,该温度下1mol·L-1的NH4Cl溶液中c(H+)=______ mol·L-1(已知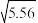 ≈2.36)。
≈2.36)。
(3)25℃时,H2SO3 HSO
HSO +H+的电离常数Ka=1×10-2,则该温度下NaHSO3水解反应的平衡常数Kh=
+H+的电离常数Ka=1×10-2,则该温度下NaHSO3水解反应的平衡常数Kh=______ ,若向NaHSO3溶液中加入少量的I2,则溶液中 将
将______ (填“增大”“减小”或“不变”)。
(4)已知常温下CN—的水解常数Kh=1.61×10—5.。
①常温下,含等物质的量浓度的HCN与NaCN的混合溶液显______ (填“酸”“碱”或“中”)性,c(CN—)______ (填“>”“<”或“=”)c(HCN),该溶液中各离子浓度由大到小的顺序为______ 。
②常温下,若将cmol·L-1盐酸与0.62mol·L-1KCN溶液等体积混合后恰好得到中性溶液,则c=______ (小数点后保留4位数字)。
II、
(5)比较结合H+能力的相对强弱:
______  (填“>”“<”或“=”),用一个离子方程式说明
(填“>”“<”或“=”),用一个离子方程式说明 给出H+的能力比H2O强:
给出H+的能力比H2O强:______ 。
(6)联氨N2H4是共价化合物,各原子均满足2或8电子稳定结构,写出联氨的电子式:______ 。
(7)NH3极易溶于水的主要原因是______ 。
(1)已知某温度时,KW=1.0×10-12,Na2CO3溶液的水解常数Kh=2.0×10—3,则当溶液中c(HCO
 ):c(CO
):c(CO )=2:1时,试求该溶液的pH=
)=2:1时,试求该溶液的pH=(2)已知25℃时,NH3·H2O的电离平衡常数Kb=1.8×10-5,该温度下1mol·L-1的NH4Cl溶液中c(H+)=
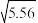 ≈2.36)。
≈2.36)。(3)25℃时,H2SO3
 HSO
HSO +H+的电离常数Ka=1×10-2,则该温度下NaHSO3水解反应的平衡常数Kh=
+H+的电离常数Ka=1×10-2,则该温度下NaHSO3水解反应的平衡常数Kh= 将
将(4)已知常温下CN—的水解常数Kh=1.61×10—5.。
①常温下,含等物质的量浓度的HCN与NaCN的混合溶液显
②常温下,若将cmol·L-1盐酸与0.62mol·L-1KCN溶液等体积混合后恰好得到中性溶液,则c=
II、
(5)比较结合H+能力的相对强弱:

 (填“>”“<”或“=”),用一个离子方程式说明
(填“>”“<”或“=”),用一个离子方程式说明 给出H+的能力比H2O强:
给出H+的能力比H2O强:(6)联氨N2H4是共价化合物,各原子均满足2或8电子稳定结构,写出联氨的电子式:
(7)NH3极易溶于水的主要原因是
您最近一年使用:0次
名校
解题方法
6 . 根据所学知识回答下列问题。
(1)辨析相似概念是化学学科学习的基础,以下物质:① 和
和 ;②
;② 和
和 ;③CH3CH2CHO和CH3COCH3;④D和T;⑤氯水与液氯;⑥16O与18O;⑦CH2=CHCH3和CH3CH=CH2;⑧红磷和白磷,用数字序号回答下列问题:
;③CH3CH2CHO和CH3COCH3;④D和T;⑤氯水与液氯;⑥16O与18O;⑦CH2=CHCH3和CH3CH=CH2;⑧红磷和白磷,用数字序号回答下列问题:
互为同系物的是________ ;互为同分异构体的是________ ;属于同一种物质的是________ ;互为同素异形体的是________ ;属于同位素的是_______ 。
(2)X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期主族元素。W与Z同主族,X可以分别与Y、Z、W形成八核、四核、三核的18电子分子。
ⅰ.由X、Y两种元素组成的分子中只含有22个共价单键的链状化合物的分子式为________ ;其主链含有五个碳原子的同分异构体有________ 种。
ii.YW2分子中的化学键为_______ (填“离子键”、“极性共价键”或“非极性共价键”)。
ⅲ.X2Z、X2W沸点更高的是_______ (填化学式)。
ⅳ.由X、Y两种元素形成的10电子分子的空间构型为_______ 。
(1)辨析相似概念是化学学科学习的基础,以下物质:①
 和
和 ;②
;② 和
和 ;③CH3CH2CHO和CH3COCH3;④D和T;⑤氯水与液氯;⑥16O与18O;⑦CH2=CHCH3和CH3CH=CH2;⑧红磷和白磷,用数字序号回答下列问题:
;③CH3CH2CHO和CH3COCH3;④D和T;⑤氯水与液氯;⑥16O与18O;⑦CH2=CHCH3和CH3CH=CH2;⑧红磷和白磷,用数字序号回答下列问题:互为同系物的是
(2)X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期主族元素。W与Z同主族,X可以分别与Y、Z、W形成八核、四核、三核的18电子分子。
ⅰ.由X、Y两种元素组成的分子中只含有22个共价单键的链状化合物的分子式为
ii.YW2分子中的化学键为
ⅲ.X2Z、X2W沸点更高的是
ⅳ.由X、Y两种元素形成的10电子分子的空间构型为
您最近一年使用:0次
7 . 丙烯酸(V)是重要的化工原料,可用化合物I为原料制备,合成路线如下。
(1)鉴别I和III可选用的试剂为_______ ;III分子中共平面的原子最多有_______ 个。
(2)II与 反应生成III的化学方程式为
反应生成III的化学方程式为_______ 。
(3)IV存在顺反异构体,其中沸点较高的是_______ (填“顺式”或“反式”),理由是_______ 。
(4)IV生成V的反应中原子利用率为100%,且1molIV与1molX反应得到2molV,则X的名称为_______ 。
(5)1molI与_______  发生加成反应可以生成
发生加成反应可以生成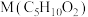 ;M有多种同分异构体,其中能发生银镜反应且核磁共振氢谱只有两组峰的结构简式为
;M有多种同分异构体,其中能发生银镜反应且核磁共振氢谱只有两组峰的结构简式为_______ 。
(1)鉴别I和III可选用的试剂为
(2)II与
 反应生成III的化学方程式为
反应生成III的化学方程式为(3)IV存在顺反异构体,其中沸点较高的是
(4)IV生成V的反应中原子利用率为100%,且1molIV与1molX反应得到2molV,则X的名称为
(5)1molI与
 发生加成反应可以生成
发生加成反应可以生成 ;M有多种同分异构体,其中能发生银镜反应且核磁共振氢谱只有两组峰的结构简式为
;M有多种同分异构体,其中能发生银镜反应且核磁共振氢谱只有两组峰的结构简式为
您最近一年使用:0次
8 . 有机物种类繁多,应用广泛。
(1)邻氨基吡啶(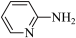 )的铜配合物在有机不对称合成中起催化诱导效应。邻氨基吡啶中所有元素的电负性由大到小的顺序为
)的铜配合物在有机不对称合成中起催化诱导效应。邻氨基吡啶中所有元素的电负性由大到小的顺序为_______ (填元素符号)。 能溶于水的原因是
能溶于水的原因是_______ 。
(2)鸟嘌呤和吡咯的结构如下图所示。
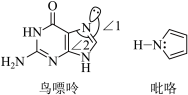
①鸟嘌呤中N原子的杂化方式为_______ ,夹角∠1_______ ∠2(填“>”或“<”)。
②分子中的大 键可以用符号
键可以用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数,吡咯中的大
键的电子数,吡咯中的大 键可表示为
键可表示为_______ 。
(3)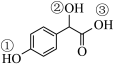 分子中3个-OH的电离能力由强到弱的顺序是
分子中3个-OH的电离能力由强到弱的顺序是_______ (用①、②、③表示)。
(4)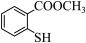 与
与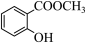 相比,前者的水溶性更
相比,前者的水溶性更_______ (填“大”或“小”)。—SH与—OH性质相似,写出与NaOH溶液反应的化学方程式_______ 。
(1)邻氨基吡啶(
 )的铜配合物在有机不对称合成中起催化诱导效应。邻氨基吡啶中所有元素的电负性由大到小的顺序为
)的铜配合物在有机不对称合成中起催化诱导效应。邻氨基吡啶中所有元素的电负性由大到小的顺序为 能溶于水的原因是
能溶于水的原因是(2)鸟嘌呤和吡咯的结构如下图所示。

①鸟嘌呤中N原子的杂化方式为
②分子中的大
 键可以用符号
键可以用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数,吡咯中的大
键的电子数,吡咯中的大 键可表示为
键可表示为(3)
 分子中3个-OH的电离能力由强到弱的顺序是
分子中3个-OH的电离能力由强到弱的顺序是(4)
 与
与 相比,前者的水溶性更
相比,前者的水溶性更
您最近一年使用:0次
2023-07-11更新
|
360次组卷
|
2卷引用:山东省泰安市2022-2023学年高二下学期期末考试化学试题
9 . 下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)写出元素m的基态一价离子的核外电子排布式:___________ 。
(2)对应元素氢化物沸点e高于j的原因:___________ 。
(3)元素q与h同族,化合物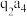 常用作火箭燃料,写出其电子式:
常用作火箭燃料,写出其电子式:___________ 。
(4)写出b的氢氧化物与f的氢氧化物反应的化学方程式___________ 。
(5)m和n比较:第一电离能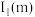
___________ 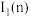 (填“大于”或“小于”),原因是
(填“大于”或“小于”),原因是___________ 。
(6)实验室制得元素k的单质中混有其氢化物,可用四氯化碳分离,其原理是:___________ 。

请回答下列问题:
(1)写出元素m的基态一价离子的核外电子排布式:
(2)对应元素氢化物沸点e高于j的原因:
(3)元素q与h同族,化合物
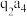 常用作火箭燃料,写出其电子式:
常用作火箭燃料,写出其电子式:(4)写出b的氢氧化物与f的氢氧化物反应的化学方程式
(5)m和n比较:第一电离能
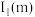
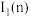 (填“大于”或“小于”),原因是
(填“大于”或“小于”),原因是(6)实验室制得元素k的单质中混有其氢化物,可用四氯化碳分离,其原理是:
您最近一年使用:0次
10 . 下表给出了三组物质的相关性质数据
回答下列问题:
(1)A组中的碳化硅属于_______ 晶体,碳化硅的沸点
_______ 3350(填“大于”、“小于”或“等于”),石墨沸点高于金刚石的原因是_______ 。
(2)判断B组中甲醇沸点 的范围
的范围_______ 。
a.>117.6 b.34.5~117.6 c.<34.5
(3)在水中的溶解度, 远大于
远大于 ,原因是
,原因是_______ 。
(4)C组物质,其晶体中微粒之间的作用力名称是_______ 。该组物质可能具有的性质是_______ 。
①硬度小②熔融状态能导电③固体能导电④熔点较低
| A组(沸点/℃) | B组(沸点/℃) | C组(晶格能/kJ•mol⁻¹) |
| 金刚石:3350 |  : : | NaCl:a |
| 石墨:3850 |  :117.6 :117.6 | NaBr:b |
碳化硅: |  :34.5 :34.5 | MgO:c |
(1)A组中的碳化硅属于

(2)判断B组中甲醇沸点
 的范围
的范围a.>117.6 b.34.5~117.6 c.<34.5
(3)在水中的溶解度,
 远大于
远大于 ,原因是
,原因是(4)C组物质,其晶体中微粒之间的作用力名称是
①硬度小②熔融状态能导电③固体能导电④熔点较低
您最近一年使用:0次



