1 . 氮族元素在化学领域具有重要的地位。请回答下列问题:
(1)基态氮原子的未成对电子数为_______ ;第二周期的元素中,第一电离能介于 和
和 之间的元素有
之间的元素有_______ (填元素符号)。
(2) 是一种有毒气体,用于合成医药制剂、农药杀虫剂等。其中
是一种有毒气体,用于合成医药制剂、农药杀虫剂等。其中 原子的杂化类型为
原子的杂化类型为_______ 。 的沸点
的沸点_______ (填“高于”或“低于”) 的沸点,主要原因是
的沸点,主要原因是_______ 。
(3)氮化碳和氮化硅晶体结构相似,是新型的非金属高温陶瓷材料,它们的硬度大、熔点高,化学性质稳定。氮化碳的硬度_______ (填“大于”或“小于”)氮化硅的硬度,原因是_______ 。
(4)AlN晶胞如图所示,晶胞的边长为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则
,则
_______  。
。
(1)基态氮原子的未成对电子数为
 和
和 之间的元素有
之间的元素有(2)
 是一种有毒气体,用于合成医药制剂、农药杀虫剂等。其中
是一种有毒气体,用于合成医药制剂、农药杀虫剂等。其中 原子的杂化类型为
原子的杂化类型为 的沸点
的沸点 的沸点,主要原因是
的沸点,主要原因是(3)氮化碳和氮化硅晶体结构相似,是新型的非金属高温陶瓷材料,它们的硬度大、熔点高,化学性质稳定。氮化碳的硬度
(4)AlN晶胞如图所示,晶胞的边长为
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则
,则
 。
。
您最近一年使用:0次
名校
解题方法
2 . 按要求完成下列填空:
Cu2+能与NH3、H2O、OH-、Cl-等形成配位数为4的配合物
(1)向CuSO4溶液中加入过量NaOH溶液可生成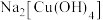 。
。
①画出配离子 的结构:
的结构:_______ 。
②写出该过程生成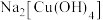 的化学方程式
的化学方程式_______ 。
③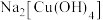 中除了配位键外,还存在的化学键类型有
中除了配位键外,还存在的化学键类型有_______ 。
A.离子键 B.金属键 C.极性共价键 D.非极性共价键
(2)Cu2+可以与乙二胺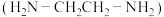 形成配离子(如图):
形成配离子(如图):
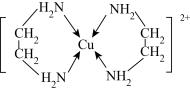
①乙二胺分子中N原子成键时采取的杂化类型是_______ 。
②乙二胺沸点高于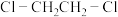 的主要原因是
的主要原因是_______ 。
Cu2+能与NH3、H2O、OH-、Cl-等形成配位数为4的配合物
(1)向CuSO4溶液中加入过量NaOH溶液可生成
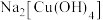 。
。①画出配离子
 的结构:
的结构:②写出该过程生成
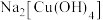 的化学方程式
的化学方程式③
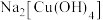 中除了配位键外,还存在的化学键类型有
中除了配位键外,还存在的化学键类型有A.离子键 B.金属键 C.极性共价键 D.非极性共价键
(2)Cu2+可以与乙二胺
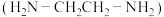 形成配离子(如图):
形成配离子(如图):
①乙二胺分子中N原子成键时采取的杂化类型是
②乙二胺沸点高于
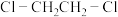 的主要原因是
的主要原因是
您最近一年使用:0次
2023-04-27更新
|
260次组卷
|
3卷引用:吉林省长春市第十七中学2022-2023学年高二下学期4月月考化学试题
名校
解题方法
3 . 氮、氧、磷、砷及其化合物在工农业生产等方面有着重要应用。请按要求回答下列问题。
(1)基态砷原子价电子排布图不能写为 ,是因为该排布方式违背了
,是因为该排布方式违背了__________ 这一原理。
(2)元素第一电离能N______ O(填“>”或“<”或“=”,下同),电负性P______  。
。
(3)肼 可用作火箭燃料等,它的沸点远高于乙烯的原因是:
可用作火箭燃料等,它的沸点远高于乙烯的原因是:__________ 。
(4)尿素( )中碳原子杂化类型
)中碳原子杂化类型__________ ; 离子的立体构型(即空间构型)为
离子的立体构型(即空间构型)为__________ 。
(5) 的熔点为1238℃可作半导体材料;而
的熔点为1238℃可作半导体材料;而 的熔点为77.9℃。
的熔点为77.9℃。
①预测 的晶体类型为
的晶体类型为__________ 。
② 晶胞结构如图所示,晶胞边长为
晶胞结构如图所示,晶胞边长为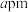 。则晶胞中每个
。则晶胞中每个 原子周围有
原子周围有__________ 个紧邻等距的 原子;该晶体的密度为
原子;该晶体的密度为__________  (列出计算式)。
(列出计算式)。

(1)基态砷原子价电子排布图不能写为
 ,是因为该排布方式违背了
,是因为该排布方式违背了(2)元素第一电离能N
 。
。(3)肼
 可用作火箭燃料等,它的沸点远高于乙烯的原因是:
可用作火箭燃料等,它的沸点远高于乙烯的原因是:(4)尿素(
 )中碳原子杂化类型
)中碳原子杂化类型 离子的立体构型(即空间构型)为
离子的立体构型(即空间构型)为(5)
 的熔点为1238℃可作半导体材料;而
的熔点为1238℃可作半导体材料;而 的熔点为77.9℃。
的熔点为77.9℃。①预测
 的晶体类型为
的晶体类型为②
 晶胞结构如图所示,晶胞边长为
晶胞结构如图所示,晶胞边长为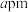 。则晶胞中每个
。则晶胞中每个 原子周围有
原子周围有 原子;该晶体的密度为
原子;该晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2022-11-20更新
|
1002次组卷
|
6卷引用:吉林省吉林松花江中学2022-2023学年高二上学期1月期末考试化学试题
吉林省吉林松花江中学2022-2023学年高二上学期1月期末考试化学试题天津市河北区2022-2023学年高三上学期期中质量检测化学试题(已下线)北京市海淀区2022届高三一模(结构与性质)(已下线)2022年天津市普通高中学业水平等级性考试化学试题变式题(结构与性质)(已下线)期中模拟预测卷03(测试范围:选择性必修2+选择性必修3第1-2章)-2022-2023学年高二化学下学期期中期末考点大串讲(人教版2019)宁夏青铜峡市宁朔中学2022-2023学年高二下学期期中考试化学试题
名校
解题方法
4 . 填空。
(1) 分子中,P的杂化方式
分子中,P的杂化方式_______ 。
(2)经X射线衍射测得化合物R的晶体结构,其局部结构如下图所示。

①从结构角度分析,R中两种阳离子的相同之处为_______ 。(填标号)
A.中心原子的杂化轨道类型B.中心原子的价层电子对数
C.空间结构D.共价键类型
②R中阴离子 中的
中的 键总数为
键总数为_______ 个。分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则
),则 中的大π键应表示为
中的大π键应表示为_______ 。
③图中虚线代表氢键,其表示式为 、
、 、
、_______ 。
(1)
 分子中,P的杂化方式
分子中,P的杂化方式(2)经X射线衍射测得化合物R的晶体结构,其局部结构如下图所示。

①从结构角度分析,R中两种阳离子的相同之处为
A.中心原子的杂化轨道类型B.中心原子的价层电子对数
C.空间结构D.共价键类型
②R中阴离子
 中的
中的 键总数为
键总数为 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则
),则 中的大π键应表示为
中的大π键应表示为③图中虚线代表氢键,其表示式为
 、
、 、
、
您最近一年使用:0次
名校
解题方法
5 . 完成下列问题。
(1) 是有机合成中常用的还原剂。
是有机合成中常用的还原剂。 中,存在_______(填标号)。
中,存在_______(填标号)。
(2)气态三氧化硫以单分子形式存在,其中按轨道重叠方式分类共价键的类型有_______ 种。
(3)等电子体的结构相似、物理性质相近,称为等电子原理。如 和CO为等电子体。试回答:
和CO为等电子体。试回答:
①写出下面物质分子或离子的立体构型:

_______ ,
_______ 。
②由第二周期元素组成,与 互为等电子体的离子有
互为等电子体的离子有_______ 。
③ 的立体构型如图1所示,请再按照图1的表示方法在图2中表示
的立体构型如图1所示,请再按照图1的表示方法在图2中表示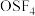 分子中O、S、F原子的空间位置
分子中O、S、F原子的空间位置_______ 。已知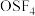 分子中O、S间为共价双键,S、F间为共价单键。(已知三键斥力>双键斥力>单键斥力)
分子中O、S间为共价双键,S、F间为共价单键。(已知三键斥力>双键斥力>单键斥力)
(4)氨气在水中的溶解度远大于甲烷,原因是_______ (答出三条)。
(1)
 是有机合成中常用的还原剂。
是有机合成中常用的还原剂。 中,存在_______(填标号)。
中,存在_______(填标号)。| A.离子键 | B.σ键 | C.π键 | D.氢键 |
(3)等电子体的结构相似、物理性质相近,称为等电子原理。如
 和CO为等电子体。试回答:
和CO为等电子体。试回答:①写出下面物质分子或离子的立体构型:


②由第二周期元素组成,与
 互为等电子体的离子有
互为等电子体的离子有③
 的立体构型如图1所示,请再按照图1的表示方法在图2中表示
的立体构型如图1所示,请再按照图1的表示方法在图2中表示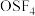 分子中O、S、F原子的空间位置
分子中O、S、F原子的空间位置 分子中O、S间为共价双键,S、F间为共价单键。(已知三键斥力>双键斥力>单键斥力)
分子中O、S间为共价双键,S、F间为共价单键。(已知三键斥力>双键斥力>单键斥力)
(4)氨气在水中的溶解度远大于甲烷,原因是
您最近一年使用:0次
名校
解题方法
6 . (锌的化合物)ZSM是2-甲基咪唑和水杨酸与锌形成的化合物,2-甲基咪唑可通过下列反应制备:H2NCH2CH2NH2+CH3CN
 +NH3。
+NH3。
①C、N、H的电负性由大到小的顺序是_______ 。
②CN-的价电子总数为_______ 。
③2-甲基咪唑中碳原子杂化轨道类型为_______ ;1 mol 2-甲基咪唑分子中含σ键数目为_______ ;NH3易溶于水的主要原因是_______ 。

 +NH3。
+NH3。①C、N、H的电负性由大到小的顺序是
②CN-的价电子总数为
③2-甲基咪唑中碳原子杂化轨道类型为
您最近一年使用:0次
7 . 氧是地壳中含量最多的元素。
(1)氧元素基态原子核外未成对电子数为__ 。
(2)H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为__ 。
(3) 的沸点比
的沸点比 高,原因是
高,原因是___ 。
(1)氧元素基态原子核外未成对电子数为
(2)H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为
(3)
 的沸点比
的沸点比 高,原因是
高,原因是
您最近一年使用:0次
8 . 氧是地壳中含量最多的元素。
(1)氧元素基态原子核外未成对电子数为_______ 。
(2)H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为______ 。 的沸点比
的沸点比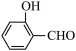 高,原因是
高,原因是_______ 。
(1)氧元素基态原子核外未成对电子数为
(2)H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为
 的沸点比
的沸点比 高,原因是
高,原因是
您最近一年使用:0次
2019-06-25更新
|
64次组卷
|
2卷引用:吉林省汪清县第六中学2018-2019学年高二6月月考化学试题
名校
9 . 地球上的物质不断变化,数10亿年来大气的成分也发生了很大的变化。下表是原始大气和目前空气的主要成分:
用上表所涉及的分子填写下列空白。
(1)含有10个电子的分子有(填化学式,下同)______________________ ;
(2)由极性键构成的非极性分子有____________________ ;
(3)与H+可直接形成配位键的分子有________ ;
(4)沸点最高的物质是________ ,用所学的知识解释其沸点最高的原因_____________ ;
(5)分子中不含孤电子对的分子(稀有气体除外)有________ ,它的立体构型为________ ;
(6)极易溶于水、且水溶液呈碱性的物质的分子是________ ,它之所以极易溶于水是因为它的分子和水分子之间形成________ ;
(7)CO的结构可表示为O C,与CO结构最相似的分子是
C,与CO结构最相似的分子是________ ,这两种结构相似的分子中,分子的极性________ (填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________ 。
| 目前空气的成分 | N2、O2、CO2、水蒸气及稀有气体(如He、Ne等) |
| 原始大气的主要成分 | CH4、NH3、CO、CO2等 |
(1)含有10个电子的分子有(填化学式,下同)
(2)由极性键构成的非极性分子有
(3)与H+可直接形成配位键的分子有
(4)沸点最高的物质是
(5)分子中不含孤电子对的分子(稀有气体除外)有
(6)极易溶于水、且水溶液呈碱性的物质的分子是
(7)CO的结构可表示为O
 C,与CO结构最相似的分子是
C,与CO结构最相似的分子是
您最近一年使用:0次
2019-06-15更新
|
186次组卷
|
9卷引用:吉林省乾安县第七中学2018-2019学年高二下学期第一次质量检测化学试题
吉林省乾安县第七中学2018-2019学年高二下学期第一次质量检测化学试题云南省河口县一中2018-2019学年高二上学期期中考试化学试题贵州省剑河县第二高级中学2018-2019学年高二上学期12月份考试化学试题云南省元江民族中学2018-2019学年高二下学期5月月考化学试题鲁科版2019选择性必修2第2章综合检测卷云南省红河县一中2020-2021学年高二下学期6月份考试化学试题云南省宣威市第三中学2021-2022学年高二下学期3月份考试化学试题福建省建瓯市芝华中学2021-2022学年高二下学期第一次阶段考化学试题贵州省凯里学院附属中学2021-2022学年高二下学期3月月考化学试题
10 . 已知N、P同属于元素周期表的第ⅤA族元素,N在第二周期,P在第三周期。NH3分子呈三角锥形,N原子位于锥顶,3个H原子位于锥底,N—H键间的夹角是107°。
(1)PH3分子与NH3分子的立体构型______ (填 “相似”或“不相似”),P—H键____ (填“有”或“无”)极性,PH3分子____ (填“有”或“无”)极性。
(2)NH3与PH3相比,热稳定性更强的是____ (填化学式)。
(3)NH3、PH3在常温、常压下都是气体,NH3比PH3易液化,其主要原因是_______ 。
A.键的极性:N—H比P—H强
B.分子的极性:NH3比PH3强
C.相对分子质量:PH3比NH3大
D.NH3分子之间存在特殊的分子间作用力
(1)PH3分子与NH3分子的立体构型
(2)NH3与PH3相比,热稳定性更强的是
(3)NH3、PH3在常温、常压下都是气体,NH3比PH3易液化,其主要原因是
A.键的极性:N—H比P—H强
B.分子的极性:NH3比PH3强
C.相对分子质量:PH3比NH3大
D.NH3分子之间存在特殊的分子间作用力
您最近一年使用:0次
2019-05-02更新
|
145次组卷
|
4卷引用:吉林省汪清县第六中学2018-2019学年高二下学期期中考试化学试题



