名校
1 . 根据元素周期表中短周期的下列内容,用对应的化学符号回答问题:
(1)元素①~⑨形成的单质中,化学性质最稳定的是_______ 。④在元素周期表中的位置是_______
(2)③、⑨和H元素可形成一种常见的盐,其电子式为_______ ,其中存在的化学键类型_______ ③形成的10电子氢化物沸点高于同主族其它元素氢化物的原因_______ 。
(3)⑧、⑨元素最高价氧化物对应的水化物中,酸性最强的是_______ 。
(4)写出一个可证明②和⑦非金属性强弱的离子方程式_______ 。
(5)单质②与⑧对应的最高价氧化物的水化物的浓溶液反应的化学方程式_______ 。
| H | ① | ||||||
| ② | ③ | O | ④ | ||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(2)③、⑨和H元素可形成一种常见的盐,其电子式为
(3)⑧、⑨元素最高价氧化物对应的水化物中,酸性最强的是
(4)写出一个可证明②和⑦非金属性强弱的离子方程式
(5)单质②与⑧对应的最高价氧化物的水化物的浓溶液反应的化学方程式
您最近一年使用:0次
解题方法
2 . 下列说法中正确的是
| A.互为手性异构体的分子互为镜像,且分子组成相同,性质也相同 |
| B.由酸性 FCH2COOH>CH3COOH,可知酸性 ClCH2COOH>CH3COOH |
| C.由 AgCl 和 AgBr 都能溶于氨水中,而 AgI 不能溶解在氨水中,可知 AgI 在水中的溶解度最大 |
| D.除 HF 外,其他卤化氢沸点随着相对分子质量的增大而升高,是因为氢键的键能逐渐增大所致 |
您最近一年使用:0次
3 . 下列说法正确的是
| A.HF、HCl、HBr、HI 的熔点、沸点依次升高 |
| B.乙醇分子与水分子之间只存在范德华力 |
| C.H2O 的熔点、沸点高于 H2S,是由于 H2O 分子之间可以形成氢键 |
| D.氯的各种含氧酸的酸性由强到弱排列为 HClO>HClO2>HClO3>HClO4 |
您最近一年使用:0次
名校
解题方法
4 . 若不断地升高温度,实现"雪花→水→水蒸气→氧气和氢气"的变化。在变化的各阶段被破坏的粒子间主要的相互作用依次是
| A.氢键;分子间作用力;非极性键 | B.氢键;氢键;极性键 |
| C.氢键;极性键;分子间作用力 | D.分子间作用力;氢键;非极性键 |
您最近一年使用:0次
2022-09-15更新
|
833次组卷
|
25卷引用:四川省南充市嘉陵第一中学2021-2022学年高二上学期第二次月考化学试题
四川省南充市嘉陵第一中学2021-2022学年高二上学期第二次月考化学试题四川省乐山沫若中学2020-2021学年高二上学期第一次月考化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第三节 分子结构与物质的性质 课时2 分子间的作用力(已下线)2.4 分子间作用力-2020-2021学年高二化学课时同步练(鲁科2019选择性必修2) 湖北省黄冈市麻城市实验高级中学2020-2021学年高二3月月考化学试题山东省滕州市第一中学2020-2021学年高二下学期3月份阶段检测化学试题(已下线)考点34 分子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)四川省成都高新实验中学2023-2024学年高二下学期3月月考化学试卷四川省富顺一中2023-2024学年高二下学期第一次月考化学试题2015-2016学年河南省三门峡市灵宝一中高二下第一次月考化学试卷2020届高三化学二轮物质结构题型专攻——分子的性质【选择基础专练】(已下线)上海市建平中学2013届高三第一次模拟化学试题安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题甘肃省武威市第十八中学2019-2020学年高二下学期期末考试化学试题江苏省东台创新高级中学2019-2020学年高二下学期4月份月检测化学试题宁夏海原第一中学2021届高三上学期第二次月考化学试题湖南省益阳市箴言中学2021-2022学年高二下学期入学考试化学检测题重庆市万州第二高级中学2021-2022学年高二下学期期中考试化学试题河南省驻马店市环际大联考2021-2022学年高二下学期期中考试化学试题(已下线)考点47 分子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题14 分子结构与性质-2023年高考化学一轮复习小题多维练(全国通用)第二章分子结构与性质(基础卷)宁夏吴忠市吴忠中学2022-2023学年高三上学期阶段性测试 化学试题2.4分子间作用力(课前)-鲁科版选择性必修2新疆阿克苏市实验中学2022-2023学年高二下学期第二次月考化学试题
5 . 下列说法不正确的是
| A.氢键是一种化学键,它的作用力比范德华力大 |
| B.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子化学性质不相似 |
| C.如果22Ti电子排布式为1s22s22p63s23p10,则违反了泡利原理 |
| D.同周期从左到右,元素的I1有增大的趋势,且每个周期的稀有气体的I1最大 |
您最近一年使用:0次
解题方法
6 . N、P、As及其化合物在工农业生产中用途非常广泛。回答下列问题:
(1)写出基态N原子的核外电子排布式___________ , 与N同周期的主族元素中,第一电离能比N大的元素是___________ (填元素符号) 。
(2)NH3是制造HNO3、化肥、炸药的重要原料,还可用于制冷。NH3的立体构型为___________ , 在工业合成NH3 (N2 + 3H2 2NH3)的反应所涉及的3种物质中,沸点从高到低的顺序为
2NH3)的反应所涉及的3种物质中,沸点从高到低的顺序为___________ , 原因是___________ 。
(3)H3PO2是一种重要的化工原料。已知:无机含氧酸分子中非羟基氧越多,酸性越强。1个非羟基氧是中强酸,2个非羟基氧是强酸。如H3PO4为中强酸,其结构简式为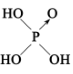 ;H3PO2也是一种中强酸,则H3PO2的结构简式为
;H3PO2也是一种中强酸,则H3PO2的结构简式为___________ ,写出H3PO2与足量NaOH溶液反应的化学方程式____________ 。
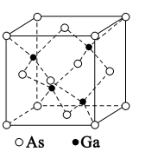
(4)GaAs 的熔点为1 238 °C,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为___________ 。已知:阿伏加德罗常数的值为NA,GaAs的摩尔质量为145g·mol-1,则GaAs的晶胞边长为___________ pm。
(1)写出基态N原子的核外电子排布式
(2)NH3是制造HNO3、化肥、炸药的重要原料,还可用于制冷。NH3的立体构型为
 2NH3)的反应所涉及的3种物质中,沸点从高到低的顺序为
2NH3)的反应所涉及的3种物质中,沸点从高到低的顺序为(3)H3PO2是一种重要的化工原料。已知:无机含氧酸分子中非羟基氧越多,酸性越强。1个非羟基氧是中强酸,2个非羟基氧是强酸。如H3PO4为中强酸,其结构简式为
 ;H3PO2也是一种中强酸,则H3PO2的结构简式为
;H3PO2也是一种中强酸,则H3PO2的结构简式为(4)GaAs 的熔点为1 238 °C,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为

您最近一年使用:0次
名校
7 . 正硼酸( )是一种片层状结构的白色晶体,层内
)是一种片层状结构的白色晶体,层内 分子之间通过氢键相连(层状结构如图所示,图中“虚线”表示氢键)。下列有关说法正确的是
分子之间通过氢键相连(层状结构如图所示,图中“虚线”表示氢键)。下列有关说法正确的是

 )是一种片层状结构的白色晶体,层内
)是一种片层状结构的白色晶体,层内 分子之间通过氢键相连(层状结构如图所示,图中“虚线”表示氢键)。下列有关说法正确的是
分子之间通过氢键相连(层状结构如图所示,图中“虚线”表示氢键)。下列有关说法正确的是
A.含 的晶体中有6mol氢键 的晶体中有6mol氢键 |
B.分子中硼原子、氧原子最外层均为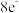 的稳定结构 的稳定结构 |
| C.正硼酸晶体属于共价晶体 |
D. 分子的稳定性与氢键无关 分子的稳定性与氢键无关 |
您最近一年使用:0次
2022-04-13更新
|
399次组卷
|
4卷引用:四川省巴中市平昌县博雅学校2021-2022学年高二上学期第二次月考化学试题
名校
8 . 将汽车尾气中含有的CO利用不仅能有效利用资源,还能防治空气污染。工业上常用CO与H2在由Al、Zn、Cu等元素形成的催化剂作用下合成甲醇。
(1)如图是某同学画出CO分子中氧原子的核外电子排布图,请判断该排布图:___ (填“正确”或“错误”),理由是___ (若判断正确,该空不用回答)。

(2)基态Fe2+的价电子排布式为___ ;Ti原子核外共有___ 种运动状态不同的电子。
(3)在硼、氧、氟、氮中第一电离能由大到小的顺序是(用元素符号表示)___ 。
(4)元素X与铁同周期,X元素原子核外未成对电子数最多,X为___ (填元素符号)X的基态原子的电子排布式为___ 。
(5)乙醇的沸点明显高于乙醛,其主要原因为____ 。
(6)Fe(CO)x的核外电子数之和为96,则x=___ 。
(1)如图是某同学画出CO分子中氧原子的核外电子排布图,请判断该排布图:

(2)基态Fe2+的价电子排布式为
(3)在硼、氧、氟、氮中第一电离能由大到小的顺序是(用元素符号表示)
(4)元素X与铁同周期,X元素原子核外未成对电子数最多,X为
(5)乙醇的沸点明显高于乙醛,其主要原因为
(6)Fe(CO)x的核外电子数之和为96,则x=
您最近一年使用:0次
名校
9 . 2020年10月,中国载人深潜器“奋斗者”号在马里亚纳海沟成功下潜突破1万米,“奋斗者”号选择了中国自主研发的全新高强高韧钛合金作为外壳材料,金属钛可用钙钛矿冶炼。请回答下列问题:
(1)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是_______ 。
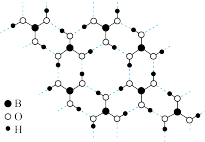
(2)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图所示,常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图。1mol硼酸(H3BO3)晶体中含有_______ mol氢键,从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:_______ 。
(3)钙钛矿(CaTiO3)的晶胞有A型和B型,将A型晶胞体心的Ti4+移至原点可得到B型晶胞。
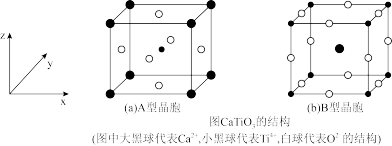
①钛酸钙其中Ti4+的核外电子排布式为_______ ;钛酸钙中两种阳离子中半径较大的是_______ 。若某B型钙钛矿的晶胞密度为ρg/cm3,NA为阿伏加德罗常数的值,晶胞中氧离子之间的最短距离为_______ pm(用含ρ和NA的代数式表示)。
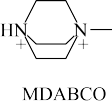
②某有机钙钛矿MDABCO-NH4I3具有A型钛酸钙晶胞结构。MDABCO的结构如图所示,则MDABCO所含元素电负性由大到小为_______ ,N原子的杂化轨道类型为_______ 。若在MDABCO-NH4I3的晶胞中MDABCO的分数坐标为(0,0,0), 的一种分数坐标为
的一种分数坐标为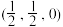 ,则
,则 的分数坐标为
的分数坐标为_______ ,与MDABCO距离最近的 有
有_______ 个。
(1)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 |  24.12 24.12 | 38.3 | 155 |

(3)钙钛矿(CaTiO3)的晶胞有A型和B型,将A型晶胞体心的Ti4+移至原点可得到B型晶胞。

①钛酸钙其中Ti4+的核外电子排布式为
②某有机钙钛矿MDABCO-NH4I3具有A型钛酸钙晶胞结构。MDABCO的结构如图所示,则MDABCO所含元素电负性由大到小为
 的一种分数坐标为
的一种分数坐标为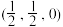 ,则
,则 的分数坐标为
的分数坐标为 有
有
您最近一年使用:0次
名校
10 . 金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态镍原子价电子排布式为___________ 。
(2)丁二酮肟( )是检验Ni2+的灵敏试剂,常与Ni2+形成图I所示的配合物,图II是硫代氧的结果:
)是检验Ni2+的灵敏试剂,常与Ni2+形成图I所示的配合物,图II是硫代氧的结果:
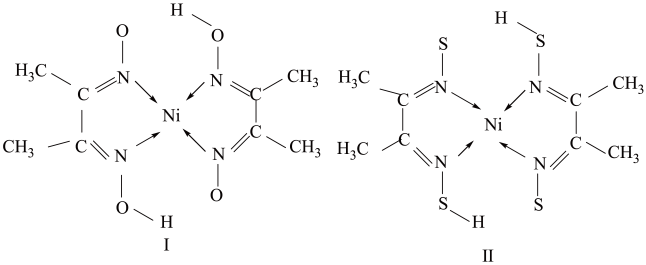
①下列说法正确的有___________ (填字母)。
A.在I中N元素的电负性最大 B.在I中C-C-C键角是180°
C.在II中-SH 上的S原子采取sp3杂化 D.在II中存在σ键、Π键与配位键
②化合物I的熔、沸点高于化合物II的原因是___________ 。
(3)工业上选用硫酸和硝酸的混酸与Ni反应制备NiSO4。写出与SO 互为等电子体的一种分子
互为等电子体的一种分子___________ 。Fe、Co、Ni三种元素二价离子的硫酸盐晶体的晶胞类型相同,其熔点由高到低的顺序为___________ 。
(4)Ni和La的合金是目前使用广泛的储氢材料。该合金的晶胞结构如图所示。
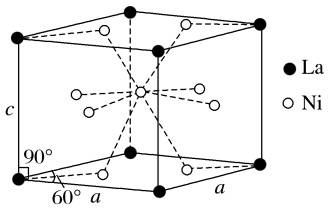
①设该合金的密度为dg/cm3,则该晶胞的体积为___________ cm3(用含 d的代数式表示,NA表示阿伏加德罗常数的值)
②该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子时比较稳定。已知:a=500pm,c=400pm;标准状况下氢气的密度为9.00×10-5g/cm3; 储氢能力= 。若忽略储氢前后晶胞的体积变化,则该合金的储氢能力为
。若忽略储氢前后晶胞的体积变化,则该合金的储氢能力为___________ (列出最简计算式,计算式不使用小数。NA表示阿伏加德罗常数的值)。
(1)基态镍原子价电子排布式为
(2)丁二酮肟(
 )是检验Ni2+的灵敏试剂,常与Ni2+形成图I所示的配合物,图II是硫代氧的结果:
)是检验Ni2+的灵敏试剂,常与Ni2+形成图I所示的配合物,图II是硫代氧的结果:
①下列说法正确的有
A.在I中N元素的电负性最大 B.在I中C-C-C键角是180°
C.在II中-SH 上的S原子采取sp3杂化 D.在II中存在σ键、Π键与配位键
②化合物I的熔、沸点高于化合物II的原因是
(3)工业上选用硫酸和硝酸的混酸与Ni反应制备NiSO4。写出与SO
 互为等电子体的一种分子
互为等电子体的一种分子(4)Ni和La的合金是目前使用广泛的储氢材料。该合金的晶胞结构如图所示。

①设该合金的密度为dg/cm3,则该晶胞的体积为
②该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子时比较稳定。已知:a=500pm,c=400pm;标准状况下氢气的密度为9.00×10-5g/cm3; 储氢能力=
 。若忽略储氢前后晶胞的体积变化,则该合金的储氢能力为
。若忽略储氢前后晶胞的体积变化,则该合金的储氢能力为
您最近一年使用:0次



