解题方法
1 . 甲硫氨酸是构成人体的必需氨基酸之一,结构简式如图所示。下列有关说法正确的是
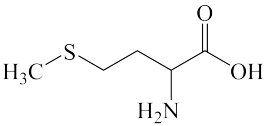

| A.第一电离能:O>N>C>H |
| B.基态氧原子的电子有8种空间运动状态 |
| C.甲硫氨酸分子中碳原子的杂化类型有sp2和sp3 |
| D.甲硫氨酸分子间不能形成氢键 |
您最近一年使用:0次
12-13高二上·四川遂宁·期中
名校
解题方法
2 . 下列说法错误的是
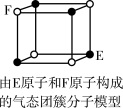
A.从CH4、 、 、 为正四面体结构,可推测PH 为正四面体结构,可推测PH 、 、 也为正四面体结构 也为正四面体结构 |
| B.1mol金刚石晶体中,平均含有2molC-C键 |
| C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键 |
| D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE |
您最近一年使用:0次
2022-10-31更新
|
245次组卷
|
8卷引用:吉林省汪清县汪清四中2020-2021学年高二下学期期末考试化学试题
名校
解题方法
3 . 如图所示的两种化合物可应用于阻燃材料和生物材料的合成。其中W、X、Y、Z为原子序数依次增大的短周期元素,X和Z同主族,Y原子序数为W原子最外层电子数的3倍。下列说法不正确 的是




| A.HX的沸点高于HZ的沸点 |
| B.X和Z的最高化合价均为+7价 |
| C.四种元素中,Y原子半径最大,X原子半径最小 |
| D.Z、W和氢三种元素可形成能促进水电离得离子化合物 |
您最近一年使用:0次
2021-11-30更新
|
536次组卷
|
3卷引用:吉林省东北师范大学附属中学2021-2022学年高三上学期一模考试化学试题
吉林省东北师范大学附属中学2021-2022学年高三上学期一模考试化学试题(已下线)解密05 物质结构 元素周期律(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)福建省南平高级中学2021-2022学年高三上学期12月月考化学试题
名校
解题方法
4 . 下图是一种阴离子的结构式,该阴离子是由同周期元素X、Y、Z、R构成,Y是构成物质种类最多的元素,Z的最外层电子数等于Y的核外电子数,四种元素的最外层电子数之和为20.下列说法正确的是


| A.R的简单氢化物沸点比Y的简单氢化物高 |
| B.Y与Z形成的化合物不可能有毒 |
| C.四种元素的原子半径:R>Z>Y>X |
| D.化合物XR3中,各原子最外层均为8电子稳定结构 |
您最近一年使用:0次
解题方法
5 . 下列描述正确的是
| A.CO2为V形极性分子 |
| B.SiF4与CH4的中心原子均为sp3杂化 |
| C.C2H2分子中σ键与π键的数目比为1∶1 |
| D.水加热到很高温度都难分解是因水分子间存在氢键 |
您最近一年使用:0次
解题方法
6 . 下列现象与氢键有关的是
①HF的熔、沸点比ⅦA族其他元素氢化物的熔、沸点高 ②乙醇可以和水以任意比互溶 ③冰的密度比液态水的密度小 ④NH3比PH3稳定 ⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的熔、沸点低
①HF的熔、沸点比ⅦA族其他元素氢化物的熔、沸点高 ②乙醇可以和水以任意比互溶 ③冰的密度比液态水的密度小 ④NH3比PH3稳定 ⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的熔、沸点低
| A.②③④⑤ | B.①②③⑤ | C.①②③④ | D.①②③④⑤ |
您最近一年使用:0次
2021-07-20更新
|
116次组卷
|
2卷引用:吉林省通化县综合高级中学2020-2021学年高二下学期期末考试化学试题
名校
7 . 回答下列问题:
(1)符号“3px”没有给出的信息是___________
A.能层 B.能级 C.电子云在空间的伸展方向 D.电子的自旋方向
(2)下列实验事实不能用氢键来解释的是___________
A.CH4比SiH4稳定
B.乙醇能与水以任意比互溶
C.邻羟基苯甲醛的沸点低于对羟基苯甲醛
D.接近沸点的水蒸气的相对分子质量测量值大于18
E.冰的密度比液态水的密度小
(3)某元素基态原子4s轨道上有1个电子,则该元素基态原子价电子排布可能是___________
(4)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般d0或d10排布无颜色,d1~d9排布有颜色。如[Co(H2O)6]2+显粉红色。据此判断:[Mn(H2O)6]2+___________ (填“无”或“有”)颜色。
(5)过渡金属易与CO形成羰基配合物,如Ni(CO)4、Fe(CO)5等,配合物[Ni(CO)4]常温下为液态,易溶于CCl4、苯等有机溶剂。则 [Ni(CO)4]固态时属于___________ 分子(填极性或非极性)。
(1)符号“3px”没有给出的信息是
A.能层 B.能级 C.电子云在空间的伸展方向 D.电子的自旋方向
(2)下列实验事实不能用氢键来解释的是
A.CH4比SiH4稳定
B.乙醇能与水以任意比互溶
C.邻羟基苯甲醛的沸点低于对羟基苯甲醛
D.接近沸点的水蒸气的相对分子质量测量值大于18
E.冰的密度比液态水的密度小
(3)某元素基态原子4s轨道上有1个电子,则该元素基态原子价电子排布可能是
(4)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般d0或d10排布无颜色,d1~d9排布有颜色。如[Co(H2O)6]2+显粉红色。据此判断:[Mn(H2O)6]2+
(5)过渡金属易与CO形成羰基配合物,如Ni(CO)4、Fe(CO)5等,配合物[Ni(CO)4]常温下为液态,易溶于CCl4、苯等有机溶剂。则 [Ni(CO)4]固态时属于
您最近一年使用:0次
8 . 下列说法不正确的是
| A.HCl、HBr、HI的熔、沸点依次升高与分子间作用力大小有关 |
| B.标准状况下,NA个HF分子约为22.4L |
| C.I2易溶于CCl4可以用相似相溶原理解释 |
| D.NH3分子间存在氢键,故氨气易液化 |
您最近一年使用:0次
2021-06-18更新
|
273次组卷
|
5卷引用:吉林省松原市乾安七中2020-2021学年高二下学期第七次质量检测化学试题
吉林省松原市乾安七中2020-2021学年高二下学期第七次质量检测化学试题(已下线)考点08 分子间作用力 氢键-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点08 微粒间作用力-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第2.3.2讲 分子间作用力 分子的手性-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)(已下线)考点08 微粒间相互作用力-备战2023年高考化学一轮复习考点帮(全国通用)
9 . 下列说法都正确的是
①CO和N2互为等电子体,且前者沸点低于后者;
②CH3-CH2-CH2-CH3和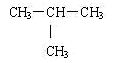 互为同分异构体,且前者熔沸点高于后者;
互为同分异构体,且前者熔沸点高于后者;
③BF3和NH3化学键的类型和分子的极性皆相同;
④F的电负性大于O,但H2O的熔沸点比HF高;
⑤CsCl晶格能小于NaCl;
⑥简单立方堆积和面心立方堆积是由非密置层堆积形成的;
①CO和N2互为等电子体,且前者沸点低于后者;
②CH3-CH2-CH2-CH3和
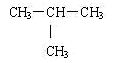 互为同分异构体,且前者熔沸点高于后者;
互为同分异构体,且前者熔沸点高于后者;③BF3和NH3化学键的类型和分子的极性皆相同;
④F的电负性大于O,但H2O的熔沸点比HF高;
⑤CsCl晶格能小于NaCl;
⑥简单立方堆积和面心立方堆积是由非密置层堆积形成的;
| A.①④⑥ | B.③④⑤ | C.②④⑤ | D.②④⑥ |
您最近一年使用:0次
10 . 过渡金属元素铬 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(1)对于基态Cr原子,下列叙述正确的是_______ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B.4s轨道上电子能量较高,总是在比3s轨道上电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是_______ ,中心离子的配位数为_______ 。
(3) 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如图所示。
的空间结构和相应的键角如图所示。
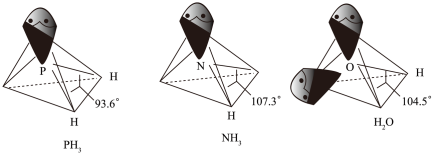
 中P的杂化类型是
中P的杂化类型是_______ 。 的沸点比
的沸点比 的
的_______ ,原因是_______ , 的键角小于
的键角小于 的,分析原因
的,分析原因_______ 。
(4)在金属材料中添加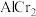 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。
颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。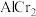 具有体心四方结构,如图所示,处于顶角位置的是
具有体心四方结构,如图所示,处于顶角位置的是_______ 原子。设Cr和Al原子半径分别为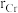 和
和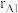 ,则金属原子空间占有率为
,则金属原子空间占有率为_______ %(列出计算表达式)。

 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:(1)对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为

B.4s轨道上电子能量较高,总是在比3s轨道上电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。
 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是(3)
 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如图所示。
的空间结构和相应的键角如图所示。
 中P的杂化类型是
中P的杂化类型是 的沸点比
的沸点比 的
的 的键角小于
的键角小于 的,分析原因
的,分析原因(4)在金属材料中添加
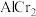 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。
颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。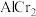 具有体心四方结构,如图所示,处于顶角位置的是
具有体心四方结构,如图所示,处于顶角位置的是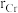 和
和 ,则金属原子空间占有率为
,则金属原子空间占有率为
您最近一年使用:0次
2021-06-09更新
|
20281次组卷
|
19卷引用:吉林省长春外国语学校2020-2021学年高二下学期第二次月考化学试题
吉林省长春外国语学校2020-2021学年高二下学期第二次月考化学试题吉林省汪清县汪清四中2020-2021学年高二下学期期末考试化学试题2021年高考全国乙卷化学真题(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)(已下线)2021年高考全国乙卷化学试题变式题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题19 物质结构与性质-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)新疆柯坪县柯坪湖州国庆中学2021-2022学年高二下学期期末考试化学试题广东省茂名市电白区2021-2022学年高二下学期期中(选择性)考试化学试题(已下线)专题02 物质结构专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)广东省广州市真光中学2022-2023学年高二下学期期中考试化学试题(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)



