名校
解题方法
1 . 某种锂电池中电解质的结构如图所示,已知短周期主族元素X、Y、Z、M和W的原子序数依次增大,且0.1mol/L的XW水溶液呈酸性且pH>1。下列说法正确的是
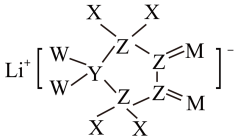
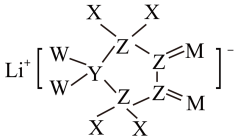
| A.元素的非金属性:X>Z |
| B.简单氢化物的沸点:M>Z |
| C.简单离子半径:W>M |
| D.Li2ZM3为弱电解质 |
您最近一年使用:0次
解题方法
2 . Fe、Mg、Co、Ni与稀土元素钇(39Y)在工农业生产、军事、航空航天、能源、环境保护、生物医学等领域中应用广泛。回答下列问题:
(1)Y在元素周期表中的位置___________ ,基态Co原子价电子排布式为___________ 。
(2)纳米Fe因其表面活性常用作有机催化剂,如图所示:

①化合物M的熔沸点低于化合物N,其主要原因是___________ 。
②化合物N中除苯环外其他C原子的杂化类型为___________ ,元素C、N、O的第一电离能由小到大的顺序为___________ 。
(3)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为___ 晶体,与配体互为等电子体的阴离子___________ 。(任意写一种)。
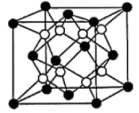
(4)由Mg、C和Ni组成的新型超导材料晶体的立方晶胞结构如图所示:

①该新型超导材料的化学式为___________ 。
②若晶胞参数为a nm,阿伏加德罗常数的值为NA,则该晶体的密度为___________ 
(1)Y在元素周期表中的位置
(2)纳米Fe因其表面活性常用作有机催化剂,如图所示:

①化合物M的熔沸点低于化合物N,其主要原因是
②化合物N中除苯环外其他C原子的杂化类型为
(3)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为
(4)由Mg、C和Ni组成的新型超导材料晶体的立方晶胞结构如图所示:

①该新型超导材料的化学式为
②若晶胞参数为a nm,阿伏加德罗常数的值为NA,则该晶体的密度为

您最近一年使用:0次
名校
解题方法
3 . 醋酸可以通过分子间氢键双聚。一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如下图所示,有关说法正确的是


| A.a、b、c三点溶液用1 mol·L-1氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a>b>c |
| B.a、b、c三点溶液的pH:a>b>c |
| C.若用湿润的pH试纸测定c处溶液的pH,比实际pH偏小 |
D.若在“O”点醋酸双聚成八元环分子,则其结构为 |
您最近一年使用:0次
名校
4 . 化合物甲是一种重要的医药中间体,其结构式如图所示。其中Q、W、X、Y、Z为原子半径依次递增的短周期元素,Q、X、Z分列于三个不同周期。下列说法错误的是
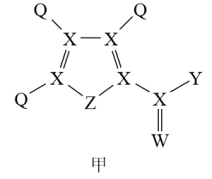

| A.非金属性:X<Z<W |
| B.Q与W形成最简单化合物的沸点高于Q与X形成化合物的沸点 |
| C.化合物甲中除Q外,其它原子均满足8电子稳定结构 |
| D.相同浓度的最高价氧化物对应水化物的酸性:Y>Z |
您最近一年使用:0次
2021-12-14更新
|
459次组卷
|
8卷引用:广东省韶关市北江中等职业学校等九校 2021-2022学年高三上学期11月联考化学试题
解题方法
5 . 镍及其化合物用途广泛,可用作催化剂、合金、电器元件等。回答下列问题:
(1)基态 原子价电子的轨道表示式为
原子价电子的轨道表示式为___________ 。
(2) 是制取镍盐、碱性蓄电池的原料。
是制取镍盐、碱性蓄电池的原料。 与异乙腈(
与异乙腈( )可发生生成单质镍的配合物:
)可发生生成单质镍的配合物: 。
。 (结构简式为
(结构简式为 )分子中碳原子的杂化方式为
)分子中碳原子的杂化方式为___________ ;设 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则 中σ键的数目为
中σ键的数目为___________ 。
(3) 常温下呈液态,其空间构型为正四面体。解释其易溶于
常温下呈液态,其空间构型为正四面体。解释其易溶于 、苯等有机溶剂的原因:
、苯等有机溶剂的原因:___________ 。
(4)在镍的催化作用下,3-甲基呋喃与氨在高温下反应得到3-甲基吡咯。

①C、N、O的第一电离能由大到小顺序为___________ 。
②3-甲基吡咯的熔、沸点高于3-甲基呋喃的原因是___________ 。
(5)镍的氧化物也常用作催化剂, 的晶胞结构如图所示,其中阴离子采用面心立方最密堆积方式,则该晶体的密度为
的晶胞结构如图所示,其中阴离子采用面心立方最密堆积方式,则该晶体的密度为___________ 
___________ nm。

(1)基态
 原子价电子的轨道表示式为
原子价电子的轨道表示式为(2)
 是制取镍盐、碱性蓄电池的原料。
是制取镍盐、碱性蓄电池的原料。 与异乙腈(
与异乙腈( )可发生生成单质镍的配合物:
)可发生生成单质镍的配合物: 。
。 (结构简式为
(结构简式为 )分子中碳原子的杂化方式为
)分子中碳原子的杂化方式为 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则 中σ键的数目为
中σ键的数目为(3)
 常温下呈液态,其空间构型为正四面体。解释其易溶于
常温下呈液态,其空间构型为正四面体。解释其易溶于 、苯等有机溶剂的原因:
、苯等有机溶剂的原因:(4)在镍的催化作用下,3-甲基呋喃与氨在高温下反应得到3-甲基吡咯。

①C、N、O的第一电离能由大到小顺序为
②3-甲基吡咯的熔、沸点高于3-甲基呋喃的原因是
(5)镍的氧化物也常用作催化剂,
 的晶胞结构如图所示,其中阴离子采用面心立方最密堆积方式,则该晶体的密度为
的晶胞结构如图所示,其中阴离子采用面心立方最密堆积方式,则该晶体的密度为

您最近一年使用:0次
6 . 2019年诺贝尔化学奖颁发给古迪纳夫等三位科学家,以表彰他们对锂电池研发的贡献。锂电池的种类繁多,电极材料用了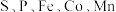 等元素组成的化合物。请回答下列问题:
等元素组成的化合物。请回答下列问题:
(1)请列举一个Li元素可用于研发手机电池的优势:_______ 。
(2)Mn原子的核外电子排布式为_______ 。
(3)Fe、Co都位于元素周期表第_______ 族,第四电离能I4(Fe)>I4(Co),请解释原因:_______ 。
(4) 是锂电池中常用的电极材料,
是锂电池中常用的电极材料, 的中心原子杂化方式是
的中心原子杂化方式是_______ 杂化,其空间构型为_______ 。
(5)锂硫电池在放电过程中会生成Li2S2,其阴、阳离子的数目之比为_______ 。
(6)S与O、Se、Te位于同一主族,它们的简单氢化物沸点由高到低为_______ 。
(7)硫化锂(Li2S)晶体是开发先进锂电池的关键材料,其晶胞结构如图所示。已知晶胞的边长为a nm,NA为阿伏加德罗常数的值,则晶胞的密度为_______  。
。
 等元素组成的化合物。请回答下列问题:
等元素组成的化合物。请回答下列问题:(1)请列举一个Li元素可用于研发手机电池的优势:
(2)Mn原子的核外电子排布式为
(3)Fe、Co都位于元素周期表第
(4)
 是锂电池中常用的电极材料,
是锂电池中常用的电极材料, 的中心原子杂化方式是
的中心原子杂化方式是(5)锂硫电池在放电过程中会生成Li2S2,其阴、阳离子的数目之比为
(6)S与O、Se、Te位于同一主族,它们的简单氢化物沸点由高到低为
(7)硫化锂(Li2S)晶体是开发先进锂电池的关键材料,其晶胞结构如图所示。已知晶胞的边长为a nm,NA为阿伏加德罗常数的值,则晶胞的密度为
 。
。
您最近一年使用:0次
7 . 镍、铁合金及其化合物用途广泛。回答下列问题:
(1)基态Fe3+与Ni2+中未成对的电子数之比为___________ 。
(2)Ni-NTA-Nangold可用于检测或定位6x组氨酸(His)或Poly-His标记的重组蛋白。Ni(Ⅱ)—NTA的结构简式如图所示。
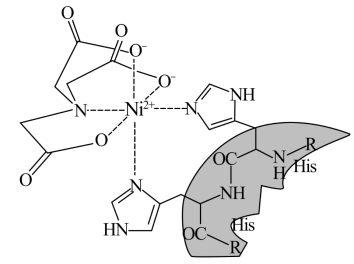
①配合物中向Ni2+提供电子对的原子是___________ 。
②配体N(CH2COO-)3中4种元素的电负性从大到小的顺序为___________ (用元素符号表示)。三乙酸胺[N(CH2COOH)3]与三正丁胺[N(CH2CH2CH2CH3)3]的相对分子质量相近,但三乙酸胺的熔点(167℃)、沸点(246℃)分别高于三正丁胺的熔点(-70℃)、沸点(216.5℃),原因是___________ 。
③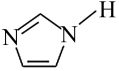 的空间结构与苯类似,N的杂化类型为
的空间结构与苯类似,N的杂化类型为___________ 。
(3)铁磁DMS被认为是自选电子应用的可行和关键材料。镍掺杂的稀磁半导体的立方晶胞(晶胞参数为a)结构如图所示。
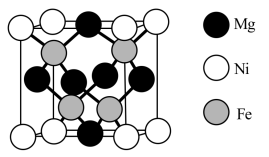
①晶体中与每个Ni紧邻且等距离的Fe有___________ 个。
②设Mg、Ni和Fe的原子半径分别为rMg、rNi和rFe,则该晶胞中金属原子的空间占有率为___________ %(列出计算表达式)。
(1)基态Fe3+与Ni2+中未成对的电子数之比为
(2)Ni-NTA-Nangold可用于检测或定位6x组氨酸(His)或Poly-His标记的重组蛋白。Ni(Ⅱ)—NTA的结构简式如图所示。

①配合物中向Ni2+提供电子对的原子是
②配体N(CH2COO-)3中4种元素的电负性从大到小的顺序为
③
 的空间结构与苯类似,N的杂化类型为
的空间结构与苯类似,N的杂化类型为(3)铁磁DMS被认为是自选电子应用的可行和关键材料。镍掺杂的稀磁半导体的立方晶胞(晶胞参数为a)结构如图所示。

①晶体中与每个Ni紧邻且等距离的Fe有
②设Mg、Ni和Fe的原子半径分别为rMg、rNi和rFe,则该晶胞中金属原子的空间占有率为
您最近一年使用:0次
名校
8 . 化学工业为新冠疫情防控提供了强有力的物质支撑。科学家利用原子序数依次增大的四种短周期元素X、Y、Z和W“组合”成一种高效、贮运稳定的消毒漂白剂,其分子结构示意图如下,W原子的L层电子数比Z原子的L层电子数多2个。下列说法正确的是
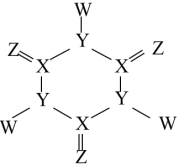

| A.简单离子半径:Y<Z |
| B.W和Y的氧化物对应的水化物均为强酸 |
| C.简单氢化物的沸点:X>Y |
| D.可用Y的简单氢化物检验输送W单质的管道是否泄漏 |
您最近一年使用:0次
2021-11-01更新
|
508次组卷
|
6卷引用:广东省肇庆市2021-2022学年高三上学期第一次统一检测化学试题
名校
9 . 磷和砷的相关化合物在化工、医药、材料等领域有着广泛应用。回答下列问题:
(1)红磷是巨型共价分子,无定形结构,下列方法能证明红磷是非晶体的是___________。
(2)第一电离能介于Al、P之间的第三周期元素有___________ 种。
(3)如图所示,每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________ 。

(4)黑磷是新型二维半导体材料,具有片层结构(如图所示),P在元素周期表分区中属于___________ 区,层与层之间的相互作用力为___________ 。

(5)N、P、As、Sb均是第ⅤA族的元素,As原子的逐级电离能数据如下:
第五电离能与第六电离能相差较大的原因:___________ 。
(1)红磷是巨型共价分子,无定形结构,下列方法能证明红磷是非晶体的是___________。
| A.质谱法 | B.原子发射光谱法 |
| C.核磁共振谱法 | D.X射线衍射法 |
(3)如图所示,每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是

(4)黑磷是新型二维半导体材料,具有片层结构(如图所示),P在元素周期表分区中属于

(5)N、P、As、Sb均是第ⅤA族的元素,As原子的逐级电离能数据如下:
| 第一电离能 | 第二电离能 | 第三电离能 | 第四电离能 | 第五电离能 | 第六电离能 |
| 947.0 | 1 798 | 2 735 | 4 837 | 6 043 | 12 310 |
第五电离能与第六电离能相差较大的原因:
您最近一年使用:0次
名校
解题方法
10 . 研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)元素Mn与O中,基态原子核外未成对电子数较多的是___________ 。
(2)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为___________ ,原因是___________ 。
(3)①H2O分子内O-H键、②分子间的范德华力、③氢键,从强到弱依次为___________ (用序号进行排序)。
(4)H2O2是一种无色液体,其结构如图所示。根据“相似相溶规则”,H2O2在水中的溶解度___________ (填“大于”、“小于”、“等于”)其在CCl4中的溶解度。

(5)基态Co原子的核外电子占据的最高能层符号为___________ , CO2分子中σ键与π键数目的比值为___________ 。
(1)元素Mn与O中,基态原子核外未成对电子数较多的是
(2)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为
(3)①H2O分子内O-H键、②分子间的范德华力、③氢键,从强到弱依次为
(4)H2O2是一种无色液体,其结构如图所示。根据“相似相溶规则”,H2O2在水中的溶解度

(5)基态Co原子的核外电子占据的最高能层符号为
您最近一年使用:0次
2021-10-27更新
|
414次组卷
|
3卷引用:广东省东莞市光明中学2021-2022学年高二上学期第一次月考化学试题
广东省东莞市光明中学2021-2022学年高二上学期第一次月考化学试题(已下线)2.3.2 分子间作用力 分子的手性-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)黑龙江省大庆市大庆中学2021-2022学年高二下学期期中考试化学试题



