解题方法
1 . 碳族元素中的碳、硅、锗及其化合物在诸多领域有重要用途。
(1)碳族元素位于周期表_______ 区,基态锗原子外围电子的轨道表示式为_______ ,基态锗原子核外有_______ 种空间运动状态不同的电子。
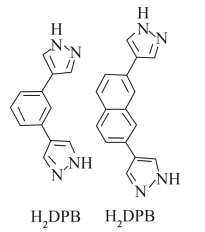
(2)科学家以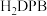 、
、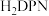 等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。
等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。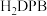 和
和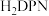 结构中含氮碳环均为平面结构,则N的杂化方式是
结构中含氮碳环均为平面结构,则N的杂化方式是_______ 。
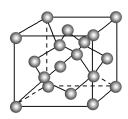
(3)金刚石(甲)、石墨(乙)、C60(丙)的结构如下图所示:
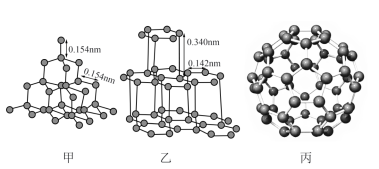
①12g金刚石和石墨中含有的σ键数目之比为_______ 。
②金刚石的熔点高于C60,但低于石墨,原因是_______ 。
③C60的晶胞呈分子密堆积,下列晶体中,与C60具有相同晶体结构的是_______ 。
A.CO2 B.冰 C.Zn D.Ag E.NaCl
(4)一种低温超导体立方晶胞结构如下图所示:
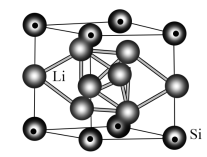
①该晶体的化学式为_______ 。
②若晶胞参数为apm,该晶体的密度ρ=_______  。(列出计算式即可,设NA表示阿伏加德罗常数的值)
。(列出计算式即可,设NA表示阿伏加德罗常数的值)
(1)碳族元素位于周期表
(2)科学家以
 、
、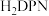 等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。
等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。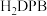 和
和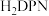 结构中含氮碳环均为平面结构,则N的杂化方式是
结构中含氮碳环均为平面结构,则N的杂化方式是
(3)金刚石(甲)、石墨(乙)、C60(丙)的结构如下图所示:

①12g金刚石和石墨中含有的σ键数目之比为
②金刚石的熔点高于C60,但低于石墨,原因是
③C60的晶胞呈分子密堆积,下列晶体中,与C60具有相同晶体结构的是
A.CO2 B.冰 C.Zn D.Ag E.NaCl
(4)一种低温超导体立方晶胞结构如下图所示:

①该晶体的化学式为
②若晶胞参数为apm,该晶体的密度ρ=
 。(列出计算式即可,设NA表示阿伏加德罗常数的值)
。(列出计算式即可,设NA表示阿伏加德罗常数的值)
您最近一年使用:0次
2 . 下列物质性质与用途不相应的是
| A.SO2具有漂白性,可用于纸浆漂白 |
| B.石墨具有良好的润滑性,可用作电池电极材料 |
| C.液氮的沸点较低,可为超导材料提供低温环境 |
| D.硫酸钡难溶于酸,可作为“胃镜”检查中的内服药剂 |
您最近一年使用:0次
名校
解题方法
3 . 砷(As)、镓(Ga)等形成的化合物在现代工业中有广泛的用途,其中砷化镓是一种重要的半导体材料,晶胞结构如图所示,其熔点为1238℃,以下说法正确的是


| A.一个晶胞中As原子的个数为4 |
| B.As的配位数是2 |
| C.砷化镓、砷化铝、砷化硼的熔沸点逐渐降低 |
| D.砷化镓晶体中每个原子均形成4个共价键 |
您最近一年使用:0次
2022-07-13更新
|
240次组卷
|
2卷引用:山东省德州市2021-2022学年高二下学期期末考试化学试题
4 . 常见晶体的结构分析
(1)金刚石晶体



①在晶体中每个碳原子以_______ 个共价单键与相邻的_______ 个碳原子相结合,成为正四面体。
②晶体中C-C-C夹角为_______ ,碳原子采取了_______ 杂化。
③最小环上有_______ 个碳原子。
④晶体中碳原子个数与C-C键数之比为_______ 。
⑤在一个晶胞中,碳原子位于立方体的8个顶点、6个面心以及晶胞内部,由“均摊法”可求出该晶胞中实际含有的碳原子数为_______ 。
(2)二氧化硅晶体

①每个硅原子与相邻的_______ 个氧原子以共价键相结合构成_______ 结构,硅原子在正四面体的中心,4个氧原子在正四面体的4个顶点。晶体中Si原子与O原子个数比为_______ 。
②每个Si原子与4个O原子成键,每个O原子与_______ 个Si原子成键,最小的环是_______ 元环。
③每个最小的环实际拥有的硅原子为_______ ,氧原子数为_______ 。
④1molSiO2晶体中含Si-O键数目为_______ ,在SiO2晶体中Si、O原子均采取_______ 杂化。
⑤SiO2具有许多重要用途,是制造水泥、玻璃、人造红宝石、单晶硅、硅光电池、芯片和光导纤维的原料。
(1)金刚石晶体



①在晶体中每个碳原子以
②晶体中C-C-C夹角为
③最小环上有
④晶体中碳原子个数与C-C键数之比为
⑤在一个晶胞中,碳原子位于立方体的8个顶点、6个面心以及晶胞内部,由“均摊法”可求出该晶胞中实际含有的碳原子数为
(2)二氧化硅晶体

①每个硅原子与相邻的
②每个Si原子与4个O原子成键,每个O原子与
③每个最小的环实际拥有的硅原子为
④1molSiO2晶体中含Si-O键数目为
⑤SiO2具有许多重要用途,是制造水泥、玻璃、人造红宝石、单晶硅、硅光电池、芯片和光导纤维的原料。
您最近一年使用:0次
名校
解题方法
5 . 碳族中的碳、硅、锗及其化合物在多领域有重要用途。
(1)基态 的电子排布式为
的电子排布式为___________ 。
(2)我国科学家研发的“液态阳光”计划是通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。 分子中存在
分子中存在___________ 个 键和
键和___________ 个 键,
键, 分子是
分子是___________ 分子(填“极性”或“非极性”)。
(3)关于 、
、 及其化合物的结构与性质,下列论述
及其化合物的结构与性质,下列论述不正确 的是___________。
(4) 与
与 -甲基咪唑(
-甲基咪唑(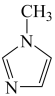 )反应可以得到
)反应可以得到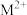 ,其结构如下图所示:
,其结构如下图所示:

 -甲基咪唑中碳原子的杂化轨道类型有
-甲基咪唑中碳原子的杂化轨道类型有___________ 。
(5)汞(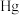 )、锗(
)、锗( )、锑(
)、锑(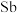 )形成的一种新物质
)形成的一种新物质 为潜在的拓扑绝缘体材料。
为潜在的拓扑绝缘体材料。 的晶体(晶胞为下图
的晶体(晶胞为下图 )可视为
)可视为 晶体(晶胞为下图
晶体(晶胞为下图 )中部分
)中部分 原子被
原子被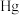 和
和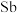 取代后形成。
取代后形成。
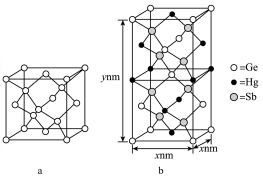
 的最简式的相对分子质量为
的最简式的相对分子质量为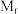 ,阿伏加德罗常数的数值为
,阿伏加德罗常数的数值为 ,则
,则 晶体的密度为
晶体的密度为___________  (列出计算式)。注:
(列出计算式)。注:
(1)基态
 的电子排布式为
的电子排布式为(2)我国科学家研发的“液态阳光”计划是通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。
 分子中存在
分子中存在 键和
键和 键,
键, 分子是
分子是(3)关于
 、
、 及其化合物的结构与性质,下列论述
及其化合物的结构与性质,下列论述A.键能 、 、 ,因此 ,因此 稳定性小于 稳定性小于 |
B. 是与金刚石结构相似的共价晶体,因此 是与金刚石结构相似的共价晶体,因此 具有较高的硬度 具有较高的硬度 |
C. 中 中 的化合价为 的化合价为 , , 中 中 的化合价为 的化合价为 ,因此 ,因此 还原性小于 还原性小于 |
D. 原子间难形成双键和三键而 原子间难形成双键和三键而 原子间可以,是因为 原子间可以,是因为 的原子半径大于 的原子半径大于 ,因此难以形成 ,因此难以形成 键 键 |
 与
与 -甲基咪唑(
-甲基咪唑( )反应可以得到
)反应可以得到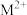 ,其结构如下图所示:
,其结构如下图所示:
 -甲基咪唑中碳原子的杂化轨道类型有
-甲基咪唑中碳原子的杂化轨道类型有(5)汞(
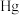 )、锗(
)、锗( )、锑(
)、锑(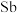 )形成的一种新物质
)形成的一种新物质 为潜在的拓扑绝缘体材料。
为潜在的拓扑绝缘体材料。 的晶体(晶胞为下图
的晶体(晶胞为下图 )可视为
)可视为 晶体(晶胞为下图
晶体(晶胞为下图 )中部分
)中部分 原子被
原子被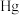 和
和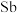 取代后形成。
取代后形成。
 的最简式的相对分子质量为
的最简式的相对分子质量为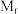 ,阿伏加德罗常数的数值为
,阿伏加德罗常数的数值为 ,则
,则 晶体的密度为
晶体的密度为 (列出计算式)。注:
(列出计算式)。注:
您最近一年使用:0次
2012·上海·零模
解题方法
6 . 氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得: ___ SiO2+ ___ C+___ N2
___ Si3N4+___ CO,根据题意完成下列各题:
(1)配平上述化学反应方程式。
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了20mol氮气,反应生成了5mol一氧化碳,则反应中转移电子为_____ NA,此时混合气体的平均相对分子质量是_____ 。
(3)分析反应可推测碳、氮气的氧化性____ >_____ (填化学式)。
(4)氮化硅陶瓷的机械强度高,硬度接近于刚玉(Al2O3),热稳定性好,化学性质稳定。以下用途正确的是____ 。
A 可以在冶金工业上制成坩埚、铝电解槽衬里等热工设备上
B 在电子工业上制成耐高温的电的良导体
C 研发氮化硅的全陶发动机替代同类型金属发动机
D 氮化硅陶瓷的开发,将受到资源的限制,发展前途暗淡

(1)配平上述化学反应方程式。
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了20mol氮气,反应生成了5mol一氧化碳,则反应中转移电子为
(3)分析反应可推测碳、氮气的氧化性
(4)氮化硅陶瓷的机械强度高,硬度接近于刚玉(Al2O3),热稳定性好,化学性质稳定。以下用途正确的是
A 可以在冶金工业上制成坩埚、铝电解槽衬里等热工设备上
B 在电子工业上制成耐高温的电的良导体
C 研发氮化硅的全陶发动机替代同类型金属发动机
D 氮化硅陶瓷的开发,将受到资源的限制,发展前途暗淡
您最近一年使用:0次
7 . 原子晶体是由原子直接通过共价键形成的空间网状结构的晶体,又称共价晶体,因其具有高熔沸点、硬度大、耐磨等优良特性而具有广泛的用途。
(1)晶体硅是良好的半导体材料,被广泛用于信息技术和能源科学等领域。晶体硅是与金刚石结构类似的晶体(其晶胞如图乙所示),硅晶体的1个晶胞中含_____ 个Si原子,在晶体硅的空间网状结构中最小环为_____ 元环,每最小环独立含有__________ 个Si原子,含1molSi原子的晶体硅中Si-Si键的数目为_____ 。
(2)金刚砂(SiC)也与金刚石具有相似的晶体结构(如图丙所示),在金刚砂的空间网状结构中,碳原子、硅原子交替以共价单键相结合。试回答下列问题:

①金刚砂、金刚石、晶体硅的熔点由低到高的顺序是_____ (均用化学式表示)。
②在金刚砂的结构中,一个碳原子周围结合了_____ 硅个原子,其键角是_____ 。
③金刚砂的结构中含有C、Si原子以共价键结合形成的环,其中一个最小的环上独立含有_ 个C-Si键
④金刚砂的晶胞结构如图甲所示,在SiC中,每个C原子周围最近等距的C原子数目为_____ ;若金刚砂的密度为ρg·cm-3,阿伏加 德罗常数为NA,则晶体中最近的两个碳硅原子之间的距离为_________ pm(用代数式表示即可)。
(1)晶体硅是良好的半导体材料,被广泛用于信息技术和能源科学等领域。晶体硅是与金刚石结构类似的晶体(其晶胞如图乙所示),硅晶体的1个晶胞中含
(2)金刚砂(SiC)也与金刚石具有相似的晶体结构(如图丙所示),在金刚砂的空间网状结构中,碳原子、硅原子交替以共价单键相结合。试回答下列问题:

①金刚砂、金刚石、晶体硅的熔点由低到高的顺序是
②在金刚砂的结构中,一个碳原子周围结合了
③金刚砂的结构中含有C、Si原子以共价键结合形成的环,其中一个最小的环上独立含有
④金刚砂的晶胞结构如图甲所示,在SiC中,每个C原子周围最近等距的C原子数目为
您最近一年使用:0次
解题方法
8 . 碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛。
(1)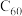 分子的晶体中,在晶胞的顶点和面心均含有一个
分子的晶体中,在晶胞的顶点和面心均含有一个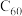 分子,则一个
分子,则一个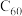 晶胞的质量为
晶胞的质量为_______ 。
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是_____ (填字母)。
a.晶体的熔点:干冰>冰
b.晶体中的空间利用率:干冰>冰
c.晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的是______ (填字母)。
a.金刚石中碳原子的杂化类型为 杂化,石墨中碳原子的杂化类型为
杂化,石墨中碳原子的杂化类型为 杂化
杂化
b.晶体中共价键的键长:金刚石中 <石墨中
<石墨中
C.晶体的熔点:金刚石>石墨
d.晶体中共价键的键角:金刚石>石墨
e.金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力
f.金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
(4)金刚石晶胞结构如下图,立方 结构与金刚石相似,在
结构与金刚石相似,在 晶体中,
晶体中, 原子周围最近的
原子周围最近的 原子所构成的立体图形为
原子所构成的立体图形为_______ , 原子与
原子与 原子之间共价键与配位键的数目比为
原子之间共价键与配位键的数目比为_______ ,一个晶胞中 原子数目为
原子数目为___________ 。
(5)已知 单质的晶体密度为
单质的晶体密度为 ,
, 的相对原子质量为
的相对原子质量为 ,阿伏加 德罗常数为
,阿伏加 德罗常数为 ,则
,则 的原子半径为
的原子半径为_________ 。
(1)
 分子的晶体中,在晶胞的顶点和面心均含有一个
分子的晶体中,在晶胞的顶点和面心均含有一个 分子,则一个
分子,则一个 晶胞的质量为
晶胞的质量为(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是
a.晶体的熔点:干冰>冰
b.晶体中的空间利用率:干冰>冰
c.晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的是
a.金刚石中碳原子的杂化类型为
 杂化,石墨中碳原子的杂化类型为
杂化,石墨中碳原子的杂化类型为 杂化
杂化b.晶体中共价键的键长:金刚石中
 <石墨中
<石墨中
C.晶体的熔点:金刚石>石墨
d.晶体中共价键的键角:金刚石>石墨
e.金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力
f.金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体

(4)金刚石晶胞结构如下图,立方
 结构与金刚石相似,在
结构与金刚石相似,在 晶体中,
晶体中, 原子周围最近的
原子周围最近的 原子所构成的立体图形为
原子所构成的立体图形为 原子与
原子与 原子之间共价键与配位键的数目比为
原子之间共价键与配位键的数目比为 原子数目为
原子数目为(5)已知
 单质的晶体密度为
单质的晶体密度为 ,
, 的相对原子质量为
的相对原子质量为 ,阿伏加 德罗常数为
,阿伏加 德罗常数为 ,则
,则 的原子半径为
的原子半径为
您最近一年使用:0次
9 . Ⅰ.有一应用前景广阔的纳米材料甲,其由A、B两种短周期非金属元素组成,难溶于水,且硬度大,熔点高。取材料甲与熔融的烧碱反应,生成一种含A元素的含氧酸盐乙和一种含B元素的气体丙,丙能使湿润的红色石蕊试纸变蓝;乙能溶于水,加盐酸产生白色沉淀,盐酸过量沉淀不溶解。
(1)甲的化学式为_________ ,其晶体属于________ 晶体
(2)乙的水溶液可以用来做__________________ (写出一种用途)
(3)B元素的一种氢化物丁,相对分子质量为32,常温下为液体,其燃烧放热多且燃烧产物对环境无污染,因此可用作火箭燃料、燃料电池燃料等。则丁的电子式为_____________ 。
Ⅱ.某铜制品在潮湿环境中发生的电化学腐蚀过程可表示为如图,腐蚀后有A物质生成,某小组为分析A物质的组成,进行了如下实验:
实验①:取A样品,加过量稀硝酸完全溶解后,再加入AgNO3溶液,有白色沉淀生成。
实验②:另取A样品4.29g,加入含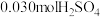 的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
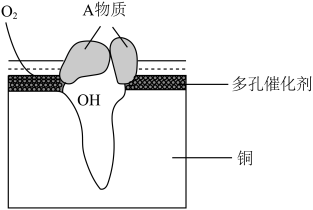
(1)该粉状锈中除了铜元素外还含有(写元素符号)_____ 元素.
(2)写出该粉状锈溶于稀硫酸反应的离子方程式____ 。
(3)加热条件下,实验②中所得的黑色固体能与乙醇反应,化学方程式为_____ 。
(1)甲的化学式为
(2)乙的水溶液可以用来做
(3)B元素的一种氢化物丁,相对分子质量为32,常温下为液体,其燃烧放热多且燃烧产物对环境无污染,因此可用作火箭燃料、燃料电池燃料等。则丁的电子式为
Ⅱ.某铜制品在潮湿环境中发生的电化学腐蚀过程可表示为如图,腐蚀后有A物质生成,某小组为分析A物质的组成,进行了如下实验:
实验①:取A样品,加过量稀硝酸完全溶解后,再加入AgNO3溶液,有白色沉淀生成。
实验②:另取A样品4.29g,加入含
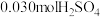 的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
(1)该粉状锈中除了铜元素外还含有(写元素符号)
(2)写出该粉状锈溶于稀硫酸反应的离子方程式
(3)加热条件下,实验②中所得的黑色固体能与乙醇反应,化学方程式为
您最近一年使用:0次
2010·全国·一模
解题方法
10 . A、B、C、W、X、Y、Z是由周期表中短周期元素组成的七种物质,其中A、B、C是三种固体单质,W、X、Y、Z是由两种元素组成的化合物。它们之间的转化关系如图所示(所有反应物和生成物均在框图中):

回答下列问题:
(1)化合物Z的晶体类型属于__________ 晶体。
(2)写出单质C的一种用途__________________________________ 。
(3)航天科技测知化合物N是金星大气层的成分之一,组成化合物N的元素与W相同。已知N中两种元素的质量之比为2:1,N的相对原子质量小于80,则N的化学式为_____________ 。又知该分子中的每个原子都满足最外层8电子的稳定结构,试写出其电子式_________________ 。
(4)写出下列反应的化学方程式:
①__________________________________ ;
②__________________________________ 。

回答下列问题:
(1)化合物Z的晶体类型属于
(2)写出单质C的一种用途
(3)航天科技测知化合物N是金星大气层的成分之一,组成化合物N的元素与W相同。已知N中两种元素的质量之比为2:1,N的相对原子质量小于80,则N的化学式为
(4)写出下列反应的化学方程式:
①
②
您最近一年使用:0次



