1 . (1)向盛有硫酸铜水溶液的试管里逐滴加入氨水,首先出现蓝色沉淀,继续滴加氨水,蓝色沉淀溶解,得到深蓝色的透明溶液,请写出先后发生的离子方程式
①_______________________________________________ ;
②________________________________________________ 。
(2)再向深蓝色透明溶液中加入乙醇,析出深蓝色的晶体。深蓝色晶体的化学式为____________________ 。 乙醇的作用是____________________ 。
(3)根据以上实验过程,判断NH3和H2O与Cu2+的配位能力:NH3_______ H2O(填“>”、“=”或“<”);
①
②
(2)再向深蓝色透明溶液中加入乙醇,析出深蓝色的晶体。深蓝色晶体的化学式为
(3)根据以上实验过程,判断NH3和H2O与Cu2+的配位能力:NH3
您最近一年使用:0次
名校
2 . 如图所示为冰晶石(化学式为Na3AlF6)的晶胞。已知冰晶石熔融时电离方程式为:Na3AlF6=3Na++AlF63-。图中●位于大立方体顶点和面心,○位于大立方体的12 条棱的中点和8个小立方体的体心。则下列说法正确的是
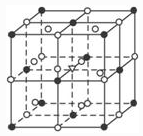
| A.冰晶石是原子晶体 | B.该物质中存在配位键 |
| C.大立方体的体心处△代表的是Al3+ | D.该物质是电解冶炼铝的还原剂 |
您最近一年使用:0次
3 . 有关常见晶体的叙述正确的是( )
| A.氯化铯晶体中,每1个Cs+与其他8个Cs+等距离紧邻 |
| B.干冰晶体中,每1个CO2分子与其他12个CO2分子等距离紧邻 |
| C.石墨中由非极性键构成的最小碳环有6个碳原子,每个该小环平均分配6个碳原子 |
| D.氯化钠晶体中,每个Na+与其他6个Na+等距离紧邻 |
您最近一年使用:0次
2017-04-24更新
|
281次组卷
|
3卷引用:广东省实验中学2016-2017学年高二下学期期中考试化学试题
4 . 金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的价电子排布式为_________ 。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。电负性:C___ Ti(填“>”或“<“,下同);第一电离能:N____ O,原因是_________ 。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为___ 形,其中硫原子的杂化方式为_______ ,写出与SO42-互为等电子体的一种分子的化学式:________ 。
(4)Ti的氧化物和CaO相互作用能形成钛酸盐CaTiO3,CaTiO3的晶体结构如图1,Ti位于立方体的体心。该晶体中,Ca2+的配位数为__ 。
(5)Fe能形成多种氧化物,其中FeO晶胞结构如图2。FeO晶胞边长为428pm则FeO晶体的密度为____ g/cm3(阿伏伽德罗常数的值用NA表示,1pm=10-12m,写出计算式即可)。
(1)Ti基态原子的价电子排布式为
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。电负性:C
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为
(4)Ti的氧化物和CaO相互作用能形成钛酸盐CaTiO3,CaTiO3的晶体结构如图1,Ti位于立方体的体心。该晶体中,Ca2+的配位数为
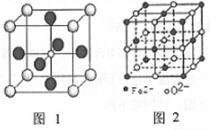
(5)Fe能形成多种氧化物,其中FeO晶胞结构如图2。FeO晶胞边长为428pm则FeO晶体的密度为
您最近一年使用:0次
名校
解题方法
5 . 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。
请回答下列问题:
(1)请写出:D基态原子的价层电子排布图:_________________________________________ ;F基态原子的价电子排布式:________________________________________ 。
(2)下列说法错误的是________ 。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:B<C<D
C.N2与CO为等电子体,结构相似
D.稳定性:H2O>H2S,水分子更稳定的原因是水分子间存在氢键
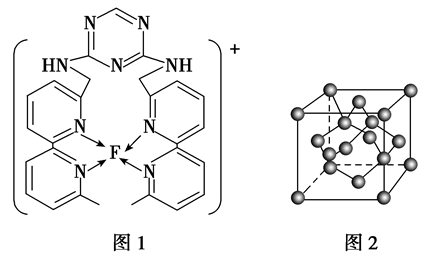
(3)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向F的硫酸盐溶液中通入过量的C与A形成的气体X可生成[F(X)4]2+,该离子的结构式为_____________________________________ (用元素符号表示)。
(4)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图1所示的离子,该离子中碳原子的杂化方式有________ 。
(5)B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子数为________ 。
(6)D与F形成离子个数比为1∶1的化合物,晶胞与NaCl类似,设D离子的半径为a pm,F离子的半径b pm,求该晶胞的空间利用率________ 。
请回答下列问题:
(1)请写出:D基态原子的价层电子排布图:
(2)下列说法错误的是
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:B<C<D
C.N2与CO为等电子体,结构相似
D.稳定性:H2O>H2S,水分子更稳定的原因是水分子间存在氢键
(3)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向F的硫酸盐溶液中通入过量的C与A形成的气体X可生成[F(X)4]2+,该离子的结构式为
(4)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图1所示的离子,该离子中碳原子的杂化方式有

(5)B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子数为
(6)D与F形成离子个数比为1∶1的化合物,晶胞与NaCl类似,设D离子的半径为a pm,F离子的半径b pm,求该晶胞的空间利用率
您最近一年使用:0次
2017-03-21更新
|
393次组卷
|
3卷引用:2017届河北省石家庄市第二中学高三下学期模拟联考理科综合化学试卷
6 . 黑火药是我国古代的四大发明之一,距今已有1000多年的历史,其成分是木炭(C)、硫粉(S)和硝酸钾(KNO3)。回答下列有关问题:
(1)黑火药爆炸生成无毒的气体和K2S,该反应的化学方程式为________________ 。
(2)Se与S同主族,则Se原子的核外电子排布式为〔Ar〕________ ,有____ 对成对电子。
(3)C、N、O、K的电负性由大到小的顺序是_________________ 。
(4)黑火药爆炸除生成K2S外,还生成少量K2S2,其结构类似于Na2O2。则K2S2中含有的化学键类型为_______________ 。
(5)K2S遇酸生成H2S,H2S分子中,S原子的杂化轨道类型是_________ ;KNO3可电离出NO3-,NO3-的空间构型是______________ 。
(6)K2S的晶胞结构如图所示。其中K+的配位数为_______ ,若K2S晶体的密度为ρg·cm-3,则晶胞中距离最近的两个S2-核间距为_________ cm(用NA表示阿伏伽德罗常数的值)
(1)黑火药爆炸生成无毒的气体和K2S,该反应的化学方程式为
(2)Se与S同主族,则Se原子的核外电子排布式为〔Ar〕
(3)C、N、O、K的电负性由大到小的顺序是
(4)黑火药爆炸除生成K2S外,还生成少量K2S2,其结构类似于Na2O2。则K2S2中含有的化学键类型为
(5)K2S遇酸生成H2S,H2S分子中,S原子的杂化轨道类型是
(6)K2S的晶胞结构如图所示。其中K+的配位数为
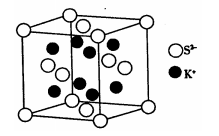
您最近一年使用:0次
解题方法
7 . Zn(OH)2可溶于氨水生成[Zn(NH3)4]2+: Zn(OH)2+4NH3·H2O=Zn(NH3)4]2++4H2O+2OH-
(1)原子序数比Zn元素小1的元素符号为____ ,该元素原子基态核外电子排布式为______ 。
(2)NH3、H2O的沸点均高于同族元素氢化物的沸点,是因为________ 。
(3)NH3中N原子轨道的杂化类型是______ 。
(4)与H2O分子互为等电子体的分子为_____ 。
(5)闪锌矿是一种自然界含Zn元素的矿物,其晶体结构属于立方晶体(如右图所示),则在立方ZnS晶体结构中S2-的配位数为________ 。Zn2+的分数坐标为( ,
, ,
, )、(
)、( ,
,  ,
, )、(
)、( ,
, ,
, )、(
)、( ,
, ,
, ),则S2-的分数坐标为
),则S2-的分数坐标为______ 。
(1)原子序数比Zn元素小1的元素符号为
(2)NH3、H2O的沸点均高于同族元素氢化物的沸点,是因为
(3)NH3中N原子轨道的杂化类型是
(4)与H2O分子互为等电子体的分子为
(5)闪锌矿是一种自然界含Zn元素的矿物,其晶体结构属于立方晶体(如右图所示),则在立方ZnS晶体结构中S2-的配位数为
 ,
, ,
, )、(
)、( ,
,  ,
, )、(
)、( ,
, ,
, )、(
)、( ,
, ,
, ),则S2-的分数坐标为
),则S2-的分数坐标为
您最近一年使用:0次
名校
解题方法
8 . 青蒿素是从黄花蒿中提取的一种无色针状晶体,双氢青蒿素是青蒿素的重要衍生物,抗疟疾疗效优于青蒿素,请回答下列问题:
(1)组成青蒿素的三种元素电负性由大到小排序是__________ ,画出基态O原子的价电子排布图__________ 。
(2)一个青蒿素分子中含有_______ 个手性碳原子。
(3)双氢青蒿素的合成一般是用硼氢化钠(NaBH4)还原青蒿素.硼氢化物的合成方法有:
2LiH+B2H6=2LiBH4; 4NaH+BF3═NaBH4+3NaF
①写出BH4﹣的等电子体_________ (分子、离子各写一种);
②B2H6分子结构如图,2个B原子和一个H原子共用2个电子形成3中心二电子键,中间的2个氢原子被称为“桥氢原子”,它们连接了2个B原子.则B2H6分子中有______ 种共价键,B原子的杂化方式为________ ;
③NaBH4的阴离子中一个B原子能形成4个共价键,而冰晶石(Na3AlF6)的阴离子中一个Al原子可以形成6个共价键,原因是______________ ;
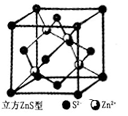
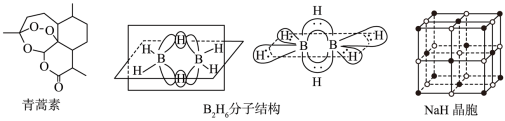
④NaH的晶胞如图,则NaH晶体中阳离子的配位数是_________ ;设晶胞中阴、阳离子为刚性球体且恰好相切,求阴、阳离子的半径比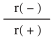 =
=__________ 。
(1)组成青蒿素的三种元素电负性由大到小排序是
(2)一个青蒿素分子中含有
(3)双氢青蒿素的合成一般是用硼氢化钠(NaBH4)还原青蒿素.硼氢化物的合成方法有:
2LiH+B2H6=2LiBH4; 4NaH+BF3═NaBH4+3NaF
①写出BH4﹣的等电子体
②B2H6分子结构如图,2个B原子和一个H原子共用2个电子形成3中心二电子键,中间的2个氢原子被称为“桥氢原子”,它们连接了2个B原子.则B2H6分子中有
③NaBH4的阴离子中一个B原子能形成4个共价键,而冰晶石(Na3AlF6)的阴离子中一个Al原子可以形成6个共价键,原因是
④NaH的晶胞如图,则NaH晶体中阳离子的配位数是
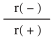 =
=
您最近一年使用:0次
名校
9 . 硫是一种重要的非金属元素,广泛存在于自然界,回答下列问题:
(1)基态硫原子的价层电子排布图是_________________ 。
(2)①硫单质的一种结构为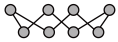 ,杂化方式为
,杂化方式为______________ ,该物质___________ (填“可溶”或“难溶”)于水,该晶体中存在的作用力___________ 、_____________ 。
②SO42-、CS2、CO32-键角由大到小的顺序是_________________ 。
(3)含硫的物质的特殊性质与其结构相关。
①熔点:SF6_______ A1F3(填“>”或“<”),原因是___________________ 。
②分析并比较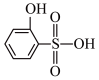 与
与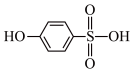 的沸点高低:
的沸点高低:___________________ 。
(4)ZnS晶胞如图所示:
①由图可知,Zn2+填在了S2-形成的______________ 空隙中。
②已知晶胞密度为, g/cm3,阿伏伽德罗常数为NA,则晶胞边长为
g/cm3,阿伏伽德罗常数为NA,则晶胞边长为__________ pm。
(1)基态硫原子的价层电子排布图是
(2)①硫单质的一种结构为
 ,杂化方式为
,杂化方式为②SO42-、CS2、CO32-键角由大到小的顺序是
(3)含硫的物质的特殊性质与其结构相关。
①熔点:SF6
②分析并比较
 与
与 的沸点高低:
的沸点高低:(4)ZnS晶胞如图所示:
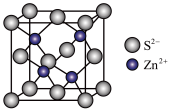
①由图可知,Zn2+填在了S2-形成的
②已知晶胞密度为,
 g/cm3,阿伏伽德罗常数为NA,则晶胞边长为
g/cm3,阿伏伽德罗常数为NA,则晶胞边长为
您最近一年使用:0次
2017-03-04更新
|
1488次组卷
|
2卷引用:2017届云南省师范大学附属中学高三高考适应性月考(六)理综化学试卷
名校
10 . 铜元素的化合物种类很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)CuSO4和Cu(NO3)2是自然界中重要的铜盐。
① CuSO4和Cu(NO3)2中阳离子的基态外围电子排布式为_______________ 。
② S、O、N三种元素的第一电离能由大到小为_____________ 。
③ CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是________ 。
(2)硫酸铜溶液中滴入氨基乙酸钠(H2NCH2COONa)即可得到配合物A,其结构如图所示。请回答下列问题:

① 配合物A中N原子的轨道杂化类型为__________ 。
② 1 mol配合物A含有σ键的数目为_____________ 。
(3)CuFeS2的晶胞如图1所示,CuFeS2的晶胞中每个Cu原子与__ 个S原子相连

(1)CuSO4和Cu(NO3)2是自然界中重要的铜盐。
① CuSO4和Cu(NO3)2中阳离子的基态外围电子排布式为
② S、O、N三种元素的第一电离能由大到小为
③ CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是
(2)硫酸铜溶液中滴入氨基乙酸钠(H2NCH2COONa)即可得到配合物A,其结构如图所示。请回答下列问题:

① 配合物A中N原子的轨道杂化类型为
② 1 mol配合物A含有σ键的数目为
(3)CuFeS2的晶胞如图1所示,CuFeS2的晶胞中每个Cu原子与

您最近一年使用:0次



