名校
解题方法
1 . 如图是甲、乙、丙三种固体物质的溶解度曲线。
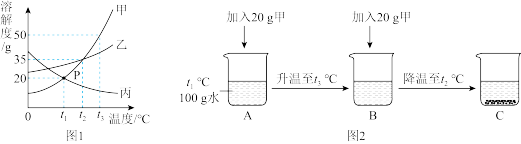
(1)P点的含义是_______ 。
(2)若甲中混有少量乙,应采用_______ 方法提纯甲。
(3)取固体甲进行图2所示的实验,一定属于不饱和溶液的是_______ (填序号,下同),三个烧杯中溶液的溶质质量分数由大到小的顺序是_______ 。

(1)P点的含义是
(2)若甲中混有少量乙,应采用
(3)取固体甲进行图2所示的实验,一定属于不饱和溶液的是
您最近一年使用:0次
2 . 海洋是一个巨大的宝藏,海水淡化是重要的化学研究课题。
(1)蒸馏法获取淡水,历史悠久,操作简单,图中符合模拟蒸馏海水的装置是___ (填序号)。
a.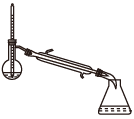 b.
b.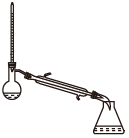
c.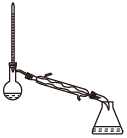 d.
d.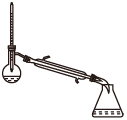
蒸馏前,应向烧瓶中加入沸石或碎瓷片,目的是___ ,冷凝水一般不采用“上进下出”,其原因是____ 。
(2)电渗析法的技术原理如图(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过):
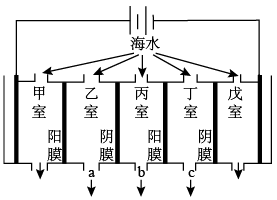
某地海水中主要含Na+、K+、Ca2+、Mg2+、Cl-、HCO 、SO
、SO 等,则淡化过程中,甲室的电极反应式为
等,则淡化过程中,甲室的电极反应式为___ ,产生水垢最多的是___ 室,淡水的出口为____ (填“a”、“b”或“c”)。
(3)离子交换法获取淡水模拟图如图:

经过阳离子交换树脂后水中阳离子数目____ (填“增加”“不变”或“减少”),阴离子交换树脂中发生了离子反应,其离子方程式为___ 。
(1)蒸馏法获取淡水,历史悠久,操作简单,图中符合模拟蒸馏海水的装置是
a.
 b.
b.
c.
 d.
d.
蒸馏前,应向烧瓶中加入沸石或碎瓷片,目的是
(2)电渗析法的技术原理如图(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过):

某地海水中主要含Na+、K+、Ca2+、Mg2+、Cl-、HCO
 、SO
、SO 等,则淡化过程中,甲室的电极反应式为
等,则淡化过程中,甲室的电极反应式为(3)离子交换法获取淡水模拟图如图:

经过阳离子交换树脂后水中阳离子数目
您最近一年使用:0次
2021-09-06更新
|
1253次组卷
|
5卷引用:安徽省A10联盟2022届高三上学期摸底考试化学试题
安徽省A10联盟2022届高三上学期摸底考试化学试题(已下线)3.3.1 粗盐提纯 从海水中提取溴-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)(已下线)专题35 物质的检验、分离和提纯(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练(已下线)第八章 化学与可持续发展(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)第八章 化学与可持续发展【单元测试B卷】
3 . 用于分离或提纯物质的方法有:A.蒸馏(分馏) B.萃取C.过滤 D.重结晶 E.分液。下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号 )
(1)除去Ca(OH)2溶液中悬浮的CaCO3微粒___ ;
(2)分离四氯化碳与水的混合物____ ;
(3)分离汽油和煤油____ ;
(4)分离碘水中的碘单质____ ;
(5)提纯氯化钠和硝酸钾混合物中的硝酸钾____ 。
(1)除去Ca(OH)2溶液中悬浮的CaCO3微粒
(2)分离四氯化碳与水的混合物
(3)分离汽油和煤油
(4)分离碘水中的碘单质
(5)提纯氯化钠和硝酸钾混合物中的硝酸钾
您最近一年使用:0次
2021-03-25更新
|
78次组卷
|
2卷引用:新疆维吾尔自治区呼图壁县第一中学2020-2021学年高二下学期期初考试化学试题
名校
4 . 分离和提纯是研究有机物结构和性质的前提,下面是两种分离和提纯有机物的装置图。
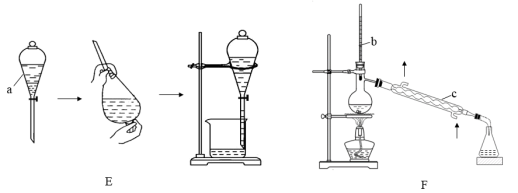
(1)E的操作名称是_______ ;F的操作名称是_______ 。
(2)用“E”、“F”或其他操作名称填空:
①分离甲醇和水的混合物,所用的操作为_______ 。
②提取溴水中的Br2,所用的操作为_______ 。
③粗苯甲酸提纯,所用的操作为_______ 。
(3)仪器a中有两种不相溶的液体,其中一种为水,请设计一个简单的实验方案,判断静置分层后水的哪一层:_______ 。

(1)E的操作名称是
(2)用“E”、“F”或其他操作名称填空:
①分离甲醇和水的混合物,所用的操作为
②提取溴水中的Br2,所用的操作为
③粗苯甲酸提纯,所用的操作为
(3)仪器a中有两种不相溶的液体,其中一种为水,请设计一个简单的实验方案,判断静置分层后水的哪一层:
您最近一年使用:0次
名校
解题方法
5 . 某铝合金中含有元素铝、镁、铜、硅,为了测定该合金中铝的含量,设计了如下实验,请回答有关问题:
(1)称取样品ag(精确到0.1g),称量时通常使用的主要仪器的名称是_______ 。
(2)样品溶解于足量的稀盐酸,过滤并洗涤滤渣。滤渣为_______ ,溶解、过滤用到的玻璃仪器是_______ 。
(3)向滤液中加过量的氢氧化钠溶液,过滤并洗涤滤渣。有关的离子方程式是_______ 、_______ 、_______ 。
(4)向步骤(3)的滤液中通入足量的二氧化碳气体,过滤并洗涤滤渣。有关的离子方程式是_______ 、_______ 。
(5)将步骤(4)中所得的滤渣烘干并灼烧至恒重、冷却后称量,其质量为bg。有关反应的化学方程式是_______ 。原样品中铝的质量分数是_______ 。
(1)称取样品ag(精确到0.1g),称量时通常使用的主要仪器的名称是
(2)样品溶解于足量的稀盐酸,过滤并洗涤滤渣。滤渣为
(3)向滤液中加过量的氢氧化钠溶液,过滤并洗涤滤渣。有关的离子方程式是
(4)向步骤(3)的滤液中通入足量的二氧化碳气体,过滤并洗涤滤渣。有关的离子方程式是
(5)将步骤(4)中所得的滤渣烘干并灼烧至恒重、冷却后称量,其质量为bg。有关反应的化学方程式是
您最近一年使用:0次
名校
6 . (1)当光束通过下列物质时,会出现丁达尔效应的是_______ 。
①Fe(OH)3胶体,②水,③蔗糖溶液,④Ca(OH)2悬浊液
(2)维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有_______ (填“氧化性”或“还原性”)。
(3)下列各组混合物的分离或提纯选用哪种方法最合适?(把选用的标号填入括号内)
A.萃取 B.分液 C.过滤 D.加热分解 E.蒸发 F.蒸馏 H.升华
①把溴水中的溴提取出来_______
②分离柴油和水的混合物_______
③分离四氯化碳(沸点为 76.75℃)和甲苯(沸点为 110.6℃)的混合物_______
(4)现有以下物质:①Ba(OH)2晶体,②盐酸,③冰醋酸(固态醋酸),④石墨,⑤酒精(C2H5OH),请回答下列问题(填序号):
Ⅰ、以上物质中属于电解质的是_______ 。
Ⅱ、以上物质中属于非电解质的是_______ 。
Ⅲ、请写出①在水溶液中的电离方程式_______ 。
(5)某学校实验室有一瓶浓硫酸试剂,标签上标有密度1.84g·cm-3,质量分数98%,现用该浓硫酸配制480 mL 1mol·L﹣1的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒。请回答下列问题:
a.配制稀硫酸时,除了上述仪器,还缺少的仪器有_______ (写仪器名称)。
b.经计算,配制480mL 1mol·L-1的稀硫酸,需要用量筒量取上述浓硫酸的体积为_______ mL。
①Fe(OH)3胶体,②水,③蔗糖溶液,④Ca(OH)2悬浊液
(2)维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有
(3)下列各组混合物的分离或提纯选用哪种方法最合适?(把选用的标号填入括号内)
A.萃取 B.分液 C.过滤 D.加热分解 E.蒸发 F.蒸馏 H.升华
①把溴水中的溴提取出来
②分离柴油和水的混合物
③分离四氯化碳(沸点为 76.75℃)和甲苯(沸点为 110.6℃)的混合物
(4)现有以下物质:①Ba(OH)2晶体,②盐酸,③冰醋酸(固态醋酸),④石墨,⑤酒精(C2H5OH),请回答下列问题(填序号):
Ⅰ、以上物质中属于电解质的是
Ⅱ、以上物质中属于非电解质的是
Ⅲ、请写出①在水溶液中的电离方程式
(5)某学校实验室有一瓶浓硫酸试剂,标签上标有密度1.84g·cm-3,质量分数98%,现用该浓硫酸配制480 mL 1mol·L﹣1的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒。请回答下列问题:
a.配制稀硫酸时,除了上述仪器,还缺少的仪器有
b.经计算,配制480mL 1mol·L-1的稀硫酸,需要用量筒量取上述浓硫酸的体积为
您最近一年使用:0次
名校
解题方法
7 . 电子工业中常用覆铜板为基础材料制作印刷电路板,工业上利用 溶液作为“腐蚀液”将覆铜板上不想要的铜腐蚀,同时还可以从腐蚀废液(主要含
溶液作为“腐蚀液”将覆铜板上不想要的铜腐蚀,同时还可以从腐蚀废液(主要含 、
、 和
和 )中回收铜,并重新获得
)中回收铜,并重新获得 溶液。废液处理流程如下:
溶液。废液处理流程如下:

请回答下列问题。
(1)操作 的名称为
的名称为___________ 。
(2) 溶液腐蚀铜板的离子方程式为
溶液腐蚀铜板的离子方程式为___________ 。
(3)试剂 为
为___________ (填化学式)。沉淀 为
为___________ (填化学式)。从氧化还原反应的角度分析,试剂 是
是___________ 剂。
(4)为了检验腐蚀废液中是否含有 ,可将腐蚀废液取样然后滴加
,可将腐蚀废液取样然后滴加___________ (填化学式)溶液。
(5)查阅资料可知 能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,请写出反应的离子方程式
能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,请写出反应的离子方程式___________ 。但是检验腐蚀废液中是否含有 ,不能用酸性高锰酸钾溶液进行检验,原因是
,不能用酸性高锰酸钾溶液进行检验,原因是___________ 。
(6)向 溶液中加入
溶液中加入 溶液的实验现象为
溶液的实验现象为___________ 。
 溶液作为“腐蚀液”将覆铜板上不想要的铜腐蚀,同时还可以从腐蚀废液(主要含
溶液作为“腐蚀液”将覆铜板上不想要的铜腐蚀,同时还可以从腐蚀废液(主要含 、
、 和
和 )中回收铜,并重新获得
)中回收铜,并重新获得 溶液。废液处理流程如下:
溶液。废液处理流程如下:
请回答下列问题。
(1)操作
 的名称为
的名称为(2)
 溶液腐蚀铜板的离子方程式为
溶液腐蚀铜板的离子方程式为(3)试剂
 为
为 为
为 是
是(4)为了检验腐蚀废液中是否含有
 ,可将腐蚀废液取样然后滴加
,可将腐蚀废液取样然后滴加(5)查阅资料可知
 能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,请写出反应的离子方程式
能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,请写出反应的离子方程式 ,不能用酸性高锰酸钾溶液进行检验,原因是
,不能用酸性高锰酸钾溶液进行检验,原因是(6)向
 溶液中加入
溶液中加入 溶液的实验现象为
溶液的实验现象为
您最近一年使用:0次
2021-02-09更新
|
399次组卷
|
3卷引用:云南省昆明市第八中学2020-2021学年高一下学期开学考试化学试题
云南省昆明市第八中学2020-2021学年高一下学期开学考试化学试题云南省玉溪市2020-2021学年高一上学期教学质量检测化学试题(已下线)第09练 铁及其化合物-2022年【寒假分层作业】高一化学(人教版2019)
解题方法
8 . 按要求填空
(1)向CuCl2溶液中滴加NaOH溶液,现象:_________ ,离子方程式:_____ ,
(2)向NaHCO3溶液中滴加稀硫酸,现象:_____ ,离子方程式:_______ ;
(3)铜粉(铁粉):除杂,括号内为杂质,所加试剂_____ ,离子方程式;_____ 。
(4)FeSO4 (CuSO4):除杂,括号内为杂质,所加试剂________ ,离子方程式__________ 。
(1)向CuCl2溶液中滴加NaOH溶液,现象:
(2)向NaHCO3溶液中滴加稀硫酸,现象:
(3)铜粉(铁粉):除杂,括号内为杂质,所加试剂
(4)FeSO4 (CuSO4):除杂,括号内为杂质,所加试剂
您最近一年使用:0次
2021-01-09更新
|
1981次组卷
|
5卷引用:湖南省岳阳市岳阳县2021-2022学年高三上学期入学考试化学试题
真题
名校
9 . 用含有A1203、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解A12O3的离子方程式是_______________ 1;
(2)KMnO4-氧化Fe2+的离子方程式补充完整:______
 1MnO
1MnO +
+ Fe2++
Fe2++ ______=
______= Mn2++
Mn2++ Fe3++
Fe3++ ______
______
(3)已知:
生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的:._________________ ;
(4)已知:一定条件下,MnO 可与Mn2+反应生成MnO2,
可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是_____________ ;
②Ⅳ中加入MnSO4的目的是:______________ ;
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解A12O3的离子方程式是
(2)KMnO4-氧化Fe2+的离子方程式补充完整:
 1MnO
1MnO +
+ Fe2++
Fe2++ ______=
______= Mn2++
Mn2++ Fe3++
Fe3++ ______
______(3)已知:
生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤Ⅱ的目的:.
(4)已知:一定条件下,MnO
 可与Mn2+反应生成MnO2,
可与Mn2+反应生成MnO2,①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是
②Ⅳ中加入MnSO4的目的是:
您最近一年使用:0次
2019-01-30更新
|
1889次组卷
|
4卷引用:吉林省长春外国语学校2020-2021学年高一下学期期初考试化学试题
吉林省长春外国语学校2020-2021学年高一下学期期初考试化学试题河南省范县第一中学2021-2022学年高一上学期第三次月考检测化学试题2013年全国普通高等学校招生统一考试理科综合能力测试化学(北京卷)(已下线)2014届高考化学二轮复习四川配套训练 第10讲金属元素化合物练习卷
10 . 海水是一种丰富的资源,工业上可从海水中提取多种物质,广泛应用于生活、生产、科技等方面。下图是某工厂对海水资源进行综合利用的示意图。

回答下列问题:
(1)流程图中操作a的名称为________ 。(填序号)
A、蒸发结晶 B、降温结晶
(2)生产生石灰的方程式__________________________ 。从离子反应的角度思考,往海水中加入石灰乳的作用是____________________ 。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是_____________ 。
②操作b是在________ 氛围中进行,若在空气中加热,则会生成Mg(OH)2,
写出有关反应的化学方程式:________________________________________ 。
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为__________ ,从考虑成本和废物循环利用的角度,副产物氯气可以用于_______________ 。

回答下列问题:
(1)流程图中操作a的名称为
A、蒸发结晶 B、降温结晶
(2)生产生石灰的方程式
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是
②操作b是在
写出有关反应的化学方程式:
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为
您最近一年使用:0次
2019-01-19更新
|
465次组卷
|
2卷引用:河南省南阳市内乡县菊潭高级中学2022届高三入学考试化学试题



