名校
解题方法
1 . 钴广泛应用于机械制造、电子电器、航空航天、电池制造等行业,是国家重要的战略资源。用含钴废料(主要成分为 ,含少量
,含少量 、
、 、CaO、MgO、
、CaO、MgO、 等)制备草酸钴晶体(
等)制备草酸钴晶体( )的工艺流程如图所示,试回答下列问题:
)的工艺流程如图所示,试回答下列问题:
① 具有强氧化性。
具有强氧化性。
② ,
, 。
。
(1)为提高含钴废料的浸出效率,可采取的措施是___________ (任写一条)。
(2) 在水溶液中的电离方程式为
在水溶液中的电离方程式为___________ ;浸出渣的主要成分为___________ (填化学式)。
(3)向“浸出液”中加入适量的 时,
时, 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(4)①“除钙镁”后,滤液中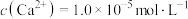 时,
时,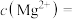
___________  。
。
②若“调pH”时溶液的pH偏低,将会导致 、
、 沉淀不完全,其原因是
沉淀不完全,其原因是___________ 。
(5)将 在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知:
在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知: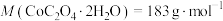 ,曲线中330℃及以上所得固体均为钴氧化物]
,曲线中330℃及以上所得固体均为钴氧化物] ,此过程中发生反应的化学方程式为
,此过程中发生反应的化学方程式为___________ 。
 ,含少量
,含少量 、
、 、CaO、MgO、
、CaO、MgO、 等)制备草酸钴晶体(
等)制备草酸钴晶体( )的工艺流程如图所示,试回答下列问题:
)的工艺流程如图所示,试回答下列问题: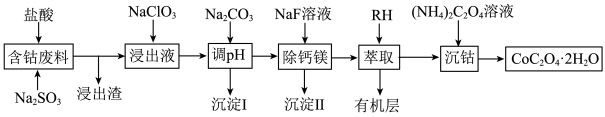
①
 具有强氧化性。
具有强氧化性。②
 ,
, 。
。(1)为提高含钴废料的浸出效率,可采取的措施是
(2)
 在水溶液中的电离方程式为
在水溶液中的电离方程式为(3)向“浸出液”中加入适量的
 时,
时, 发生反应的离子方程式为
发生反应的离子方程式为(4)①“除钙镁”后,滤液中
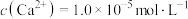 时,
时,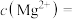
 。
。②若“调pH”时溶液的pH偏低,将会导致
 、
、 沉淀不完全,其原因是
沉淀不完全,其原因是(5)将
 在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知:
在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知: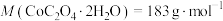 ,曲线中330℃及以上所得固体均为钴氧化物]
,曲线中330℃及以上所得固体均为钴氧化物]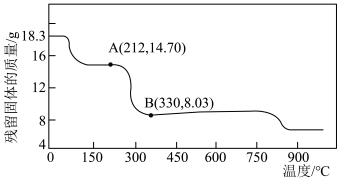
 ,此过程中发生反应的化学方程式为
,此过程中发生反应的化学方程式为
您最近一年使用:0次
2024-06-02更新
|
175次组卷
|
5卷引用:2024届内蒙古自治区名校联盟高三下学期联合质量检测(三模)理科综合试题-高中化学
2 . 以湿法炼锌厂所产的钴锰渣(主要成分为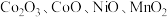 ,含少量
,含少量
 等)为原料回收制备
等)为原料回收制备 的工艺如下:
的工艺如下: ;
;
回答下列问题:
(1)“酸浸”时其中 ,写出
,写出 反应的化学方程式:
反应的化学方程式:___________ ,滤渣1中的硫酸盐是___________ 。
(2)“除铁”时,生成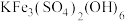 的离子方程式为
的离子方程式为___________ 。
(3)“除铜锌”时, 主要以
主要以___________ [填“ ”或“
”或“ ”]形式除去,其原因是
”]形式除去,其原因是___________ (反应平衡常数 视为反应完全,根据已知信息,写出推理过程)。
视为反应完全,根据已知信息,写出推理过程)。
(4)“滤渣3”中含有MnO2,写出“除锰”时生成MnO2的化学方程式:___________ 。
(5)P204、P507对金属离子的萃取率与 的关系如图所示。
的关系如图所示。___________ 。
②“P507萃取”时,选择合适的pH范围为___________ (填字母)。
A.3~4 B.4~5 C.5~6 D.6~7
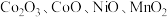 ,含少量
,含少量
 等)为原料回收制备
等)为原料回收制备 的工艺如下:
的工艺如下:
 ;
;回答下列问题:
(1)“酸浸”时其中
 ,写出
,写出 反应的化学方程式:
反应的化学方程式:(2)“除铁”时,生成
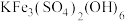 的离子方程式为
的离子方程式为(3)“除铜锌”时,
 主要以
主要以 ”或“
”或“ ”]形式除去,其原因是
”]形式除去,其原因是 视为反应完全,根据已知信息,写出推理过程)。
视为反应完全,根据已知信息,写出推理过程)。(4)“滤渣3”中含有MnO2,写出“除锰”时生成MnO2的化学方程式:
(5)P204、P507对金属离子的萃取率与
 的关系如图所示。
的关系如图所示。
②“P507萃取”时,选择合适的pH范围为
A.3~4 B.4~5 C.5~6 D.6~7
您最近一年使用:0次
名校
3 . 在实验室,从叔丁醇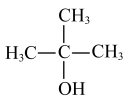 )和浓盐酸制备2-氯-2-甲基丙烷(
)和浓盐酸制备2-氯-2-甲基丙烷(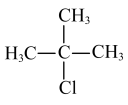 ,熔点:-25.4℃,沸点:50.7℃)所得混合液中提取产品的流程如图所示:
,熔点:-25.4℃,沸点:50.7℃)所得混合液中提取产品的流程如图所示:
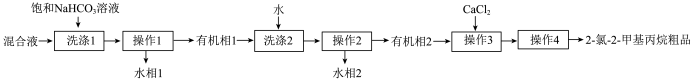
| A.“洗1”的主要目的是除去盐酸 |
| B.“操作1”和“操作2”的名称均为分液 |
| C.“操作3”中CaCl2不能用碱石灰代替 |
| D.“操作4”中用到的仪器是分液漏斗 |
您最近一年使用:0次
2024-05-31更新
|
55次组卷
|
2卷引用:2024届内蒙古乌海市第六中学高三下学期第二次临模考试理科综合试题-高中化学
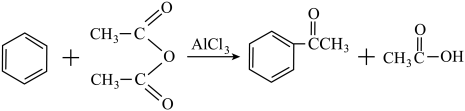
4 . 苯乙酮是一种重要的化工原料,可用于制造香皂和塑料的增塑剂。实验室可用苯和乙酸酐为原料,在无水AlCl3催化下加热制得:
实验步骤如下:
步骤Ⅰ:向仪器A中迅速加入13g粉状无水AlCl3和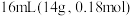 无水苯,在搅拌下将
无水苯,在搅拌下将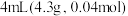 乙酸酐慢慢滴加到A中,待反应缓和后,加热回流1小时,直至无HCl气体逸出为止。
乙酸酐慢慢滴加到A中,待反应缓和后,加热回流1小时,直至无HCl气体逸出为止。
步骤Ⅲ:将混合物转入分液漏斗中,分出有机层,水层用苯萃取两次(每次8mL)。合并有机层,有机层依次用等体积5%NaOH溶液和水洗涤,再用无水MgSO4干燥。
步骤Ⅳ:将苯乙酮粗产品放入蒸馏烧瓶中,先在水浴上蒸馏回收苯,稍冷后改用空气冷凝管,蒸馏收集198~202℃的馏分,得到产品约4.20g。
(1)仪器A选用的规格为___________ ,仪器B中的出水口是___________ (“a”或“b”)。
A.10mL B.50mL C.200mL
(2)图一装置中CaCl2的作用是___________ 。
(3)步聚I发生的反应是强烈的放热反应,控制温度是该步骤的关键,试从试剂投入、装置改进方面,分别提出一条控温的措施:①___________ ;②___________ 。
(4)图一装置中漏斗一半扣在水面下、一半露在水面上的原因是___________ 。
(5)步聚Ⅲ中,水层用苯萃取两次(每次8mL),而不是取一次(16mL)的目的是___________ 。
(6)步骤Ⅳ中蒸馏收集苯乙酮产品时,改用空气冷凝管的原因是___________ 。
(7)本实验为收集产品用了减压蒸馏装置,如图二所示,其中毛细管的作用是___________ 。

| 名称 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/ g∙cm-3 | 溶解度 |
| 乙酸酐 | 102 | -73 | 140 | 1.082 | 微溶于水,易水解 |
| 苯 | 78 | 5.5 | 80.5 | 0.879 | 不溶于水 |
| 苯乙酮 | 120 | 20.5 | 202 | 1.028 | 微溶于水 |
步骤Ⅰ:向仪器A中迅速加入13g粉状无水AlCl3和
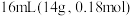 无水苯,在搅拌下将
无水苯,在搅拌下将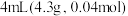 乙酸酐慢慢滴加到A中,待反应缓和后,加热回流1小时,直至无HCl气体逸出为止。
乙酸酐慢慢滴加到A中,待反应缓和后,加热回流1小时,直至无HCl气体逸出为止。
步骤Ⅲ:将混合物转入分液漏斗中,分出有机层,水层用苯萃取两次(每次8mL)。合并有机层,有机层依次用等体积5%NaOH溶液和水洗涤,再用无水MgSO4干燥。
步骤Ⅳ:将苯乙酮粗产品放入蒸馏烧瓶中,先在水浴上蒸馏回收苯,稍冷后改用空气冷凝管,蒸馏收集198~202℃的馏分,得到产品约4.20g。
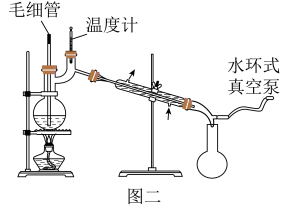
(1)仪器A选用的规格为
A.10mL B.50mL C.200mL
(2)图一装置中CaCl2的作用是
(3)步聚I发生的反应是强烈的放热反应,控制温度是该步骤的关键,试从试剂投入、装置改进方面,分别提出一条控温的措施:①
(4)图一装置中漏斗一半扣在水面下、一半露在水面上的原因是
(5)步聚Ⅲ中,水层用苯萃取两次(每次8mL),而不是取一次(16mL)的目的是
(6)步骤Ⅳ中蒸馏收集苯乙酮产品时,改用空气冷凝管的原因是
(7)本实验为收集产品用了减压蒸馏装置,如图二所示,其中毛细管的作用是
您最近一年使用:0次
解题方法
5 . 金属钛用途广泛。从海水中提取Mg和 ,并联合用以钛铁矿(主要含
,并联合用以钛铁矿(主要含 和
和 、
、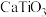 、
、 等杂质)为原料冶炼钛单质,其主要工艺流程如下:
等杂质)为原料冶炼钛单质,其主要工艺流程如下: 的形式存在于溶液中,
的形式存在于溶液中, 易水解为偏钛酸
易水解为偏钛酸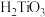 ,
,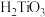 可写作
可写作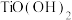 。
。
(1)试剂①通常选煅烧的贝壳粉而不用 的原因是
的原因是_____ 。
(2)试剂②为_____ 。
(3)“沉降分离”出的滤渣成分有_____ 。
(4)已知绿矾的溶解度随温度变化的曲线如图所示,从溶液Ⅰ获得绿矾的操作方法为_____ 、_____ ,过滤、洗涤、干燥。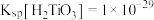 ,若要让
,若要让 水解完全(离子浓度小于
水解完全(离子浓度小于 ),应控制
),应控制 不低于
不低于_____ 。
(6)反应①除生成 外还生成一种可燃性气体,该反应的化学方程式为
外还生成一种可燃性气体,该反应的化学方程式为_____ ,“高温氯化”反应理论计算结果显示,在200℃条件下达到平衡时, 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于200℃,其原因是
,但实际生产中反应温度却远高于200℃,其原因是_____ (写一种)。
(7)该工艺流程中可以循环使用的物质有_____ 。
 ,并联合用以钛铁矿(主要含
,并联合用以钛铁矿(主要含 和
和 、
、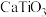 、
、 等杂质)为原料冶炼钛单质,其主要工艺流程如下:
等杂质)为原料冶炼钛单质,其主要工艺流程如下: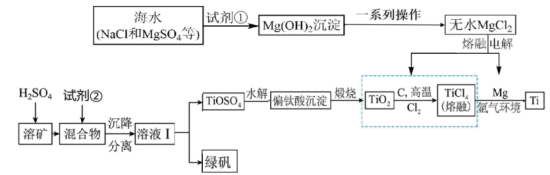
 的形式存在于溶液中,
的形式存在于溶液中, 易水解为偏钛酸
易水解为偏钛酸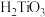 ,
,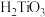 可写作
可写作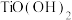 。
。(1)试剂①通常选煅烧的贝壳粉而不用
 的原因是
的原因是(2)试剂②为
(3)“沉降分离”出的滤渣成分有
(4)已知绿矾的溶解度随温度变化的曲线如图所示,从溶液Ⅰ获得绿矾的操作方法为
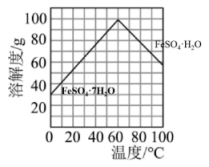
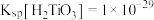 ,若要让
,若要让 水解完全(离子浓度小于
水解完全(离子浓度小于 ),应控制
),应控制 不低于
不低于(6)反应①除生成
 外还生成一种可燃性气体,该反应的化学方程式为
外还生成一种可燃性气体,该反应的化学方程式为 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于200℃,其原因是
,但实际生产中反应温度却远高于200℃,其原因是(7)该工艺流程中可以循环使用的物质有
您最近一年使用:0次
解题方法
6 . 硫酸四氨合铜晶体( )常用作杀虫剂、媒染剂。已知:常温下
)常用作杀虫剂、媒染剂。已知:常温下 受热易分解,在空气中会水解生成铜的碱式盐;在溶液中存在以下电离过程:
受热易分解,在空气中会水解生成铜的碱式盐;在溶液中存在以下电离过程: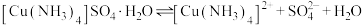 。现以废铜屑(表面沾有油污)为原料制备
。现以废铜屑(表面沾有油污)为原料制备 的实验步骤如下:
的实验步骤如下: 的制备
的制备
(1)步骤①中采取“碱煮水洗”,“碱”是指一种钠盐,其化学式是_____ 。
(2)步骤②在常温下进行,需要加入的试剂有稀 和另一种液态试剂,发生的化学反应方程式为
和另一种液态试剂,发生的化学反应方程式为_____ 。
Ⅱ.晶体的制备
将上述制备的 溶液加入装置A中,滴加
溶液加入装置A中,滴加 氨水时,有浅蓝色沉淀
氨水时,有浅蓝色沉淀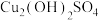 生成;继续滴加氨水,沉淀消失,得到深蓝色
生成;继续滴加氨水,沉淀消失,得到深蓝色 溶液。将A中溶液转移至B中,析出
溶液。将A中溶液转移至B中,析出 晶体;将B中混合物转移至装置C中抽滤(减压过滤),用乙醇洗涤晶体2~3次;取出晶体,冷风吹干。
晶体;将B中混合物转移至装置C中抽滤(减压过滤),用乙醇洗涤晶体2~3次;取出晶体,冷风吹干。_____ 。
(4)抽滤时,抽气泵处于工作状态,活塞需_____ (填“打开”或“关闭”),作用是_____ 。
(5)使用下列试剂可代替乙醇来促进 晶体析出的有
晶体析出的有_____ 。(填标号)
a.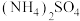 b.稀氨水 c.
b.稀氨水 c. d.
d. 溶液
溶液
(6)晶体采用冷风吹干而不用加热烘干的原因是_____ 。
Ⅲ.废液回收
减压过滤后的废液中含有 、乙醇和氨水,向废液中加入硫酸,回收乙醇并获得
、乙醇和氨水,向废液中加入硫酸,回收乙醇并获得 和的混合溶液。
和的混合溶液。
(7) 溶液受热易分解,则回收乙醇的实验方法为
溶液受热易分解,则回收乙醇的实验方法为_____ 。
 )常用作杀虫剂、媒染剂。已知:常温下
)常用作杀虫剂、媒染剂。已知:常温下 受热易分解,在空气中会水解生成铜的碱式盐;在溶液中存在以下电离过程:
受热易分解,在空气中会水解生成铜的碱式盐;在溶液中存在以下电离过程: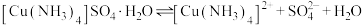 。现以废铜屑(表面沾有油污)为原料制备
。现以废铜屑(表面沾有油污)为原料制备 的实验步骤如下:
的实验步骤如下: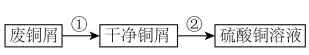
 的制备
的制备(1)步骤①中采取“碱煮水洗”,“碱”是指一种钠盐,其化学式是
(2)步骤②在常温下进行,需要加入的试剂有稀
 和另一种液态试剂,发生的化学反应方程式为
和另一种液态试剂,发生的化学反应方程式为Ⅱ.晶体的制备
将上述制备的
 溶液加入装置A中,滴加
溶液加入装置A中,滴加 氨水时,有浅蓝色沉淀
氨水时,有浅蓝色沉淀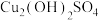 生成;继续滴加氨水,沉淀消失,得到深蓝色
生成;继续滴加氨水,沉淀消失,得到深蓝色 溶液。将A中溶液转移至B中,析出
溶液。将A中溶液转移至B中,析出 晶体;将B中混合物转移至装置C中抽滤(减压过滤),用乙醇洗涤晶体2~3次;取出晶体,冷风吹干。
晶体;将B中混合物转移至装置C中抽滤(减压过滤),用乙醇洗涤晶体2~3次;取出晶体,冷风吹干。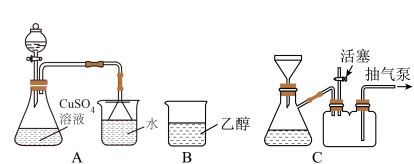
(4)抽滤时,抽气泵处于工作状态,活塞需
(5)使用下列试剂可代替乙醇来促进
 晶体析出的有
晶体析出的有a.
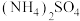 b.稀氨水 c.
b.稀氨水 c. d.
d. 溶液
溶液(6)晶体采用冷风吹干而不用加热烘干的原因是
Ⅲ.废液回收
减压过滤后的废液中含有
 、乙醇和氨水,向废液中加入硫酸,回收乙醇并获得
、乙醇和氨水,向废液中加入硫酸,回收乙醇并获得 和的混合溶液。
和的混合溶液。(7)
 溶液受热易分解,则回收乙醇的实验方法为
溶液受热易分解,则回收乙醇的实验方法为
您最近一年使用:0次
7 . 下列装置中能达到实验目的的是
A.灼烧 固体制得 固体制得 | B.定量测定化学反应速率 |
|
|
| C.保存液溴 | D.除去 中的HCl 中的HCl |
|
|
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
8 . 环己酮缩乙二醇( ,常温时为液体)常用于日用化学品中,也用作有机合成的中间体。实验室利用环己酮和乙二醇反应可以制备环己酮缩乙二醇,反应原理如下:
,常温时为液体)常用于日用化学品中,也用作有机合成的中间体。实验室利用环己酮和乙二醇反应可以制备环己酮缩乙二醇,反应原理如下:

Ⅰ.按图示装置(加热装置已省略),向烧瓶中加入26.7mL(0.3mol)乙二醇、20.7mL(0.2mol)环已酮、35ml苯、5gSnCl2·2H2O(s),加热回流0.75h;

Ⅲ.将滤液蒸馏,收集174~180℃的馏分,得粗产品环已酮缩乙二醇,粗产品经精馏提纯得产品24.2g。
回答下列问题:
(1)根据上述实验药品的用量,圆底烧瓶的最适宜规格为___________(填字母)。
| A.100ml | B.250mL | C.500mL | D.1000mL |
(2)苯的作用是
(3)当观察到分水器中
(4)下列仪器在步骤Ⅲ中不需要使用的是

 )和乙二醇,则得到的有机产物的结构简式为
)和乙二醇,则得到的有机产物的结构简式为(6)检验粗产品中是否含有乙二醇的化学方法是
(7)产品的产率为
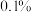 )。
)。
您最近一年使用:0次
2024-05-15更新
|
186次组卷
|
2卷引用:2024届内蒙古乌海市第六中学高三下学期第二次临模考试理科综合试题-高中化学
名校
9 . 钪是一种稀土金属元素,在国防、航天、核能等领域具有重要应用。氯化钪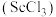 是制备钪的重要原料。工业上利用固体废料“赤泥”(含
是制备钪的重要原料。工业上利用固体废料“赤泥”(含 、
、 、
、 、
、 、
、 等)制取
等)制取 的流程如图。
的流程如图。 难溶于盐酸;②草酸可与多种金属离子形成可溶性络合物。
难溶于盐酸;②草酸可与多种金属离子形成可溶性络合物。
回答下列问题:
(1)酸浸中,滤渣的主要成分是_______ (填化学式), 溶解的离子反应方程式为
溶解的离子反应方程式为_______ 。
(2)“步骤Ⅰ”中加入 后选择合适试剂调pH,再将溶液加热煮沸一段时间,加热煮沸的目的是
后选择合适试剂调pH,再将溶液加热煮沸一段时间,加热煮沸的目的是_______ 。
(3)草酸用量过多时,钪的沉淀率反而下降,原因是_______ 。
(4)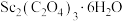 在空气中加热分解时,
在空气中加热分解时,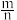 %随温度变化如图所示。
%随温度变化如图所示。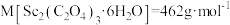 。
。
250℃时固体的主要成分是:_______ (填化学式)。
(5)传统制备 的方法是先得到
的方法是先得到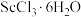 沉淀,再高温脱水得
沉淀,再高温脱水得 ,但通常含有
,但通常含有 杂质,原因是
杂质,原因是_______ 。
(6)“加热氯化”过程主要发生反应的化学方程式为:_______ 。
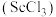 是制备钪的重要原料。工业上利用固体废料“赤泥”(含
是制备钪的重要原料。工业上利用固体废料“赤泥”(含 、
、 、
、 、
、 、
、 等)制取
等)制取 的流程如图。
的流程如图。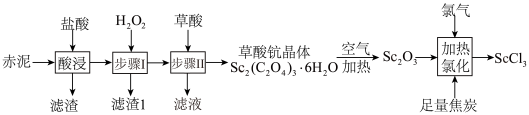
 难溶于盐酸;②草酸可与多种金属离子形成可溶性络合物。
难溶于盐酸;②草酸可与多种金属离子形成可溶性络合物。回答下列问题:
(1)酸浸中,滤渣的主要成分是
 溶解的离子反应方程式为
溶解的离子反应方程式为(2)“步骤Ⅰ”中加入
 后选择合适试剂调pH,再将溶液加热煮沸一段时间,加热煮沸的目的是
后选择合适试剂调pH,再将溶液加热煮沸一段时间,加热煮沸的目的是(3)草酸用量过多时,钪的沉淀率反而下降,原因是
(4)
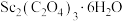 在空气中加热分解时,
在空气中加热分解时,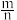 %随温度变化如图所示。
%随温度变化如图所示。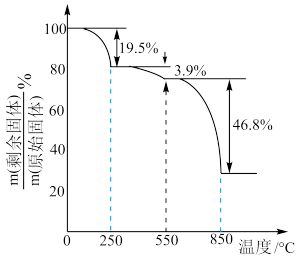
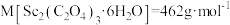 。
。250℃时固体的主要成分是:
(5)传统制备
 的方法是先得到
的方法是先得到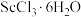 沉淀,再高温脱水得
沉淀,再高温脱水得 ,但通常含有
,但通常含有 杂质,原因是
杂质,原因是(6)“加热氯化”过程主要发生反应的化学方程式为:
您最近一年使用:0次
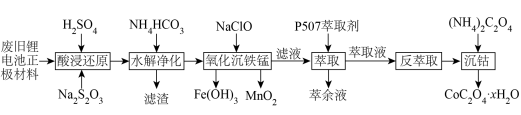
10 . 近年来,废旧锂离子电池的回收成为目前新能源产业重要的发展方向。某锂离子二次电池的正极材料主要为LiCoO2,还含有少量Al、Fe、Mn、Ni的化合物。通过如图所示的流程利用废旧锂离子电池制备草酸钴晶体(CoC2O4·xH2O),回答下列问题:
(1)LiCoO2中Co的化合价为___________ ,“酸浸还原”中LiCoO2转化为(Co2+,氧化产物是SO2,该反应中氧化剂与还原剂的物质的量之比为___________ 。
(2)“水解净化”的滤渣主要成分为___________ (填化学式)。
(3)“氧化沉铁锰”的操作为控制体系的pH在4~5,加入NaClO溶液。其中Mn2+转化为MnO2的离子方程式为___________ ;实际生产中,随着反应时间的延长,锰和铁的沉淀率逐渐增大,但钴的损失量也随之增大,可能的原因是___________ 。
(4)利用“P507萃取剂”从“滤液”中分离Co2+萃取时,Co、Ni的萃取率和Co/Ni分离因素与水相pH的关系如图所示。
(5)“沉钴”时反应的化学方程式为___________ 。
| 离子 | Co2+ | Fe3+ | Fe2+ | Al3+ | Mn2+ | Ni2+ |
| pH | 9.3 | 3.2 | 9.0 | 4.7 | 10.1 | 8.9 |
(1)LiCoO2中Co的化合价为
(2)“水解净化”的滤渣主要成分为
(3)“氧化沉铁锰”的操作为控制体系的pH在4~5,加入NaClO溶液。其中Mn2+转化为MnO2的离子方程式为
(4)利用“P507萃取剂”从“滤液”中分离Co2+萃取时,Co、Ni的萃取率和Co/Ni分离因素与水相pH的关系如图所示。
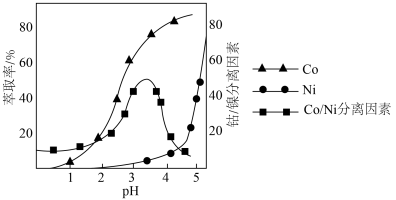
| A.2.5 | B.3.0 | C.3.5 | D.4.0 |
(5)“沉钴”时反应的化学方程式为
您最近一年使用:0次
2024-05-08更新
|
168次组卷
|
3卷引用:2024届内蒙古自治区赤峰市高三下学期三模理科综合试题-高中化学