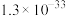名校
解题方法
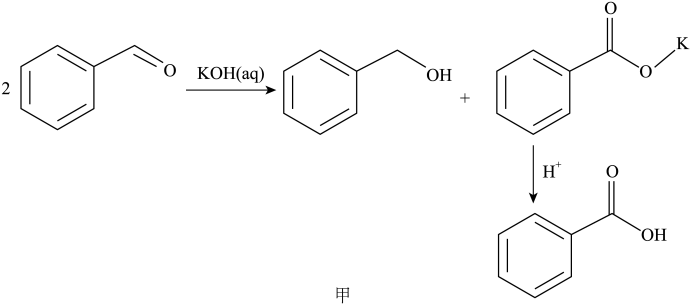
1 . 某小组设计实验制备苯甲酸:
【原理】
 苯甲醛(新蒸),
苯甲醛(新蒸),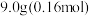 氢氧化钾,乙醚,
氢氧化钾,乙醚, 碳酸钠溶液,浓盐酸。
碳酸钠溶液,浓盐酸。
【资料】
乙醚的密度为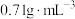 ,乙醚沸点为34.5℃。苯甲醛沸点为179℃。
,乙醚沸点为34.5℃。苯甲醛沸点为179℃。
【步骤】
①在锥形瓶中将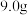 氢氧化钾溶于
氢氧化钾溶于 水配成溶液,冷却至室温后,加入
水配成溶液,冷却至室温后,加入 新蒸馏过的苯甲醛。用橡胶塞塞紧瓶口,用力振摇,使反应物充分混合,最后成为白色糊状物,放置
新蒸馏过的苯甲醛。用橡胶塞塞紧瓶口,用力振摇,使反应物充分混合,最后成为白色糊状物,放置 以上。
以上。
②向反应混合物中逐滴加入足量的水(约 ),不断振摇使其中的苯甲酸盐全部溶解。将溶液倒入分液漏斗,每次用
),不断振摇使其中的苯甲酸盐全部溶解。将溶液倒入分液漏斗,每次用 乙醚萃取三次。合并乙醚萃取液,依次用饱和亚硫酸氢钠溶液、10%碳酸钠溶液及水洗涤,最后加入无水硫酸镁或无水碳酸钾,过滤。
乙醚萃取三次。合并乙醚萃取液,依次用饱和亚硫酸氢钠溶液、10%碳酸钠溶液及水洗涤,最后加入无水硫酸镁或无水碳酸钾,过滤。
③过滤后蒸馏,收集204~206℃的馏分。
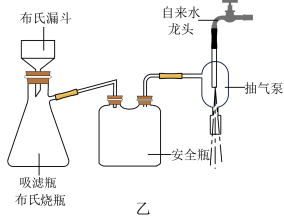
④乙醚萃取后的水溶液,用浓盐酸酸化。充分冷却使苯甲酸析出完全,抽滤,如图乙所示。粗产品用水重结晶,得苯甲酸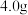 。
。
(1)苯甲醇中最多有___________ 个原子共平面。
(2)乙醚萃取时分离有机相部分操作如下,正确的先后顺序为___________ (填标号);分离乙醚相的具体操作是___________ 。
a.振荡,放气 b.加入萃取剂 c.静置、分层 d.分液
(3)乙醚溶液依次用饱和 溶液、
溶液、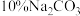 溶液洗涤,其目的依次是
溶液洗涤,其目的依次是___________ 、___________ 。
(4)乙醚萃取后的水溶液,用浓盐酸酸化到中性是否最恰当?___________ (填“最恰当”或“不恰当”),理由是___________ 。
(5)相对普通过滤,利用图乙装置进行抽滤操作的优点主要有___________ 、___________ (答两点)。
(6)本实验的苯甲酸产率约为___________(填标号)。
【原理】
 苯甲醛(新蒸),
苯甲醛(新蒸),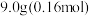 氢氧化钾,乙醚,
氢氧化钾,乙醚, 碳酸钠溶液,浓盐酸。
碳酸钠溶液,浓盐酸。【资料】
乙醚的密度为
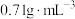 ,乙醚沸点为34.5℃。苯甲醛沸点为179℃。
,乙醚沸点为34.5℃。苯甲醛沸点为179℃。【步骤】
①在锥形瓶中将
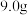 氢氧化钾溶于
氢氧化钾溶于 水配成溶液,冷却至室温后,加入
水配成溶液,冷却至室温后,加入 新蒸馏过的苯甲醛。用橡胶塞塞紧瓶口,用力振摇,使反应物充分混合,最后成为白色糊状物,放置
新蒸馏过的苯甲醛。用橡胶塞塞紧瓶口,用力振摇,使反应物充分混合,最后成为白色糊状物,放置 以上。
以上。②向反应混合物中逐滴加入足量的水(约
 ),不断振摇使其中的苯甲酸盐全部溶解。将溶液倒入分液漏斗,每次用
),不断振摇使其中的苯甲酸盐全部溶解。将溶液倒入分液漏斗,每次用 乙醚萃取三次。合并乙醚萃取液,依次用饱和亚硫酸氢钠溶液、10%碳酸钠溶液及水洗涤,最后加入无水硫酸镁或无水碳酸钾,过滤。
乙醚萃取三次。合并乙醚萃取液,依次用饱和亚硫酸氢钠溶液、10%碳酸钠溶液及水洗涤,最后加入无水硫酸镁或无水碳酸钾,过滤。③过滤后蒸馏,收集204~206℃的馏分。
④乙醚萃取后的水溶液,用浓盐酸酸化。充分冷却使苯甲酸析出完全,抽滤,如图乙所示。粗产品用水重结晶,得苯甲酸
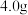 。
。
(1)苯甲醇中最多有
(2)乙醚萃取时分离有机相部分操作如下,正确的先后顺序为
a.振荡,放气 b.加入萃取剂 c.静置、分层 d.分液
(3)乙醚溶液依次用饱和
 溶液、
溶液、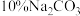 溶液洗涤,其目的依次是
溶液洗涤,其目的依次是(4)乙醚萃取后的水溶液,用浓盐酸酸化到中性是否最恰当?
(5)相对普通过滤,利用图乙装置进行抽滤操作的优点主要有
(6)本实验的苯甲酸产率约为___________(填标号)。
A. | B. | C.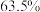 | D. |
您最近一年使用:0次
名校
解题方法
2 . 随着全球可充电锂离子电池退役高峰期的到来,从锂离子电池中回收有价值的元素引起了人们的极大关注。一种从锂离子电池的废 正极材料中分离锂、锰的工艺流程如图所示。
正极材料中分离锂、锰的工艺流程如图所示。
(1)正极材料 中
中 元素的平均化合价为
元素的平均化合价为_____ , 的空间结构名称为
的空间结构名称为___ 。
(2)“还原焙烧”过程中的氧化产物是一种环境友好型气体,锰元素转化为水溶性的 和
和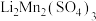 ,则该反应的化学方程式为
,则该反应的化学方程式为_______ 。
(3)“选择性氨浸”过程中,锰元素通过如下过程沉淀分离:
Ⅰ. 电离产生
电离产生 :
: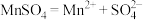 。
。
Ⅱ. 水解生成
水解生成 :
: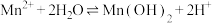 。
。
Ⅲ. 被氧化为
被氧化为 :该反应的化学方程式为
:该反应的化学方程式为_______ ,通过对氧化还原电位和 的检测,得出反应需以
的检测,得出反应需以 的速率向氨水中通入空气,以增大电位,最终实现锂、锰的高效分离。请从平衡移动角度分析通入空气的作用
的速率向氨水中通入空气,以增大电位,最终实现锂、锰的高效分离。请从平衡移动角度分析通入空气的作用_______ 。
(4)“结晶Ⅰ”所得晶体的主要成分为_______ (填化学式)。
(5)从废 正极材料中分离锂、锰的工艺流程中,能够循环利用的物质是
正极材料中分离锂、锰的工艺流程中,能够循环利用的物质是_______ 。
(6)“选择性氨浸”的浸出液中,锂元素的浸出率接近100%,而锰元素在浸出液中的含量从 降至
降至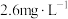 ,实现了锂、锰的有效分离。则锰元素的沉淀率为
,实现了锂、锰的有效分离。则锰元素的沉淀率为_______ 。
 正极材料中分离锂、锰的工艺流程如图所示。
正极材料中分离锂、锰的工艺流程如图所示。
(1)正极材料
 中
中 元素的平均化合价为
元素的平均化合价为 的空间结构名称为
的空间结构名称为(2)“还原焙烧”过程中的氧化产物是一种环境友好型气体,锰元素转化为水溶性的
 和
和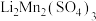 ,则该反应的化学方程式为
,则该反应的化学方程式为(3)“选择性氨浸”过程中,锰元素通过如下过程沉淀分离:
Ⅰ.
 电离产生
电离产生 :
: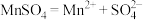 。
。Ⅱ.
 水解生成
水解生成 :
: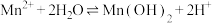 。
。Ⅲ.
 被氧化为
被氧化为 :该反应的化学方程式为
:该反应的化学方程式为 的检测,得出反应需以
的检测,得出反应需以 的速率向氨水中通入空气,以增大电位,最终实现锂、锰的高效分离。请从平衡移动角度分析通入空气的作用
的速率向氨水中通入空气,以增大电位,最终实现锂、锰的高效分离。请从平衡移动角度分析通入空气的作用(4)“结晶Ⅰ”所得晶体的主要成分为
(5)从废
 正极材料中分离锂、锰的工艺流程中,能够循环利用的物质是
正极材料中分离锂、锰的工艺流程中,能够循环利用的物质是(6)“选择性氨浸”的浸出液中,锂元素的浸出率接近100%,而锰元素在浸出液中的含量从
 降至
降至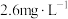 ,实现了锂、锰的有效分离。则锰元素的沉淀率为
,实现了锂、锰的有效分离。则锰元素的沉淀率为
您最近一年使用:0次
3 . 以废旧镍氢电池的金属电极芯[主要成分为 和
和 ,还含有少量铁、铝的氧化物]为原料回收钴、镍的化合物,流程如图:
,还含有少量铁、铝的氧化物]为原料回收钴、镍的化合物,流程如图:
②酸性条件下的氧化性: >
> 。
。
回答下列问题:
(1)“氧化”时 作
作_____ (填“氧化剂”或“还原剂”,下同),“浸出”时 作
作______ 。
(2)写出“沉钴1”中 转化为
转化为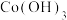 的离子方程式:
的离子方程式:_______ 。
(3)设计“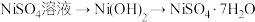 ”的目的是
”的目的是_______ 。
(4)“沉钴2”中发生反应的离子方程式为_______ ,_______ (填“能”或“不能”)用 替代
替代 ,理由是
,理由是_______ 。
(5)设计实验检验 是否洗净:
是否洗净:_______ 。
(6)水溶液中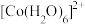 、
、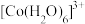 的颜色与分裂能大小有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能。d轨道分裂能:
的颜色与分裂能大小有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能。d轨道分裂能: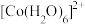
_______ (填“>”“<”或“=”)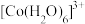 。
。
(7)镍单质晶胞有两种形式,如图所示。已知:图1晶胞棱长为acm,图2中晶胞底边长为bcm,高为ccm。图1、图2(正六棱柱)镍晶体密度之比为_______ 。
 和
和 ,还含有少量铁、铝的氧化物]为原料回收钴、镍的化合物,流程如图:
,还含有少量铁、铝的氧化物]为原料回收钴、镍的化合物,流程如图:
| 离子 |  |  |  |  |  |  |
| 开始沉淀的pH | 6.3 | 1.5 | 3.4 | 6.2 | 7.2 | |
| 完全沉淀的pH | 8.3 | 2.8 | 4.7 | 8.9 | 9.2 | 1.1 |
 >
> 。
。回答下列问题:
(1)“氧化”时
 作
作 作
作(2)写出“沉钴1”中
 转化为
转化为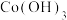 的离子方程式:
的离子方程式:(3)设计“
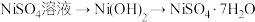 ”的目的是
”的目的是(4)“沉钴2”中发生反应的离子方程式为
 替代
替代 ,理由是
,理由是(5)设计实验检验
 是否洗净:
是否洗净:(6)水溶液中
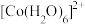 、
、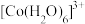 的颜色与分裂能大小有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能。d轨道分裂能:
的颜色与分裂能大小有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能。d轨道分裂能: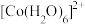
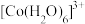 。
。(7)镍单质晶胞有两种形式,如图所示。已知:图1晶胞棱长为acm,图2中晶胞底边长为bcm,高为ccm。图1、图2(正六棱柱)镍晶体密度之比为

您最近一年使用:0次
7日内更新
|
40次组卷
|
3卷引用:2024届河北省保定市九县一中高三下学期三模化学试题
解题方法
4 . 下列除杂试剂和分离方法都正确的是
| 选项 | 物质(括号内为杂质) | 除杂试剂 | 分离方法 |
| A |  ( ( ) ) | 饱和碳酸钠溶液 | 洗气 |
| B |  [ [ ] ] | 适量浓氨水 | 过滤 |
| C | 乙酸乙酯(乙酸) | 饱和NaOH溶液 | 分液 |
| D |  ( ( ) ) | 适量 溶液 溶液 | 过滤 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
5 . 铼(Re)是一种贵金属。一种以辉钼矿(主要含有 ,还含有少量
,还含有少量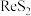 、
、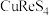 、FeS、
、FeS、 等)为原料制备铼的工艺流程如图:
等)为原料制备铼的工艺流程如图: 、
、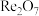 、
、 、CuO、
、CuO、 ,其中
,其中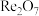 、
、 与氨水反应分别生成
与氨水反应分别生成 、
、 。下列说法错误的是
。下列说法错误的是
 ,还含有少量
,还含有少量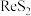 、
、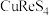 、FeS、
、FeS、 等)为原料制备铼的工艺流程如图:
等)为原料制备铼的工艺流程如图:
 、
、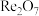 、
、 、CuO、
、CuO、 ,其中
,其中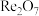 、
、 与氨水反应分别生成
与氨水反应分别生成 、
、 。下列说法错误的是
。下列说法错误的是A.废气中含有 |
B.滤渣的主要成分为 、CuO、 、CuO、 |
C.浸出时发生的反应有 |
| D.实验室用烧杯、漏斗、玻璃棒即可完成重结晶操作 |
您最近一年使用:0次
7日内更新
|
303次组卷
|
3卷引用:河北省保定市名校协作体2024届高三下学期三模化学试题
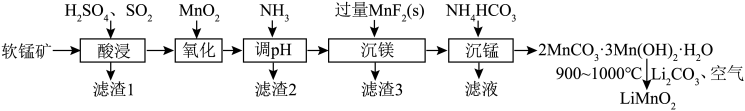
6 . 层状LiMnO2在电动车、空间技术等范畴具有十分广阔的应用前景。LiMnO2可由软锰矿(主要成分是MnO2,含少量Fe2O3、Al2O3、SiO2、MgO等)制备,其制备流程如图:
回答下列问题:
(1) LiMnO2中锰元素的化合价为______ ;“酸浸”后过滤,所得滤液中主要含有的金属阳离子有______ 。
(2)为了提高“酸浸”的浸取速率,可采取的措施有______ (写出两点)。
(3)“氧化”步骤需要加入过量MnO2,该步反应的离子方程式为______ 。
(4)常温下,“调pH”后溶液pH=5,则滤渣2的主要成分是______ 。
(5)滤渣3与浓H2SO4反应可以释放HF,同时得到的副产物是______ 。
(6)测定 LiMnO2样品中锰含量:取10g LiMnO2样品,粉碎后加入浓盐酸、30%H2O2溶液,充分反应,生成Mn(Ⅱ)。加入蒸馏水标定溶液体积为250mL,移取25mL后加入KB指示剂,用0.15mol/L的EDTA标准溶液滴定,平均消耗60mL标准溶液。样品中锰含量为______ %(已知:EDTA与Mn2+反应的化学计量数之比为1∶1)。
物质 |
|
|
|
|
|
|
|
|
|
|
|
(1) LiMnO2中锰元素的化合价为
(2)为了提高“酸浸”的浸取速率,可采取的措施有
(3)“氧化”步骤需要加入过量MnO2,该步反应的离子方程式为
(4)常温下,“调pH”后溶液pH=5,则滤渣2的主要成分是
(5)滤渣3与浓H2SO4反应可以释放HF,同时得到的副产物是
(6)测定 LiMnO2样品中锰含量:取10g LiMnO2样品,粉碎后加入浓盐酸、30%H2O2溶液,充分反应,生成Mn(Ⅱ)。加入蒸馏水标定溶液体积为250mL,移取25mL后加入KB指示剂,用0.15mol/L的EDTA标准溶液滴定,平均消耗60mL标准溶液。样品中锰含量为
您最近一年使用:0次
2024-06-04更新
|
273次组卷
|
5卷引用:2024届河北省部分高中高三下学期二模化学试题
2024届河北省部分高中高三下学期二模化学试题(已下线)T16-工业流程题2024届河南省周口市西华县第一高级中学高三下学期信息押题模拟训练理综卷(3)-高中化学2024届河南省许昌部分高中高三下学期模拟考试(三)理科综合试题-高中化学(已下线)2024届四川省成都外国语学校高三下学期冲刺练习(五)理科综合试题-高中化学
名校
7 . 微型化学实验是在保证化学反应过程质量的前提下,以尽可能少的试剂,来获取所需化学信息的实验原理与技术,是增强化学学习兴趣的催化剂。下列化学实验正确的是
|
|
| A.用于除去碳酸钠中混有的碳酸氢钠 | B.用于实验室模拟工业炼铁 |
|
|
| C.用于碱式滴定管的检漏 | D. (夹持及加热装置略)从b通入冷凝水用于除去碘中混有的 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
8 . 三氯乙醛是无色易挥发油状液体,有刺激性气味,易溶于乙醇、乙醚和氯仿,能与水化合生成三氯乙醛水合物,易被 氧化生成
氧化生成 。可用于制造滴滴涕、敌百虫、敌敌畏等杀虫剂、三氯乙醛脲除草剂。医药上用于生产氯霉素、合霉素等。实验室设计如下图所示装置,测定
。可用于制造滴滴涕、敌百虫、敌敌畏等杀虫剂、三氯乙醛脲除草剂。医药上用于生产氯霉素、合霉素等。实验室设计如下图所示装置,测定 样品的质量分数,并用制得的
样品的质量分数,并用制得的 在
在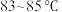 下乙醇制备少量三氯乙醛。
下乙醇制备少量三氯乙醛。_______ ,A中发生反应的化学方程式为_______ 。
(2)装置D、G内所盛试剂的作用为_______ ,导气管a的作用是_______ 。
(3)标准状况下,测定 样品的质量分数时,若实验前后集气管中液面读数分别为
样品的质量分数时,若实验前后集气管中液面读数分别为 、
、 ,则
,则 样品的质量分数的表达式为
样品的质量分数的表达式为_______ (无需化简)。
(4)该实验装置中三通阀的孔路位置如下所示,测定 样品的质量分数时调节为
样品的质量分数时调节为_______ ,制备少量三氯乙醛时三通阀的孔路调节为_______ ,并将水准管向_______ (填“上”或“下”)移动,使 进入右侧装置。
进入右侧装置。_______ ,仪器b中冷凝水下进上出的目的是_______ ,由于实验过程中可能会生成 等杂质,从F中分离出
等杂质,从F中分离出 ,需要进行蒸馏操作,蒸馏时不能选用仪器b的原因是
,需要进行蒸馏操作,蒸馏时不能选用仪器b的原因是_______ 。
(6)装置H的作用是吸收过量的 ,其离子方程式为
,其离子方程式为_______ ,下列装置中能代替装置H的是_______ (错选、漏选均不得分)。
 氧化生成
氧化生成 。可用于制造滴滴涕、敌百虫、敌敌畏等杀虫剂、三氯乙醛脲除草剂。医药上用于生产氯霉素、合霉素等。实验室设计如下图所示装置,测定
。可用于制造滴滴涕、敌百虫、敌敌畏等杀虫剂、三氯乙醛脲除草剂。医药上用于生产氯霉素、合霉素等。实验室设计如下图所示装置,测定 样品的质量分数,并用制得的
样品的质量分数,并用制得的 在
在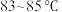 下乙醇制备少量三氯乙醛。
下乙醇制备少量三氯乙醛。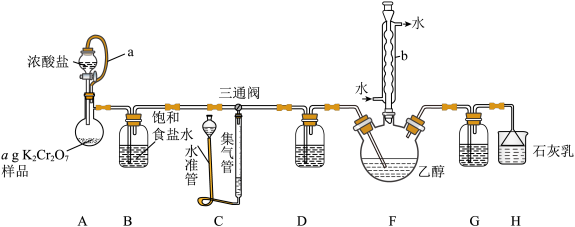
(2)装置D、G内所盛试剂的作用为
(3)标准状况下,测定
 样品的质量分数时,若实验前后集气管中液面读数分别为
样品的质量分数时,若实验前后集气管中液面读数分别为 、
、 ,则
,则 样品的质量分数的表达式为
样品的质量分数的表达式为(4)该实验装置中三通阀的孔路位置如下所示,测定
 样品的质量分数时调节为
样品的质量分数时调节为 进入右侧装置。
进入右侧装置。A. B.
B. C.
C. D.
D.
 等杂质,从F中分离出
等杂质,从F中分离出 ,需要进行蒸馏操作,蒸馏时不能选用仪器b的原因是
,需要进行蒸馏操作,蒸馏时不能选用仪器b的原因是(6)装置H的作用是吸收过量的
 ,其离子方程式为
,其离子方程式为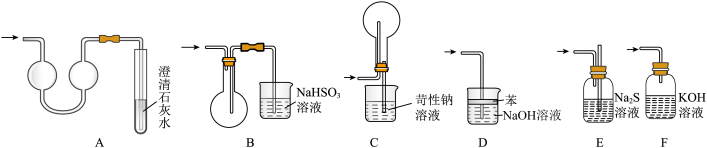
您最近一年使用:0次
名校
9 . 某含钪废水中,除了含有 外,还含有一定量的
外,还含有一定量的 、
、 ,以含钪废水为主要原料制备
,以含钪废水为主要原料制备 的工艺流程如下图所示,下列说法正确的是
的工艺流程如下图所示,下列说法正确的是
 外,还含有一定量的
外,还含有一定量的 、
、 ,以含钪废水为主要原料制备
,以含钪废水为主要原料制备 的工艺流程如下图所示,下列说法正确的是
的工艺流程如下图所示,下列说法正确的是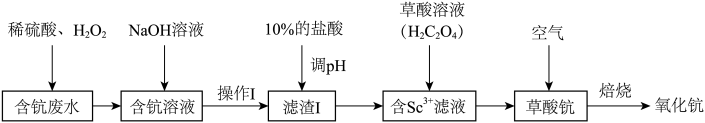
| A.为了加快操作1的速率,应该用玻璃棒不断搅拌 |
B.滤渣1中含有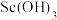 、 、 、 、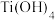 ,加入盐酸后,沉淀溶解得到含 ,加入盐酸后,沉淀溶解得到含 、 、 和 和 的滤液 的滤液 |
| C.实验室模拟“焙烧”操作的仪器:酒精灯、铁三脚架、泥三角、坩埚、玻璃棒 |
D.“焙烧”时发生反应: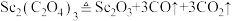 |
您最近一年使用:0次
名校
10 . 酸性条件下,砷酸具有较强氧化性,能被正四价硫、碘离子等还原为正三价砷。某工厂以废渣(主要含 )制备砷的流程如下:
)制备砷的流程如下:
(1)砷的原子结构示意图为_______ 。 的结构简式为
的结构简式为 ,0.5mol
,0.5mol  所含有S-S键的物质的量为
所含有S-S键的物质的量为_______ mol。
(2)“碱浸”后溶液中含有 、
、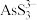 ,则该工序主反应的化学方程式为
,则该工序主反应的化学方程式为______________ 。
(3)“沉砷”时,加入试剂A的作用为_______ ;结合必要的化学用语说明为了提高 的产率,加石灰乳时控制温度45℃~85℃的目的是
的产率,加石灰乳时控制温度45℃~85℃的目的是_______ 。
(4)滤渣1含硫酸钙和沉淀a,实验室里,用_______ 试剂除去试管壁上的沉淀a。
(5)加热时“再还原”的化学方程式为_______ 。“还原”中,氧化产物与还原产物的物质的量之比为_______ 。
(6)该流程中可以循环使用的物质为_______ 。
(7)设计实验检验“还原”后的溶液中是否存在正五价砷元素_______ 。
 )制备砷的流程如下:
)制备砷的流程如下: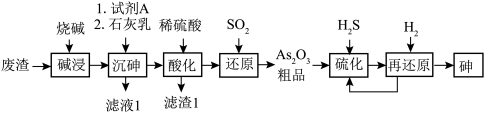
(1)砷的原子结构示意图为
 的结构简式为
的结构简式为 ,0.5mol
,0.5mol  所含有S-S键的物质的量为
所含有S-S键的物质的量为(2)“碱浸”后溶液中含有
 、
、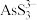 ,则该工序主反应的化学方程式为
,则该工序主反应的化学方程式为(3)“沉砷”时,加入试剂A的作用为
 的产率,加石灰乳时控制温度45℃~85℃的目的是
的产率,加石灰乳时控制温度45℃~85℃的目的是(4)滤渣1含硫酸钙和沉淀a,实验室里,用
(5)加热时“再还原”的化学方程式为
(6)该流程中可以循环使用的物质为
(7)设计实验检验“还原”后的溶液中是否存在正五价砷元素
您最近一年使用:0次
2024-06-03更新
|
79次组卷
|
2卷引用:2024届河北省沧州市沧县中学高三下学期三模化学试题