1 . 下列说法不正确 的是
| A.用pH试纸检验某干燥气体的酸碱性时,一定要先用蒸馏水湿润 |
| B.烧瓶、烧杯、锥形瓶在酒精灯上加热时,都需要要垫石棉网,以防仪器炸裂 |
| C.焰色反应时,透过蓝色钴玻璃,观察到火焰颜色为紫色,证明被检物是钾盐 |
| D.35Cl与37Cl互为同位素 |
您最近一年使用:0次
名校
解题方法
2 . 某兴趣小组研究铁盐的制备和性质。
实验I.制备FeCl2:装置如图所示(加持装置省略);已知FeCl2极易水解。
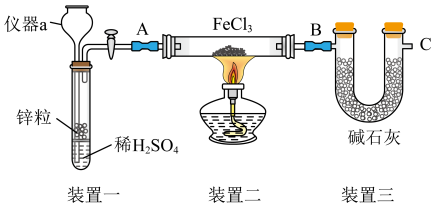
(1)仪器a的名称是_______ 。
(2)装置二中制备FeCl2的化学方程式是_____ ,装置三的作用是①_____ ;②_____ 。
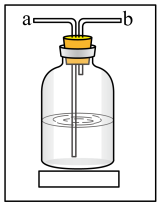
(3)该装置存在一定的缺陷,可在_______ 位置(填“A”“B”或“C”)增加如下装置。如下装置中气体从_______ (填“a”或“b”)流入;洗气瓶中盛装的是_______ 。
(4)为消除工业废气中的Cl2对环境的污染,将废气通过含有铁粉的FeCl2溶液,即可有效地除去Cl2,用离子方程式表示处理过程的原理_______ 。
实验Ⅱ.探究性质
(5) FeCl2溶液滴加NaOH溶液后会出现灰绿色沉淀,有同学猜测灰绿色沉淀是Fe(OH)2和Fe(OH)3的混合物。为探究是否存在Fe(OH)2,可取灰绿色沉淀,向其中加入_______ 溶液,再加入_______ 溶液,若观察到_______ 现象,证明灰绿色沉淀中含有Fe(OH)2。
实验I.制备FeCl2:装置如图所示(加持装置省略);已知FeCl2极易水解。

(1)仪器a的名称是
(2)装置二中制备FeCl2的化学方程式是
(3)该装置存在一定的缺陷,可在

(4)为消除工业废气中的Cl2对环境的污染,将废气通过含有铁粉的FeCl2溶液,即可有效地除去Cl2,用离子方程式表示处理过程的原理
实验Ⅱ.探究性质
(5) FeCl2溶液滴加NaOH溶液后会出现灰绿色沉淀,有同学猜测灰绿色沉淀是Fe(OH)2和Fe(OH)3的混合物。为探究是否存在Fe(OH)2,可取灰绿色沉淀,向其中加入
您最近一年使用:0次
名校
解题方法
3 . 为探究FeCl3溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
(1)用pH计测得某FeCl3溶液的pH=0.70,加入下列试剂,能使该FeCl3溶液pH升高的是_______ 。
a.水 b. FeCl3固体 c.浓盐酸 d. NaHCO3固体
蒸发FeCl3溶液并灼烧最终得到的固体产物是_______ 。
(2)利用上述FeCl3溶液探究其与镁粉的反应原理。实验操作及现象如下表:
①用离子方程式解释现象b:_______ 。
②取少量反应后的溶液,滴入2滴_______ (写化学式)溶液,出现蓝色沉淀即可证明有Fe2+生成。写出生成Fe2+的离子方程式:_______ 。
(3)镁和FeCl3溶液反应后溶液中 浓度的测定
浓度的测定
i.将反应瓶中的溶液过滤并调节溶液的pH在6.5~10.5;
ii.取20.00mL滤液加水稀释至100ml
iii.另取稀释后滤液20.00ml,加入K2CrO4溶液作指示剂,用c AgNO3标准溶液滴定滤液中的
AgNO3标准溶液滴定滤液中的 至终点,重复操作3次,平均消耗AgNO3溶液VmL。已知Ag+与
至终点,重复操作3次,平均消耗AgNO3溶液VmL。已知Ag+与 生成砖红色沉淀指示滴定终点。
生成砖红色沉淀指示滴定终点。
①滴定时,盛装AgNO3标准溶液的滴定管应选用_______ (填玻璃仪器名称)。
②计算原滤液中 浓度为
浓度为_______ (用代数式表示)。
(4)探究FeCl3溶液与Na2SO3溶液发生氧化还原反应
查阅资料可知,Na2SO3具有还原性,FeCl3具有氧化性,可以设计成原电池。用下图装置(a、b均为石墨电极)进行实验。闭合开关后灵敏电流计指针偏转,电极a附近溶液颜色变浅
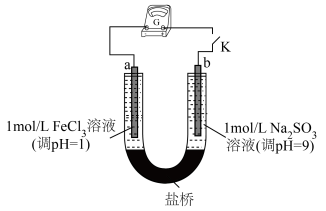
写出正极的电极反应式_______ 。一段时间后负极区pH_______ 9(填“<”、“=”、“>”)。
(1)用pH计测得某FeCl3溶液的pH=0.70,加入下列试剂,能使该FeCl3溶液pH升高的是
a.水 b. FeCl3固体 c.浓盐酸 d. NaHCO3固体
蒸发FeCl3溶液并灼烧最终得到的固体产物是
(2)利用上述FeCl3溶液探究其与镁粉的反应原理。实验操作及现象如下表:
| 操作 | 现象 |
| 先向反应瓶中注入50mL上述FeCl3溶液,再加入镁粉,搅拌。 | a.出现红褐色沉淀 b.有大量气泡 c.镁粉逐渐溶解、溶液变为浅绿色 |
②取少量反应后的溶液,滴入2滴
(3)镁和FeCl3溶液反应后溶液中
 浓度的测定
浓度的测定i.将反应瓶中的溶液过滤并调节溶液的pH在6.5~10.5;
ii.取20.00mL滤液加水稀释至100ml
iii.另取稀释后滤液20.00ml,加入K2CrO4溶液作指示剂,用c
 AgNO3标准溶液滴定滤液中的
AgNO3标准溶液滴定滤液中的 至终点,重复操作3次,平均消耗AgNO3溶液VmL。已知Ag+与
至终点,重复操作3次,平均消耗AgNO3溶液VmL。已知Ag+与 生成砖红色沉淀指示滴定终点。
生成砖红色沉淀指示滴定终点。①滴定时,盛装AgNO3标准溶液的滴定管应选用
②计算原滤液中
 浓度为
浓度为(4)探究FeCl3溶液与Na2SO3溶液发生氧化还原反应
查阅资料可知,Na2SO3具有还原性,FeCl3具有氧化性,可以设计成原电池。用下图装置(a、b均为石墨电极)进行实验。闭合开关后灵敏电流计指针偏转,电极a附近溶液颜色变浅

写出正极的电极反应式
您最近一年使用:0次
名校
4 . 某化学兴趣小组同学利用如图所示装置(夹持及加热装置已略去,装置气密性良好)探究SO2的性质(实验前已事先除去装置中的空气)。请回答下列问题:
(1)仪器a的名称_________ 。
(2)装置D和F的作用是_________ 。
(3)加热时,装置A中反应的化学方程式__________ 。
(4)打开K1,关闭K2,加热装置A一段时间后,装置B中的现象是___________ ,若要证明其过程是可逆的,还需要的操作是______________ 。

(1)仪器a的名称
(2)装置D和F的作用是
(3)加热时,装置A中反应的化学方程式
(4)打开K1,关闭K2,加热装置A一段时间后,装置B中的现象是
您最近一年使用:0次
解题方法
5 . 用如图实验装置进行相应实验,能达到实验目的的是


A.用①装置称量一定质量的  固体 固体 |
| B.用②制备氢氧化亚铁沉淀 |
C.用③证明  能溶于水或与 能溶于水或与  溶液反应 溶液反应 |
D.用④装置备  胶体 胶体 |
您最近一年使用:0次
名校
6 . 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
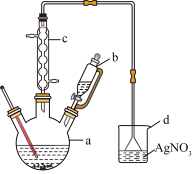
按下列合成步骤回答问题:
(1)在a中加入7.8g无水苯和少量铁屑。向a中小心加入10mL液态溴。a中发生反应的方程式为___________ 。
(2)装置c的作用为___________ 。此装置能否证明反应为取代反应___________ (能或不能),若不能,提出改进方法___________ 。
(3)反应完成后,经过下列步骤分离提纯:①水洗②用10%NaOH溶液洗③水洗④用干燥剂干燥⑤蒸馏,以上分离操作,蒸馏的目的是___________ 。
①蒸馏烧瓶中的碎瓷片若忘记加,该如何操作___________ 。
②蒸馏烧瓶中温度计的位置___________ ,若位置靠下会收集到沸点___________ 的杂质(较高或较低)。
③经称量,最终得到溴苯6.28g,该实验中溴苯的产率为___________ 。
| 苯 | 溴 | 溴苯 | |
| 密度/ g∙cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |

按下列合成步骤回答问题:
(1)在a中加入7.8g无水苯和少量铁屑。向a中小心加入10mL液态溴。a中发生反应的方程式为
(2)装置c的作用为
(3)反应完成后,经过下列步骤分离提纯:①水洗②用10%NaOH溶液洗③水洗④用干燥剂干燥⑤蒸馏,以上分离操作,蒸馏的目的是
①蒸馏烧瓶中的碎瓷片若忘记加,该如何操作
②蒸馏烧瓶中温度计的位置
③经称量,最终得到溴苯6.28g,该实验中溴苯的产率为
您最近一年使用:0次
7 . 下列所选仪器或操作符合实验要求的是
| A | B | C | D |
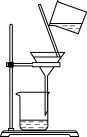 | 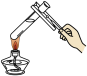 |  | 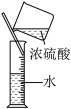 |
| 分离蛋白质胶体和蔗糖溶液 | 给液体加热 | 证明CO2能否溶于水或与NaOH溶液反应 | 稀释浓硫酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-10-15更新
|
316次组卷
|
3卷引用:江苏省南京市六校联合体2023-2024学年高一上学期10月联合调研化学试题
8 . 下列有关化学实验基本知识和基本操作的描述正确的是
| A.“日照澄洲江雾开”,指日光加热使雾的颗粒聚沉 |
| B.过滤和蒸发操作均用到玻璃棒,但玻璃棒的作用不相同 |
C.加入盐酸,能产生使澄清石灰水变浑浊的气体,则溶液中一定含有 |
D.加入 溶液产生白色沉淀,证明含大量的 溶液产生白色沉淀,证明含大量的 |
您最近一年使用:0次
9 . 海洋是一个巨大的化学资源宝库,利用海洋资源进行如下实验。
实验(一)海水提溴:空气吹出法是工业规模提溴的常用方法,其流程如图:

(1)“吹出法”提溴是利用了溴的___________ 性。工业上进行第③④⑤步操作的目的是___________ 。
(2)若步骤④中通入960gSO2,则理论上可产出___________ molBr2,实际产出Br2的质量为1920g,则实际产量Br2的产率为___________ (产率= ×100%)。
×100%)。
实验(二)从海洋植物海带中提取碘并用色度计测定了某海带样品中碘的含量。实验步骤:
I.预处理:将干海带刷净,剪成1~2cm大小的方块,准确称量3.0g样品。
Ⅱ.灰化:在仪器A中加热干海带,并用玻璃棒不断搅拌,记录加热时间,停止加热,冷却。
Ⅲ.过滤:将冷却后的海带灰转移到50mL烧杯中,加入15mL蒸馏水,静置后过滤。
IV.氧化:向滤液中加入稀H2SO4和H2O2溶液,充分反应后将滤液转移到分液漏斗中。
V.萃取:向分液漏斗中加入CCl4,振荡,静置。待溶液完全分层后,取下层溶液。
VI.含量测定:用色度计测定出所得溶液中碘的含量。
VII.回收处理:蒸馏碘的CCl4溶液,回收CCl4
已知:海带灰化后,碘元素以I-的形式存在。
(3)第Ⅱ步中的仪器A是___________ 。
(4)证明第Ⅲ步滤液中存在K+的实验方法是___________ ,实验现象是___________ 。
(5)含量测定:用色度计可测定所得溶液中碘的含量。(已知:碘浓度越大吸光度越大)
方法是:用色度计测得某碘溶液的吸光度后,利用以溶液吸光度为纵坐标、碘浓度(μg·ml-1)为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取0.10g碘单质,用100mL容量瓶配成碘的CCl4溶液,取出0.10mL加入3.90mLCCl4中配得第一份碘的标准溶液(忽略溶液混合后引起的体积改变)。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是___________ μg·ml-1。(1μg=10-6g)
(6)课题组在其他实验条件相同情况下,研究了不同灰化时间对碘提取效果的影响。其结果如图所示。灰化时间超过40min,测得碘的含量逐渐降低,原因是___________ 。(注;灰化即灼烧成灰)

实验(一)海水提溴:空气吹出法是工业规模提溴的常用方法,其流程如图:

(1)“吹出法”提溴是利用了溴的
(2)若步骤④中通入960gSO2,则理论上可产出
 ×100%)。
×100%)。实验(二)从海洋植物海带中提取碘并用色度计测定了某海带样品中碘的含量。实验步骤:
I.预处理:将干海带刷净,剪成1~2cm大小的方块,准确称量3.0g样品。
Ⅱ.灰化:在仪器A中加热干海带,并用玻璃棒不断搅拌,记录加热时间,停止加热,冷却。
Ⅲ.过滤:将冷却后的海带灰转移到50mL烧杯中,加入15mL蒸馏水,静置后过滤。
IV.氧化:向滤液中加入稀H2SO4和H2O2溶液,充分反应后将滤液转移到分液漏斗中。
V.萃取:向分液漏斗中加入CCl4,振荡,静置。待溶液完全分层后,取下层溶液。
VI.含量测定:用色度计测定出所得溶液中碘的含量。
VII.回收处理:蒸馏碘的CCl4溶液,回收CCl4
已知:海带灰化后,碘元素以I-的形式存在。
(3)第Ⅱ步中的仪器A是
(4)证明第Ⅲ步滤液中存在K+的实验方法是
(5)含量测定:用色度计可测定所得溶液中碘的含量。(已知:碘浓度越大吸光度越大)
方法是:用色度计测得某碘溶液的吸光度后,利用以溶液吸光度为纵坐标、碘浓度(μg·ml-1)为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取0.10g碘单质,用100mL容量瓶配成碘的CCl4溶液,取出0.10mL加入3.90mLCCl4中配得第一份碘的标准溶液(忽略溶液混合后引起的体积改变)。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是
(6)课题组在其他实验条件相同情况下,研究了不同灰化时间对碘提取效果的影响。其结果如图所示。灰化时间超过40min,测得碘的含量逐渐降低,原因是

您最近一年使用:0次
名校
10 . 某实验小组欲探究SO2和Cl2能否发生反应,设计如图所示的实验装置进行实验。注:已检验装置气密性,且实验前已经用氮气排净装置内的空气。
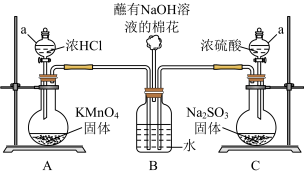
(1)图中仪器a的名称:_______ 。
(2)装置A中的反应为______KMnO4+______HCl(浓)=_____KCl+_____MnCl2+_____Cl2+_____H2O。
①配平该反应并用单线桥表示电子转移_______ 。
②反应中的氧化剂和还原剂的物质的量之比是_______ ;生成71gCl2转移的物质的量是_______ mol。
(3)装置C中反应的化学方程式是_______ 。
(4)打开装置A、C中仪器a的活塞,一段时间后关闭活塞。待反应完全后,又继续如下实验。
①甲同学取适量B中溶液于试管中,向其中滴加一滴AgNO3稀溶液,即有白色沉淀生成。甲同学由此认为SO2和Cl2发生了反应,理由是该反应中生成了______ 离子(写离子符号)。
②乙同学认为甲同学的结论不合理,认为A中生成的Cl2中混有杂质,应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法即可得到正确结论。乙同学认为Cl2中混有的杂质是_______ 。
③丙同学则认为,该白色沉淀不能证明SO2和Cl2发生反应,结合离子方程式解释原因_______ ;丙同学取适量B中溶液于试管中,向其中滴加少量溶液X,有白色沉淀生成,则可得出结论,即SO2和Cl2同时通入水中,可以发生反应。溶液X是______ (填选项序号)。
a.BaCl2溶液 b.Ba(OH)2溶液 c.Ba(NO3)2溶液 d.品红溶液
(5)SO2和Cl2同时通入水中反应的化学方程式_______ 。

(1)图中仪器a的名称:
(2)装置A中的反应为______KMnO4+______HCl(浓)=_____KCl+_____MnCl2+_____Cl2+_____H2O。
①配平该反应并用单线桥表示电子转移
②反应中的氧化剂和还原剂的物质的量之比是
(3)装置C中反应的化学方程式是
(4)打开装置A、C中仪器a的活塞,一段时间后关闭活塞。待反应完全后,又继续如下实验。
①甲同学取适量B中溶液于试管中,向其中滴加一滴AgNO3稀溶液,即有白色沉淀生成。甲同学由此认为SO2和Cl2发生了反应,理由是该反应中生成了
②乙同学认为甲同学的结论不合理,认为A中生成的Cl2中混有杂质,应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法即可得到正确结论。乙同学认为Cl2中混有的杂质是
③丙同学则认为,该白色沉淀不能证明SO2和Cl2发生反应,结合离子方程式解释原因
a.BaCl2溶液 b.Ba(OH)2溶液 c.Ba(NO3)2溶液 d.品红溶液
(5)SO2和Cl2同时通入水中反应的化学方程式
您最近一年使用:0次



