1 . 体操运动员在完成单杠、吊环项目时常用“镁粉”搓手,以起到防滑效果。某种“镁粉”中可能含有Mg、MgO、Mg(OH)2、MgCO3中的一种或两种固体,实验小组对其成分展开了探究。
已知:MgO+2HCl=MgCl2+H2O、MgCO3+2HCl=MgCl2+H2O+CO2↑。
(1)探究“镁粉”中是否含有Mg和MgCO3
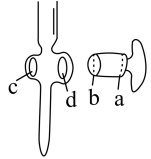
①取少量样品,如图所示进行实验。观察到a试管中有气泡产生,b试管中产生的现象是澄清石灰水变浑浊,则证明“镁粉”中一定含有______ 。
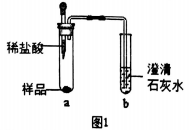
②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭。但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成浓NaOH溶液,目的是______________ 。小明按照修改后的实验方案重复上述实验,观察到b试管中无明显现象,证明“镁粉”中______________ 。
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验。分别取0.5g三种固体粉末,每次取样方法如图2所示:
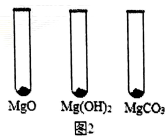
逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失。在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
Mg(OH)2与盐酸发生中和反应的化学方程式为_____________ 。
Ⅱ.取“镁粉”样品0.5g,加入上述稀盐酸至粉末恰好溶解。此时消耗稀盐酸的体积约为5.3mL。
【实验分析及结论】
“镁粉”不只含有MgCO3。理由是____________________________________ 。
【实验反思】
为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5g“镁粉”和0.5g_________ ,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL。由此可知“镁粉”中含有MgCO3的质量分数为___________ 。
已知:MgO+2HCl=MgCl2+H2O、MgCO3+2HCl=MgCl2+H2O+CO2↑。
(1)探究“镁粉”中是否含有Mg和MgCO3
①取少量样品,如图所示进行实验。观察到a试管中有气泡产生,b试管中产生的现象是澄清石灰水变浑浊,则证明“镁粉”中一定含有

②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭。但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成浓NaOH溶液,目的是
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验。分别取0.5g三种固体粉末,每次取样方法如图2所示:

逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失。在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
| MgO | Mg(OH)2 | MgCO3 | |
| 消耗稀盐酸的体积/mL | 10.4 | 7.2 | 5.0 |
Ⅱ.取“镁粉”样品0.5g,加入上述稀盐酸至粉末恰好溶解。此时消耗稀盐酸的体积约为5.3mL。
【实验分析及结论】
“镁粉”不只含有MgCO3。理由是
【实验反思】
为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5g“镁粉”和0.5g
您最近一年使用:0次
2016-12-09更新
|
480次组卷
|
3卷引用:2016届浙江省杭州市学军中学高一入学测试化学试卷
2 . 某研究小组用印刷电路板的腐蚀废液(主要含CuCl2、FeCl2、FeCl3)制备Cu(NH4)2SO4•H2O和FeCl2•4H2O。
I.制备流程图
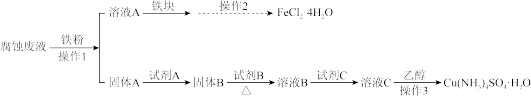
已知1.所加试剂均足量,且部分步骤有省略。
II.Cu(NH4)2SO4•H2O晶体纯度测定
①取a g Cu(NH4)2SO4•H2O晶体,加入适量1 mol·L-1稀硫酸,加热,待溶液冷却后配制成250 mL溶液。
②取25.00 mL溶液,加水50 mL,调节溶液至弱酸性(pH=3~4),加入过量20%KI溶液,避光静置几分钟。
③用c mol·L-1Na2S2O3标准溶液滴定至溶液呈淡黄色,再加入淀粉溶液,继续滴定至溶液变浅蓝色,再加入一定量10%KSCN溶液,蓝色变深,继续滴定至蓝色刚好消失,记录消耗Na2S2O3标准溶液的体积。
④平行滴定三次,消耗Na2S2O3标准溶液的平均体积为V mL。
已知2:①2Cu2++4I-=2CuI↓+I2;I2+2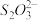 =
= +2I-。
+2I-。
②CuI和CuSCN均为白色固体;Ksp(CuI)=1.1×10-12,Ksp(CuSCN)=4.8×10-15。
请回答:
(1)下列说法正确的是____ 。
(2)测定晶体纯度时,步骤②用KI溶液测定铜含量时,需在弱酸性(pH=3~4)溶液中进行的原因____ 。
(3)下列关于滴定分析的描述,正确的是____ 。
(4)结合离子反应方程式并用必要的文字说明滴定过程中加入KSCN溶液的作用____ 。
(5)Cu(NH4)2SO4•H2O(M=246 g•mol-1)晶体样品的纯度为____ %(用含a、c、V的代数式表示)。
I.制备流程图
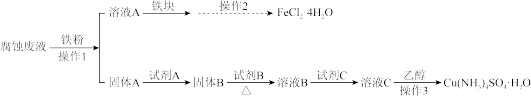
已知1.所加试剂均足量,且部分步骤有省略。
II.Cu(NH4)2SO4•H2O晶体纯度测定
①取a g Cu(NH4)2SO4•H2O晶体,加入适量1 mol·L-1稀硫酸,加热,待溶液冷却后配制成250 mL溶液。
②取25.00 mL溶液,加水50 mL,调节溶液至弱酸性(pH=3~4),加入过量20%KI溶液,避光静置几分钟。
③用c mol·L-1Na2S2O3标准溶液滴定至溶液呈淡黄色,再加入淀粉溶液,继续滴定至溶液变浅蓝色,再加入一定量10%KSCN溶液,蓝色变深,继续滴定至蓝色刚好消失,记录消耗Na2S2O3标准溶液的体积。
④平行滴定三次,消耗Na2S2O3标准溶液的平均体积为V mL。
已知2:①2Cu2++4I-=2CuI↓+I2;I2+2
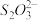 =
= +2I-。
+2I-。②CuI和CuSCN均为白色固体;Ksp(CuI)=1.1×10-12,Ksp(CuSCN)=4.8×10-15。
请回答:
(1)下列说法正确的是
| A.操作2通过蒸发至出现晶膜后趁热过滤,快速冷却滤液结晶,可得较大FeCl2•4H2O晶体 |
| B.可用KSCN或K3[Fe(CN)6]溶液检验FeCl2•4H2O晶体中是否存在杂质Fe3+ |
| C.溶液C中加入乙醇可以降低Cu(NH4)2SO4•H2O在溶剂中的溶解性,促进晶体析出 |
| D.溶液B中逐滴滴加试剂C至过量的过程中先出现蓝色沉淀后变为深蓝色溶液,这一现象可以说明与Cu2+结合能力大小为:NH3>OH->H2O |
(3)下列关于滴定分析的描述,正确的是
| A.加入过量20%KI溶液可以增大I2的溶解性,减少实验滴定误差 |
| B.Na2S2O3标准溶液应盛放在碱式滴定管中 |
| C.滴定时,眼睛应一直观察滴定管中溶液体积的变化 |
| D.若滴定恰好完全时,滴定管尖端悬半滴未滴下,会导致测定结果偏低 |
(5)Cu(NH4)2SO4•H2O(M=246 g•mol-1)晶体样品的纯度为
您最近一年使用:0次
解题方法
3 . 无水醋酸镁为白色粉末,易潮解,易溶于水,熔点323℃,熔融时同时分解,常用作烯烃聚合催化剂,制备方法如下。
制法一:将80%醋酸用水稀释后,水浴加热至60~ 80℃,在搅拌下分批少量加入碳酸镁至CO2不再逸出为止,继续加热,趁热过滤。在滤液中补充适量醋酸,......,得到四水醋酸镁晶体,....,.即得无水醋酸镁
(1)碳酸镁需分批少量加入,理由是____________________ 。
(2)滤液中补充适量醋酸的目的是_____________________ 。
(3)从下列提供的操作中选择必要的操作(可重复使用),将制法一中“……”处的步骤补充完整,正确的顺序是_________ ,_______ 。 (填编号)

制法二 :将六水硝酸镁与醋酸酐混合加热,发生反应:(具体步骤略去)
2Mg(NO3)2•6H2O+ 14(CH3CO )2O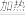 2Mg(CH3COO )2+ 4NO 2↑+ O2↑+24CH3COOH
2Mg(CH3COO )2+ 4NO 2↑+ O2↑+24CH3COOH
(4)用七水硫酸镁代替六水硝酸镁按相同操作进行制备实验,无法得到产品,原因是__________________ 。
(5)以铬黑T(BET)为指示剂 ,用 EDTA测定Mg2+含量的原理用方程式可表示为:
EDTA (无色)+Mg-BET (紫红)= BET (蓝色)+ Mg-EDTA (无色)
为测定产品纯度,称取试样0.3000 g 于锥形瓶中,加入100ml 蒸馏水,待完全溶解后加入l 0mLpH=l 0的氨-氯化铁缓冲溶液,溶液变浑浊,再滴加3~ 4 滴铬黑 T 指示剂 (BET),用0. l 000mol∙L-1的 EDTA标准溶液滴定至终点,重复上述操作两次平均消耗 EDTA 标准溶液 20.50mL。
①滴定终点的现象为_______________ 。
②产品中镁元素的质量分数为________ (保留四位有效数字)。
(6)下列关于该实验的操作或分析 ,正确的是__________ (填编号)。
A. 用倾析法将固液混合物转移至布氏漏斗中进行抽滤时,先转移溶液再转移沉淀
B. 称取一定质量的产品时,若电子天平未调整水平,则称得的产品偏多
C. 开始滴定前,滴定管尖悬挂的液滴需擦去,否则可能引起结果偏低
D. 根据(5)的测定方法可知,Mg(OH)2可溶于EDTA溶液
制法一:将80%醋酸用水稀释后,水浴加热至60~ 80℃,在搅拌下分批少量加入碳酸镁至CO2不再逸出为止,继续加热,趁热过滤。在滤液中补充适量醋酸,......,得到四水醋酸镁晶体,....,.即得无水醋酸镁
(1)碳酸镁需分批少量加入,理由是
(2)滤液中补充适量醋酸的目的是
(3)从下列提供的操作中选择必要的操作(可重复使用),将制法一中“……”处的步骤补充完整,正确的顺序是

制法二 :将六水硝酸镁与醋酸酐混合加热,发生反应:(具体步骤略去)
2Mg(NO3)2•6H2O+ 14(CH3CO )2O
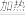 2Mg(CH3COO )2+ 4NO 2↑+ O2↑+24CH3COOH
2Mg(CH3COO )2+ 4NO 2↑+ O2↑+24CH3COOH(4)用七水硫酸镁代替六水硝酸镁按相同操作进行制备实验,无法得到产品,原因是
(5)以铬黑T(BET)为指示剂 ,用 EDTA测定Mg2+含量的原理用方程式可表示为:
EDTA (无色)+Mg-BET (紫红)= BET (蓝色)+ Mg-EDTA (无色)
为测定产品纯度,称取试样0.3000 g 于锥形瓶中,加入100ml 蒸馏水,待完全溶解后加入l 0mLpH=l 0的氨-氯化铁缓冲溶液,溶液变浑浊,再滴加3~ 4 滴铬黑 T 指示剂 (BET),用0. l 000mol∙L-1的 EDTA标准溶液滴定至终点,重复上述操作两次平均消耗 EDTA 标准溶液 20.50mL。
①滴定终点的现象为
②产品中镁元素的质量分数为
(6)下列关于该实验的操作或分析 ,正确的是
A. 用倾析法将固液混合物转移至布氏漏斗中进行抽滤时,先转移溶液再转移沉淀
B. 称取一定质量的产品时,若电子天平未调整水平,则称得的产品偏多
C. 开始滴定前,滴定管尖悬挂的液滴需擦去,否则可能引起结果偏低
D. 根据(5)的测定方法可知,Mg(OH)2可溶于EDTA溶液
您最近一年使用:0次
13-14高三·浙江·开学考试
4 . 某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。
利用下图所示装置进行实验。

(1)装置①的作用是___________ 装置③的作用是___________ 。
(2)装置②中产生ClO2的化学方程式为___________ 。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③___________ ;④低于60℃干燥,得到成品。
(4)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是:取少量晶体溶于蒸馏水,___________ 。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO + 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用c mol•L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O =2I-+S4O
=2I-+S4O )。
)。
(5)滴定中使用的指示剂是___________ ,达到滴定终点时的现象为___________ 。
(6)样品中NaClO2的质量分数为___________ (用含m、c、V的代数式表示,式量:NaClO2 90.5)。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。
利用下图所示装置进行实验。

(1)装置①的作用是
(2)装置②中产生ClO2的化学方程式为
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③
(4)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是:取少量晶体溶于蒸馏水,
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO
 + 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。②移取25.00mL待测溶液于锥形瓶中,用c mol•L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O
 =2I-+S4O
=2I-+S4O )。
)。(5)滴定中使用的指示剂是
(6)样品中NaClO2的质量分数为
您最近一年使用:0次
2019-01-30更新
|
432次组卷
|
3卷引用:2015届浙江省重点中学协作体高考摸底测试理科综合化学试卷
5 . 邻苯二甲酰亚胺(PIMD)是一种重要的亚胺,是Gabriel合成法制备胺的原料。某实验室模拟氨水法以邻苯二甲酸酐为原料制备PIMD。
反应原理:
实验装置如图:
相关物质的物理性质如表:
实验步骤:
I.向250mL三颈烧瓶中加入74.0g邻苯二甲酸酐,边搅拌边滴入50.0mL浓氨水(稍过量),加热至80℃-95℃,待固体完全溶解后停止加热。将三颈烧瓶右端口所连装置取下改为蒸馏装置,继续加热,将溶液中的水及过量的氨蒸馏回收,此时烧瓶中有白色固体析出。
Ⅱ.继续升温至235℃-240℃,固体熔化,反应60分钟后,停止加热。冷却至室温,热水洗涤固体、抽滤、烘干,得到粗品白色粉末72.2g。
Ⅲ.向白色粉末中加入适量乙醇,加热回流使固体恰好溶解, ,将滤液降温冷却,有白色晶体析出,抽滤、洗涤、烘干后得白色晶体59.2g。
请回答下列问题:
(1)仪器A的名称为______ ,仪器A中盛装的试剂是______ 。(填标号)
a.碱石灰 b.五氧化二磷 c.浓硫酸
(2)步骤Ⅱ所得粗品中的杂质主要为________ 。
(3)邻苯二甲酸酐的熔沸点远低于邻苯二甲酰亚胺,原因可能是________ 。
(4)步骤Ⅲ的目的是利用重结晶进一步提纯邻苯二甲酰亚胺,该步骤中划线部分应补全的操作是______ 。选择乙醇作为提纯溶剂的主要原因是_______ 。
(5)本实验中邻苯二甲酰亚胺的产率最接近于______ 。(填标号)
a.85% b.80% c.75% d.70%
(6)邻苯二甲酰亚胺还可以用由邻二甲苯与氨气、氧气在加热条件下催化反应一步制得,写出该反应的化学方程式:________ 。
反应原理:

实验装置如图:

相关物质的物理性质如表:
| 物质 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 邻苯二甲酸酐 | 148 | 131~134 | 284 | 不溶于冷水,微溶于热水,稍溶于乙醇 |
| 邻苯二甲酰亚胺 | 147 | 232~235 | 366 | 微溶于热水,易溶于乙醇,易溶于碱溶液 |
I.向250mL三颈烧瓶中加入74.0g邻苯二甲酸酐,边搅拌边滴入50.0mL浓氨水(稍过量),加热至80℃-95℃,待固体完全溶解后停止加热。将三颈烧瓶右端口所连装置取下改为蒸馏装置,继续加热,将溶液中的水及过量的氨蒸馏回收,此时烧瓶中有白色固体析出。
Ⅱ.继续升温至235℃-240℃,固体熔化,反应60分钟后,停止加热。冷却至室温,热水洗涤固体、抽滤、烘干,得到粗品白色粉末72.2g。
Ⅲ.向白色粉末中加入适量乙醇,加热回流使固体恰好溶解, ,将滤液降温冷却,有白色晶体析出,抽滤、洗涤、烘干后得白色晶体59.2g。
请回答下列问题:
(1)仪器A的名称为
a.碱石灰 b.五氧化二磷 c.浓硫酸
(2)步骤Ⅱ所得粗品中的杂质主要为
(3)邻苯二甲酸酐的熔沸点远低于邻苯二甲酰亚胺,原因可能是
(4)步骤Ⅲ的目的是利用重结晶进一步提纯邻苯二甲酰亚胺,该步骤中划线部分应补全的操作是
(5)本实验中邻苯二甲酰亚胺的产率最接近于
a.85% b.80% c.75% d.70%
(6)邻苯二甲酰亚胺还可以用由邻二甲苯与氨气、氧气在加热条件下催化反应一步制得,写出该反应的化学方程式:
您最近一年使用:0次
6 . 某兴趣小组设计如图实验装置制备次磷酸钠(NaH2PO2)。
已知:①白磷(P4)在空气中可自燃,与过量烧碱溶液混合,80~90℃时反应生成NaH2PO2和PH3。
②PH3是一种有强还原性的有毒气体,空气中可自燃,可与NaClO溶液反应生成NaH2PO2。

请回答:
(1)①仪器a的名称是___________ 。
②仪器b组成的装置的作用是___________ 。
(2)检查装置气密性后,应先打开K通入N2一段时间,目的是________ 。
(3)仪器c中充分反应后生成NaH2PO2和NaCl,经过一系列操作可获得固体NaH2PO2。相关物质的溶解度(S)如下:
从下列选项中选择合理的仪器和操作,补全如下步骤。[“___________”上填写一件最关键仪器,“( )”内填写一种操作,均用字母表示]。
取仪器c中溶液,用蒸发皿(___________ )→用___________ (趁热过滤)→用烧杯(冷却结晶)→用漏斗(过滤得到NaH2PO2)→洗涤→干燥→NaH2PO2粗产品。
仪器:d.普通三角漏斗;e.铜制保温漏斗;
操作:f.蒸发浓缩至有大量晶体析出;g.蒸发浓缩至溶液表面出现晶膜。
(4)下列有关说法不正确的是___________。
(5)产品纯度测定:取产品x g配成100 mL溶液,取10 mL于锥形瓶中,酸化后加入50 mL0.1000 mol/L的NH4Fe(SO4)2溶液,以邻二氮菲做指示剂,再用0.1000 mol/L的硫酸铈滴定至终点,平均消耗V mL。相关反应的离子方程式为:H2O+H2PO +2Fe3+=H2PO
+2Fe3+=H2PO +2Fe2++2H+、Ce4++Fe2+=Ce3++Fe3+,产品纯度表达式为
+2Fe2++2H+、Ce4++Fe2+=Ce3++Fe3+,产品纯度表达式为___________ (用含x、V的式子表示)。
已知:①白磷(P4)在空气中可自燃,与过量烧碱溶液混合,80~90℃时反应生成NaH2PO2和PH3。
②PH3是一种有强还原性的有毒气体,空气中可自燃,可与NaClO溶液反应生成NaH2PO2。

请回答:
(1)①仪器a的名称是
②仪器b组成的装置的作用是
(2)检查装置气密性后,应先打开K通入N2一段时间,目的是
(3)仪器c中充分反应后生成NaH2PO2和NaCl,经过一系列操作可获得固体NaH2PO2。相关物质的溶解度(S)如下:
| S(25℃) | S(100℃) | |
| NaCl | 37 | 39 |
| NaH2PO2 | 100 | 667 |
取仪器c中溶液,用蒸发皿(
仪器:d.普通三角漏斗;e.铜制保温漏斗;
操作:f.蒸发浓缩至有大量晶体析出;g.蒸发浓缩至溶液表面出现晶膜。
(4)下列有关说法不正确的是___________。
| A.次磷酸(H3PO2)是三元酸 |
| B.为加快反应速率,投料前应先在通风橱内将白磷碾成薄片状 |
| C.反应结束后应继续通入N2一段时间,可提高NaH2PO2产率 |
| D.d中所盛硫酸铜溶液可用酸性高锰酸钾溶液代替 |
(5)产品纯度测定:取产品x g配成100 mL溶液,取10 mL于锥形瓶中,酸化后加入50 mL0.1000 mol/L的NH4Fe(SO4)2溶液,以邻二氮菲做指示剂,再用0.1000 mol/L的硫酸铈滴定至终点,平均消耗V mL。相关反应的离子方程式为:H2O+H2PO
 +2Fe3+=H2PO
+2Fe3+=H2PO +2Fe2++2H+、Ce4++Fe2+=Ce3++Fe3+,产品纯度表达式为
+2Fe2++2H+、Ce4++Fe2+=Ce3++Fe3+,产品纯度表达式为
您最近一年使用:0次
名校
解题方法
7 . 过氧化钙( )可用于治理赤潮、应急供氧等。已知:过氧化钙为白色或淡黄色结晶粉末,难溶于冷水,常温下干燥品很稳定。
)可用于治理赤潮、应急供氧等。已知:过氧化钙为白色或淡黄色结晶粉末,难溶于冷水,常温下干燥品很稳定。
小组甲拟选用如下装置(部分固定装置略)用钙和氧气制备过氧化钙。
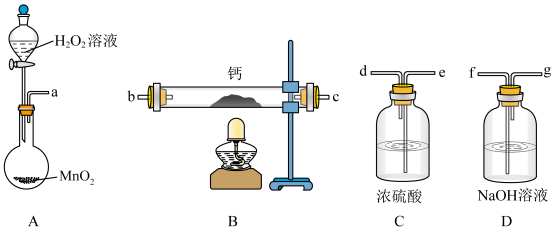
(1)请选择必要的装置(装置可重复使用),按气流方向连接顺序为______ (填仪器接口的字母编号)。
(2)过氧化钙可用于长途运输鱼苗,与此用途无关的性质是___________。
已知 在350℃时能迅速分解,生成CaO和
在350℃时能迅速分解,生成CaO和 。该小组采用如下图所示的装置(加热和固定装置略)测定所制备的产品中
。该小组采用如下图所示的装置(加热和固定装置略)测定所制备的产品中 的纯度(设杂质不分解产生气体)。
的纯度(设杂质不分解产生气体)。

(3)检查该装置气密性的方法是___________ ;
(4)使用_________ (填仪器名称)准确称取0.5000g样品,置于试管中加热使其完全分解,收集到33.60mL(标准状况)气体,则产品中过氧化钙的质量分数为________ (计算结果保留3位小数)。
(5)下列操作使得测定纯度偏高的是___________。
小组乙拟在碱性环境下制取 ,装置如图所示(部分固定装置略):
,装置如图所示(部分固定装置略):
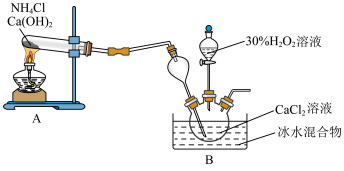
(6)上图的装置B中制取 的离子方程式为
的离子方程式为___________ ;采用冰水浴控制温度,其可能原因是___________ 、___________ 。长颈漏斗的作用___________ 。
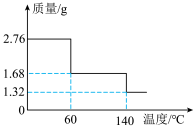
(7)2.76g 样品(含杂质)受热脱水过程的热重曲线(样品质量随温度变化曲线,140℃完全脱水,杂质受热不分解)如图所示。试确定60℃时
样品(含杂质)受热脱水过程的热重曲线(样品质量随温度变化曲线,140℃完全脱水,杂质受热不分解)如图所示。试确定60℃时 中x=
中x=___________ 。
 )可用于治理赤潮、应急供氧等。已知:过氧化钙为白色或淡黄色结晶粉末,难溶于冷水,常温下干燥品很稳定。
)可用于治理赤潮、应急供氧等。已知:过氧化钙为白色或淡黄色结晶粉末,难溶于冷水,常温下干燥品很稳定。小组甲拟选用如下装置(部分固定装置略)用钙和氧气制备过氧化钙。

(1)请选择必要的装置(装置可重复使用),按气流方向连接顺序为
(2)过氧化钙可用于长途运输鱼苗,与此用途无关的性质是___________。
| A.可缓慢供氧 | B.能吸收鱼苗呼出的 气体 气体 |
| C.能潮解 | D.可抑菌 |
已知
 在350℃时能迅速分解,生成CaO和
在350℃时能迅速分解,生成CaO和 。该小组采用如下图所示的装置(加热和固定装置略)测定所制备的产品中
。该小组采用如下图所示的装置(加热和固定装置略)测定所制备的产品中 的纯度(设杂质不分解产生气体)。
的纯度(设杂质不分解产生气体)。
(3)检查该装置气密性的方法是
(4)使用
(5)下列操作使得测定纯度偏高的是___________。
| A.反应未冷却至室温 | B.水准管液面高于量气管 |
| C.试管中留有反应生成的气体 | D.装置漏气 |
小组乙拟在碱性环境下制取
 ,装置如图所示(部分固定装置略):
,装置如图所示(部分固定装置略):
(6)上图的装置B中制取
 的离子方程式为
的离子方程式为(7)2.76g
 样品(含杂质)受热脱水过程的热重曲线(样品质量随温度变化曲线,140℃完全脱水,杂质受热不分解)如图所示。试确定60℃时
样品(含杂质)受热脱水过程的热重曲线(样品质量随温度变化曲线,140℃完全脱水,杂质受热不分解)如图所示。试确定60℃时 中x=
中x=
您最近一年使用:0次
2023-05-05更新
|
322次组卷
|
2卷引用:浙江省名校协作体2023-2024学年高二上学期开学适应性考试化学试题
解题方法
8 . 氢化亚铜为红棕色固体,不稳定,60℃时分解为金属铜和氢气,难溶于水。某研究小组实验室条件下制备CuH,流程如下:

已知:①H3PO3在空气中易氧化成H3PO4,Cu3(PO4)2溶于强酸。
②CuH + HCl = CuCl + H2↑
步骤Ⅳ实验装置图如下:

(1)反应温度控制在40℃-50℃的原因___________
(2)写出仪器A的名称___________
(3)写出流程中步骤Ⅳ的离子方程式___________
(4)下列说法正确的是___________
(5)产品纯度分析:称取氢化亚铜粗品10g,加入足量稀盐酸,充分反应(假设杂质与盐酸不反应),收集生成的氢气。
①甲、乙、丙三位同学分别以下列装置测定生成氢气的体积(其他操作正确,最终液面如下图),测得气体体积偏大是___________ (填甲、乙或丙)

②若按规范操作收集生成的氢气为VmL(已经换算成标准状况下的体积),则产品纯度为___________ 。

已知:①H3PO3在空气中易氧化成H3PO4,Cu3(PO4)2溶于强酸。
②CuH + HCl = CuCl + H2↑
步骤Ⅳ实验装置图如下:

(1)反应温度控制在40℃-50℃的原因
(2)写出仪器A的名称
(3)写出流程中步骤Ⅳ的离子方程式
(4)下列说法正确的是___________
| A.步骤Ⅰ中,加入80℃水是为了加快CuSO4· 5H2O的溶解速率 |
| B.步骤Ⅳ中,反应可用水浴加热 |
| C.步骤Ⅴ中多步操作为:过滤、洗涤、烘干 |
| D.实验得到的棕色悬浊液底部可能会有紫红色固体 |
(5)产品纯度分析:称取氢化亚铜粗品10g,加入足量稀盐酸,充分反应(假设杂质与盐酸不反应),收集生成的氢气。
①甲、乙、丙三位同学分别以下列装置测定生成氢气的体积(其他操作正确,最终液面如下图),测得气体体积偏大是

②若按规范操作收集生成的氢气为VmL(已经换算成标准状况下的体积),则产品纯度为
您最近一年使用:0次
9 . 氯化亚铜 是一种重要的化工产品,它难溶于水和乙醇,可溶于浓
是一种重要的化工产品,它难溶于水和乙醇,可溶于浓 与氨水形成的混合物,置于潮湿空气中迅速氧化为
与氨水形成的混合物,置于潮湿空气中迅速氧化为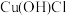 而变为绿色。实验室用酸性蚀刻液(含
而变为绿色。实验室用酸性蚀刻液(含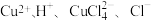 )和碱性蚀刻液[含
)和碱性蚀刻液[含 ]来制备
]来制备 ,实验过程的流程如下:
,实验过程的流程如下:
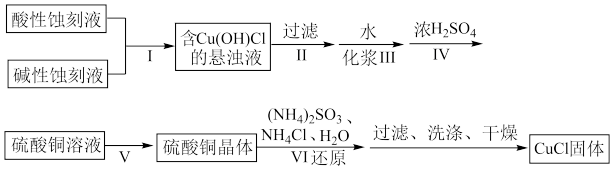
(1)步骤Ⅳ需要控制 为1~2、
为1~2、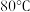 下进行,合适的加热方式是
下进行,合适的加热方式是_______ 。
(2)步骤Ⅴ为了得到较为纯净的硫酸铜晶体,根据下表中物质的溶解度(单位为g)随温度的变化,写出步骤Ⅴ得到硫酸铜晶体的操作:_______ 。
(3)写出还原过程中发生主要反应的离子方程式:_______ 。
(4)步骤Ⅵ在图装置中进行,启动磁力撒搅拌器,使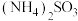 和
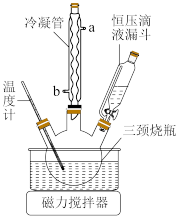
和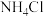 混合液缓慢滴入三颈烧瓶(提前装入硫酸铜晶体)中,控制滴加混合液速度,使所需时间不低于1小时。加完后,继续搅拌10分钟。将三颈烧瓶中的混合物进行一系列操作即可得粗产品。下列有关说法正确的是_______。
混合液缓慢滴入三颈烧瓶(提前装入硫酸铜晶体)中,控制滴加混合液速度,使所需时间不低于1小时。加完后,继续搅拌10分钟。将三颈烧瓶中的混合物进行一系列操作即可得粗产品。下列有关说法正确的是_______。
(5) 的定量分析,称取样品
的定量分析,称取样品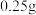 置于预先放入玻璃珠和过量
置于预先放入玻璃珠和过量 溶液的锥形瓶中,不断摇动,待样品全部溶解后,加入
溶液的锥形瓶中,不断摇动,待样品全部溶解后,加入 水、邻菲罗啉指示剂2滴,立即用
水、邻菲罗啉指示剂2滴,立即用 的硫酸铈标准液滴定至绿色出现为终点,消耗标准液
的硫酸铈标准液滴定至绿色出现为终点,消耗标准液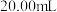 ,发生的反应为
,发生的反应为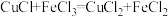 ,
, ,则
,则
①加入玻璃珠的作用是_______ 。
②下列有关上述滴定操作的说法正确的是_______ 。
A.滴定管活塞涂凡士林:取下活塞,用滤纸擦干,用手指蘸取少量凡士林涂抹一薄层在活塞a、c(如图)处的四周,平行插入活塞槽中,然后朝同一个方向转动
B.滴定开始时可以将液体成线状快速流下,接近终点时减慢滴加速度,必要时采用半滴操作
C.读数时可将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
D.第一次滴定终点时,若测得消耗标准液体积小于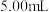 ,则第二次滴定时可稀释待测液后重新滴定来减小误差
,则第二次滴定时可稀释待测液后重新滴定来减小误差
③样品的 的质量分数为
的质量分数为_______ 。
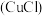 是一种重要的化工产品,它难溶于水和乙醇,可溶于浓
是一种重要的化工产品,它难溶于水和乙醇,可溶于浓 与氨水形成的混合物,置于潮湿空气中迅速氧化为
与氨水形成的混合物,置于潮湿空气中迅速氧化为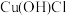 而变为绿色。实验室用酸性蚀刻液(含
而变为绿色。实验室用酸性蚀刻液(含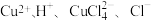 )和碱性蚀刻液[含
)和碱性蚀刻液[含 ]来制备
]来制备 ,实验过程的流程如下:
,实验过程的流程如下:
(1)步骤Ⅳ需要控制
 为1~2、
为1~2、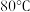 下进行,合适的加热方式是
下进行,合适的加热方式是(2)步骤Ⅴ为了得到较为纯净的硫酸铜晶体,根据下表中物质的溶解度(单位为g)随温度的变化,写出步骤Ⅴ得到硫酸铜晶体的操作:
| 温度 物质 |  | 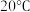 | 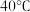 | 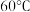 | 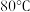 | 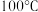 |
| 氯化铜 | 75 | 80 | 85 | 90 | 100 | 108 |
| 硫酸铜 | 12 | 18 | 30 | 50 | 60 | 87 |
(4)步骤Ⅵ在图装置中进行,启动磁力撒搅拌器,使
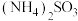 和
和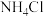 混合液缓慢滴入三颈烧瓶(提前装入硫酸铜晶体)中,控制滴加混合液速度,使所需时间不低于1小时。加完后,继续搅拌10分钟。将三颈烧瓶中的混合物进行一系列操作即可得粗产品。下列有关说法正确的是_______。
混合液缓慢滴入三颈烧瓶(提前装入硫酸铜晶体)中,控制滴加混合液速度,使所需时间不低于1小时。加完后,继续搅拌10分钟。将三颈烧瓶中的混合物进行一系列操作即可得粗产品。下列有关说法正确的是_______。
| A.装置中的温度计显示温度会迅速升高 |
B.滴加太快容易发生其他副反应,而使制得的 产品纯度下降 产品纯度下降 |
C.冷凝管上口排出的气体主要是 |
| D.该兴趣小组制备过程中产生滤液、洗涤液等要进行无害化处理后才能排放 |
 的定量分析,称取样品
的定量分析,称取样品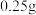 置于预先放入玻璃珠和过量
置于预先放入玻璃珠和过量 溶液的锥形瓶中,不断摇动,待样品全部溶解后,加入
溶液的锥形瓶中,不断摇动,待样品全部溶解后,加入 水、邻菲罗啉指示剂2滴,立即用
水、邻菲罗啉指示剂2滴,立即用 的硫酸铈标准液滴定至绿色出现为终点,消耗标准液
的硫酸铈标准液滴定至绿色出现为终点,消耗标准液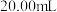 ,发生的反应为
,发生的反应为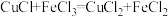 ,
, ,则
,则①加入玻璃珠的作用是
②下列有关上述滴定操作的说法正确的是

A.滴定管活塞涂凡士林:取下活塞,用滤纸擦干,用手指蘸取少量凡士林涂抹一薄层在活塞a、c(如图)处的四周,平行插入活塞槽中,然后朝同一个方向转动
B.滴定开始时可以将液体成线状快速流下,接近终点时减慢滴加速度,必要时采用半滴操作
C.读数时可将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
D.第一次滴定终点时,若测得消耗标准液体积小于
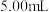 ,则第二次滴定时可稀释待测液后重新滴定来减小误差
,则第二次滴定时可稀释待测液后重新滴定来减小误差③样品的
 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
10 . 苯乙酮得用于制香皂和香烟,也用作纤维素酯和树脂等的溶剂和塑料工业生产中的增塑剂等。实验室用Friedel—Craffs酰基化反应制苯乙酮的原理如下: +(CH3CO)2O
+(CH3CO)2O
 +CH3COOH。反应过程中有HCl气体产生,尾气用NaOH溶液吸收。
+CH3COOH。反应过程中有HCl气体产生,尾气用NaOH溶液吸收。

【实验步骤】
步骤一:向装有10mL分液漏斗、机械搅拌装置和回流装置(上端通过氯化钙干燥管与氯化氢气体吸收装置相连)的100mL仪器A中迅速加入13g(0.097mol)粉状无水三氯化铝和16mL(约14g,0.18mol)无水苯。在搅拌下将4mL(约4.3g,0.04mol)醋酸肝自分液漏斗慢慢滴加到A(先加几滴,待反应发生后再继续滴加),控制醋酸的滴加速度以使A稍热为宜。加完后(约10min),待反应稍和缓后在沸水浴中搅拌回流,直到不再有氯化氢气体逸出为止。
步骤二:反应结束,将A中的液体倒入冷水中,经处理得到较纯净的苯乙酮。
步骤三:经称重苯乙酮产量约为4.1g,计算产率。
已知在常压下:
(1)图一装置中仪器A名称是___ 。
(2)图一装置中漏斗一半扣在水面下、一半露在水面上的原因是___ 。
(3)制备过程中为什么要逐渐地滴加醋酸酐?___ 。
(4)图一装置中CaCl2的作用是___ 。
(5)步骤二为得到较纯净的苯乙酮,需要经过下列的操作:①蒸馏收集某温度下的馏分;②依次用10%的NaOH溶液、水洗分液;③用无水MgSO4干燥并过滤;④水层用苯萃取合并有机层;⑤分液。正确的顺序是___ (填字母代号)。
(6)本实验为收集产品用了减压蒸馏装置,如图二所示。装置中温度计水银球的位置是否正确?___ (“是”或“否”)。收集产品,需要控制一定温度,可能是___ (填字母代号)。
A.202℃B.220℃C.175℃
(7)经计算,该反应的产率为____ (保留两位有效数)。
 +(CH3CO)2O
+(CH3CO)2O
 +CH3COOH。反应过程中有HCl气体产生,尾气用NaOH溶液吸收。
+CH3COOH。反应过程中有HCl气体产生,尾气用NaOH溶液吸收。
【实验步骤】
步骤一:向装有10mL分液漏斗、机械搅拌装置和回流装置(上端通过氯化钙干燥管与氯化氢气体吸收装置相连)的100mL仪器A中迅速加入13g(0.097mol)粉状无水三氯化铝和16mL(约14g,0.18mol)无水苯。在搅拌下将4mL(约4.3g,0.04mol)醋酸肝自分液漏斗慢慢滴加到A(先加几滴,待反应发生后再继续滴加),控制醋酸的滴加速度以使A稍热为宜。加完后(约10min),待反应稍和缓后在沸水浴中搅拌回流,直到不再有氯化氢气体逸出为止。
步骤二:反应结束,将A中的液体倒入冷水中,经处理得到较纯净的苯乙酮。
步骤三:经称重苯乙酮产量约为4.1g,计算产率。
已知在常压下:
| 名称 | 分子质量 | 颜色晶型 | 熔点 | 沸点 | 密度 | 溶解度 |
| 醋酸酐 | 102 | 无色液体 | -73 | 140 | 1.082 | 与水反应 |
| 苯 | 78 | 无色液体 | 5.5 | 80.5 | 0.879 | 不溶 |
| 苯乙酮 | 120 | 无色液体 | 20.5 | 202 | 1.0281 | 微溶 |
(2)图一装置中漏斗一半扣在水面下、一半露在水面上的原因是
(3)制备过程中为什么要逐渐地滴加醋酸酐?
(4)图一装置中CaCl2的作用是
(5)步骤二为得到较纯净的苯乙酮,需要经过下列的操作:①蒸馏收集某温度下的馏分;②依次用10%的NaOH溶液、水洗分液;③用无水MgSO4干燥并过滤;④水层用苯萃取合并有机层;⑤分液。正确的顺序是
| A.⑤④②③① | B.⑤②③④① | C.②④⑤①③ | D.②④⑤③① |
A.202℃B.220℃C.175℃
(7)经计算,该反应的产率为
您最近一年使用:0次



