名校
1 . 为测定草酸钴晶体(CoC2O4·2H2O)样品的纯度,某实验小组进行如下实验:
Ⅰ.取草酸钴晶体样品3.000 g,加稀H2SO4溶解,再加入100.00 mL 0.1000 mol/L酸性KMnO4溶液,充分反应至不再有CO2气体产生(常温下,草酸钴晶体难溶于水,该条件下Co2+不被氧化,杂质也不参与反应)。
Ⅱ.将溶液冷却,加水稀释定容至250 mL。
Ⅲ.取25.00 mL溶液,用0.1000 mol/L FeSO4标准溶液滴定。
Ⅳ.再重复步骤Ⅲ中的实验过程两次,三次的实验数据如表:
(1)步骤Ⅰ中加酸性KMnO4溶液时发生反应的离子方程式为______________ 。
(2)实验室使用的酸性KMnO4溶液一般是用________ 酸化(填酸的化学式)。
(3)步骤Ⅱ中,不会用到下列仪器中的_______ (填标号)。_______ (填“酸式”或“碱式”)滴定管;某次滴定中,开始时滴定管读数正确,结束时仰视,则所测草酸钴晶体样品的纯度会_______ (填“偏大”“偏小”或“不变”)﹔某次实验中所有实验操作和读数均无误,所测草酸钴晶体样品的纯度的误差却偏小,则可能的原因是___________ 。
(5)草酸钴晶体样品的纯度为______ %。
Ⅰ.取草酸钴晶体样品3.000 g,加稀H2SO4溶解,再加入100.00 mL 0.1000 mol/L酸性KMnO4溶液,充分反应至不再有CO2气体产生(常温下,草酸钴晶体难溶于水,该条件下Co2+不被氧化,杂质也不参与反应)。
Ⅱ.将溶液冷却,加水稀释定容至250 mL。
Ⅲ.取25.00 mL溶液,用0.1000 mol/L FeSO4标准溶液滴定。
Ⅳ.再重复步骤Ⅲ中的实验过程两次,三次的实验数据如表:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗FeSO4溶液标准的体积/mL | 18.96 | 18.03 | 17.97 |
(1)步骤Ⅰ中加酸性KMnO4溶液时发生反应的离子方程式为
(2)实验室使用的酸性KMnO4溶液一般是用
(3)步骤Ⅱ中,不会用到下列仪器中的
a. 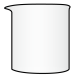 b.
b. 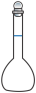 c.
c. 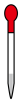 d.
d.
(5)草酸钴晶体样品的纯度为
您最近半年使用:0次
名校
解题方法
2 . 亚硝酸钠广泛用于工业、建筑业及食品加工业.某课外活动小组的同学拟制备亚硝酸钠、测定其产品的纯度并验证亚硝酸钠的某些性质。
(1)甲组同学采用下图装置制取亚硝酸钠。______ 。
②A中用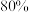 的硫酸而不用稀硫酸的原因是
的硫酸而不用稀硫酸的原因是______ 。
③若通入装置 中的
中的 与
与 按物质的量之比1:1被
按物质的量之比1:1被 溶液完全吸收,反应过程中无气体生成,则装置
溶液完全吸收,反应过程中无气体生成,则装置 中发生反应的化学方程式为
中发生反应的化学方程式为______ 。
(2)乙组同学测定甲组制得的产品中 的纯度。称取
的纯度。称取 试样于锥形瓶中,加入适量水溶解,与
试样于锥形瓶中,加入适量水溶解,与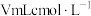 的酸性
的酸性 溶液恰好完全反应,则产品的纯度为
溶液恰好完全反应,则产品的纯度为______ (用含c、m、V的代数式表示)。
(3)现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应气体产物的成分。已知:气体液化的温度 为
为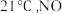 为
为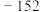 ℃。
℃。 中生成的气体产物,仪器的连接顺序(按左
中生成的气体产物,仪器的连接顺序(按左 右连接)为
右连接)为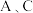 、
、______ 、______ 、______ 。
②装置 的作用是
的作用是______ 。
③滴入硫酸后,观察到A中有红棕色气体产生。依据______ 的现象,确定该气体中还有NO。
④通过上述实验探究过程,可得出装置A中反应的化学方程式是______ 。
(1)甲组同学采用下图装置制取亚硝酸钠。
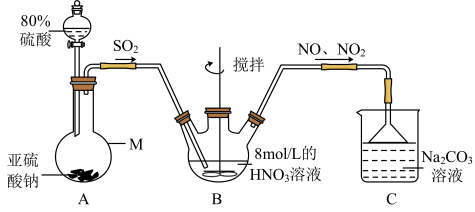
②A中用
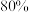 的硫酸而不用稀硫酸的原因是
的硫酸而不用稀硫酸的原因是③若通入装置
 中的
中的 与
与 按物质的量之比1:1被
按物质的量之比1:1被 溶液完全吸收,反应过程中无气体生成,则装置
溶液完全吸收,反应过程中无气体生成,则装置 中发生反应的化学方程式为
中发生反应的化学方程式为(2)乙组同学测定甲组制得的产品中
 的纯度。称取
的纯度。称取 试样于锥形瓶中,加入适量水溶解,与
试样于锥形瓶中,加入适量水溶解,与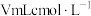 的酸性
的酸性 溶液恰好完全反应,则产品的纯度为
溶液恰好完全反应,则产品的纯度为(3)现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应气体产物的成分。已知:气体液化的温度
 为
为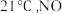 为
为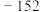 ℃。
℃。
 中生成的气体产物,仪器的连接顺序(按左
中生成的气体产物,仪器的连接顺序(按左 右连接)为
右连接)为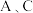 、
、②装置
 的作用是
的作用是③滴入硫酸后,观察到A中有红棕色气体产生。依据
④通过上述实验探究过程,可得出装置A中反应的化学方程式是
您最近半年使用:0次
名校
3 . 乙研究小组为了利用稀硫酸制备 ,进行了如图所示的实验设计。
,进行了如图所示的实验设计。 能加快生成
能加快生成 的反应速率,发挥作用的原理可表述为:
的反应速率,发挥作用的原理可表述为:
①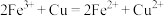
②……
(1)反应②的离子方程式 为______________ 。
(2)某小组通过向铜和稀硫酸的混合物中加入过氧化氢的方法制备硫酸铜,但是在实际操作时,发现所消耗的 的量往往会大于理论值,原因是
的量往往会大于理论值,原因是__________ 。
取 晶体隔绝空气加热,剩余固体的质量随温度的变化如图所示。
晶体隔绝空气加热,剩余固体的质量随温度的变化如图所示。 时,固体的成分为
时,固体的成分为________ (写出计算步骤 )。
(4)当剩余固体为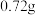 时,加热的温度不能低于
时,加热的温度不能低于_____ ℃,如果此时产生的气体中含有 ,请写出
,请写出 受热分解的化学方程式
受热分解的化学方程式________ 。
 ,进行了如图所示的实验设计。
,进行了如图所示的实验设计。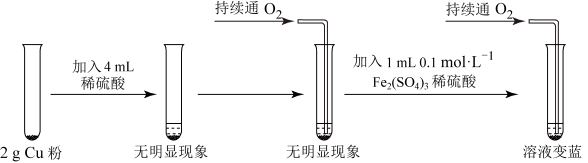
 能加快生成
能加快生成 的反应速率,发挥作用的原理可表述为:
的反应速率,发挥作用的原理可表述为:①
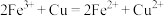
②……
(1)反应②的
(2)某小组通过向铜和稀硫酸的混合物中加入过氧化氢的方法制备硫酸铜,但是在实际操作时,发现所消耗的
 的量往往会大于理论值,原因是
的量往往会大于理论值,原因是取
 晶体隔绝空气加热,剩余固体的质量随温度的变化如图所示。
晶体隔绝空气加热,剩余固体的质量随温度的变化如图所示。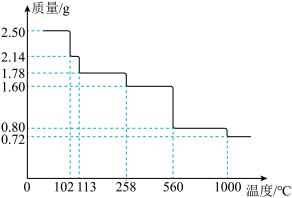
 时,固体的成分为
时,固体的成分为(4)当剩余固体为
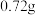 时,加热的温度不能低于
时,加热的温度不能低于 ,请写出
,请写出 受热分解的化学方程式
受热分解的化学方程式
您最近半年使用:0次
4 . 葡萄酒常用 作抗氧化剂,
作抗氧化剂, 溶于水即生成
溶于水即生成 ,我国国家标准规定葡萄酒中
,我国国家标准规定葡萄酒中 残留量
残留量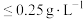 .测定某葡萄酒中抗氧化剂的残留量(以游离
.测定某葡萄酒中抗氧化剂的残留量(以游离 计算)的实验步骤如下:
计算)的实验步骤如下:
①按图示连接装置,检查装置气密性,加入药品。 的NaOH标准溶液滴定,消耗20.80mL。
的NaOH标准溶液滴定,消耗20.80mL。
③另取相同装置,向A中注入20.00mL蒸馏水和10mL 25%磷酸溶液,按同样的方法做空白实验,消耗NaOH溶液0.80mL。
回答下列问题:
(1) 溶于水的化学方程式为
溶于水的化学方程式为___________ 。
(2)装置B的名称是___________ ;使用装置D的目的是___________ ;E为直玻璃管,其作用是___________ 。
(3)真空泵抽气速率过快,导致的后果是___________ 。
(4)滴定指示剂可能是___________ ;滴定前,用标准NaOH溶液润洗滴定管的操作方法是___________ 。
(5)该葡萄酒中 的含量为
的含量为___________  。
。
 作抗氧化剂,
作抗氧化剂, 溶于水即生成
溶于水即生成 ,我国国家标准规定葡萄酒中
,我国国家标准规定葡萄酒中 残留量
残留量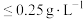 .测定某葡萄酒中抗氧化剂的残留量(以游离
.测定某葡萄酒中抗氧化剂的残留量(以游离 计算)的实验步骤如下:
计算)的实验步骤如下:①按图示连接装置,检查装置气密性,加入药品。

 的NaOH标准溶液滴定,消耗20.80mL。
的NaOH标准溶液滴定,消耗20.80mL。③另取相同装置,向A中注入20.00mL蒸馏水和10mL 25%磷酸溶液,按同样的方法做空白实验,消耗NaOH溶液0.80mL。
回答下列问题:
(1)
 溶于水的化学方程式为
溶于水的化学方程式为(2)装置B的名称是
(3)真空泵抽气速率过快,导致的后果是
(4)滴定指示剂可能是
(5)该葡萄酒中
 的含量为
的含量为 。
。
您最近半年使用:0次
名校
5 . 乙二胺四乙酸(俗称EDTA,可简写为H4Y,下同)常温下是一种白色结晶性粉末,不溶于冷水,微溶于热水。可溶于碱性溶液中,得到的乙二胺四乙酸二钠(俗称EDTA-二钠,可简写为Na2H2Y,下同)是一种重要的用途很广的络合剂。
现成实外集团高三年级的学生在实验室模拟了EDTA的制备过程并进行了Na2H2Y溶液浓度的测定。
(一)EDTA的制备
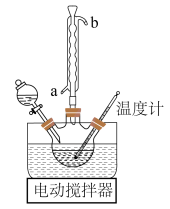
①称取一氯乙酸于下图装置中,慢慢加入50%碳酸钠溶液,直至二氧化碳气泡发生为止。
③取下反应器,冷却后倒入烧杯中,用浓HCl调节pH至1.2,有白色沉淀生成。抽滤,得到EDTA。
(1)装置A的名称是_______ ,球形冷凝管的出水口为_______ (填“a”或“b”)。
(2)步骤③加浓HCl的目的是_______ ,对应的离子方程式为_______ 。之后抽滤(减压过滤)可以得到EDTA,抽滤的主要优点是_______ 。
(3)下列说法正确的是_______。
(二)浓度的测定
取适量产品于烧杯中,加碱溶液溶解,配置成100mLNa2H2Y溶液。用移液管准确移取0.1000mol/LCa2+标准溶液20.00mL于锥形瓶中,加指示剂少许,调节溶液pH为10,用Na2H2Y溶液滴定至滴定终点,平行滴定3次,平均消耗Na2H2Y溶液18.00mL。
已知:①Na2H2Y是一种优良的钙、镁离子螯合剂,能与钙离子1:1形成稳定的的螯合物。
②指示剂呈蓝色,与钙离子结合时为紫红色。
(4)滴定终点的现象为_______ 。
(5)所配置的Na2H2Y溶液浓度为_______ 。
现成实外集团高三年级的学生在实验室模拟了EDTA的制备过程并进行了Na2H2Y溶液浓度的测定。
(一)EDTA的制备
①称取一氯乙酸于下图装置中,慢慢加入50%碳酸钠溶液,直至二氧化碳气泡发生为止。
③取下反应器,冷却后倒入烧杯中,用浓HCl调节pH至1.2,有白色沉淀生成。抽滤,得到EDTA。
(1)装置A的名称是
(2)步骤③加浓HCl的目的是
(3)下列说法正确的是_______。
| A.实验所用装置A的容积为500mL |
| B.可用广泛pH试纸检测是否将pH调至1.2 |
| C.若在加热过程中忘记加搅拌子(类似沸石),须关停装置待冷却至室温后补加 |
| D.冷凝管的作用是冷凝回流,增大反应物的转化率 |
(二)浓度的测定
取适量产品于烧杯中,加碱溶液溶解,配置成100mLNa2H2Y溶液。用移液管准确移取0.1000mol/LCa2+标准溶液20.00mL于锥形瓶中,加指示剂少许,调节溶液pH为10,用Na2H2Y溶液滴定至滴定终点,平行滴定3次,平均消耗Na2H2Y溶液18.00mL。
已知:①Na2H2Y是一种优良的钙、镁离子螯合剂,能与钙离子1:1形成稳定的的螯合物。
②指示剂呈蓝色,与钙离子结合时为紫红色。
(4)滴定终点的现象为
(5)所配置的Na2H2Y溶液浓度为
您最近半年使用:0次
名校
解题方法
6 . 某化学兴趣小组设计如图实验装置(夹持装置已省略),探究 、
、 和
和 的氧化性强弱。
的氧化性强弱。
(1)玻璃管a的作用是__________ 。
(2)实验Ⅰ:旋开恒压滴液漏斗的玻璃塞,打开活塞 ,关闭活塞
,关闭活塞 ,通入
,通入 。
。
①装置A中制备 的离子方程式为
的离子方程式为__________ 。
②证明 的氧化性大于
的氧化性大于 的现象是
的现象是__________ 。
③装置C的作用是__________ ,装置D中所盛试剂为__________ (填化学式)溶液。
(3)实验Ⅱ:实验Ⅰ进行一段时间后,关闭活塞 ,打开
,打开 ,通入
,通入 气体,验证
气体,验证 的氧化性比
的氧化性比 强。
强。
① 发生反应的化学方程式为
发生反应的化学方程式为__________ 。
②实验完成后,打开弹簧夹,持续通入 的目的是
的目的是__________ 。
(4)淀粉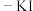 溶液中
溶液中 的测定:取10.00mL淀粉
的测定:取10.00mL淀粉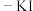 溶液,加入足量的硫酸酸化的
溶液,加入足量的硫酸酸化的 溶液,然后加入少量的
溶液,然后加入少量的 粉末除去
粉末除去 ,然后用
,然后用 的
的 标准溶液滴定,达到滴定终点时三次测量平均消耗
标准溶液滴定,达到滴定终点时三次测量平均消耗 标准溶液的体积为25.00mL(
标准溶液的体积为25.00mL(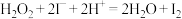 ,
, )。
)。
①滴定终点现象是__________ 。
②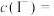
__________  。
。
 、
、 和
和 的氧化性强弱。
的氧化性强弱。
(1)玻璃管a的作用是
(2)实验Ⅰ:旋开恒压滴液漏斗的玻璃塞,打开活塞
 ,关闭活塞
,关闭活塞 ,通入
,通入 。
。①装置A中制备
 的离子方程式为
的离子方程式为②证明
 的氧化性大于
的氧化性大于 的现象是
的现象是③装置C的作用是
(3)实验Ⅱ:实验Ⅰ进行一段时间后,关闭活塞
 ,打开
,打开 ,通入
,通入 气体,验证
气体,验证 的氧化性比
的氧化性比 强。
强。①
 发生反应的化学方程式为
发生反应的化学方程式为②实验完成后,打开弹簧夹,持续通入
 的目的是
的目的是(4)淀粉
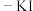 溶液中
溶液中 的测定:取10.00mL淀粉
的测定:取10.00mL淀粉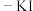 溶液,加入足量的硫酸酸化的
溶液,加入足量的硫酸酸化的 溶液,然后加入少量的
溶液,然后加入少量的 粉末除去
粉末除去 ,然后用
,然后用 的
的 标准溶液滴定,达到滴定终点时三次测量平均消耗
标准溶液滴定,达到滴定终点时三次测量平均消耗 标准溶液的体积为25.00mL(
标准溶液的体积为25.00mL(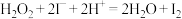 ,
, )。
)。①滴定终点现象是
②
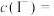
 。
。
您最近半年使用:0次
2024-04-28更新
|
166次组卷
|
2卷引用:甘肃省2024届高三普通高中三模化学试卷
名校
解题方法
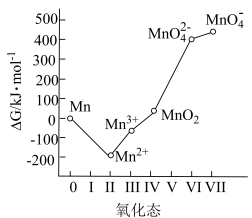
7 . 高锰酸钾为常见的强氧化剂,常用于消毒杀菌。工业上常以软锰矿(主要成分为MnO2,含少量Si、Al的氧化物)为原料制备,流程如下:
回答下列问题:
(1)基态Mn2+的价电子轨道表示式为___________ 。K2MnO4中Mn的化合价为___________ 。
(2)煅烧后,炉渣主要成分为K2MnO4,写出MnO2发生的化学方程式___________ 。
(3)浸取后通入CO2调节pH,则滤渣Ⅰ的主要成分为___________ 、___________ 。
(4)流程中的“歧化”可加入的物质甲是___________(填字母)。
(5)歧化时发生的离子方程式为___________ 。
(6)实验室常用草酸标准溶液测定产品中高锰酸钾的纯度。取0.5000g样品溶于水,配成100mL溶液,取10.00mL于锥形瓶中,滴入5滴稀硫酸酸化,用0.1500mol/L草酸标准溶液滴定,达终点时消耗标准液5.100mL。
①滴定终点的现象为___________ 。
②样品中高锰酸钾(摩尔质量为158g·mol-1)的纯度为___________ %(结果保留小数点后两位)。
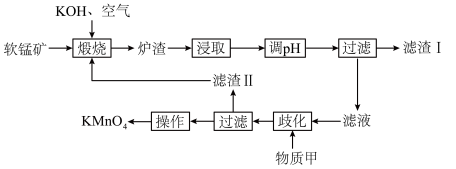
回答下列问题:
(1)基态Mn2+的价电子轨道表示式为
(2)煅烧后,炉渣主要成分为K2MnO4,写出MnO2发生的化学方程式
(3)浸取后通入CO2调节pH,则滤渣Ⅰ的主要成分为
(4)流程中的“歧化”可加入的物质甲是___________(填字母)。
| A.亚硫酸 | B.浓盐酸 | C.乙二酸 | D.稀硫酸 |
(5)歧化时发生的离子方程式为
(6)实验室常用草酸标准溶液测定产品中高锰酸钾的纯度。取0.5000g样品溶于水,配成100mL溶液,取10.00mL于锥形瓶中,滴入5滴稀硫酸酸化,用0.1500mol/L草酸标准溶液滴定,达终点时消耗标准液5.100mL。
①滴定终点的现象为
②样品中高锰酸钾(摩尔质量为158g·mol-1)的纯度为
您最近半年使用:0次
名校
8 . 重铬酸钾( )广泛应用于化学合成和定量分析。
)广泛应用于化学合成和定量分析。
(1)钾铬矾[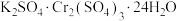 ]在鞣革、纺织等工业上有广泛的用途,可通过
]在鞣革、纺织等工业上有广泛的用途,可通过 还原酸性重铬酸钾溶液制得,实验装置如图。
还原酸性重铬酸钾溶液制得,实验装置如图。 而不用稀硫酸的原因是
而不用稀硫酸的原因是___________ 。
②装置B中为了使 尽可能吸收完全,除了控制适当搅拌速率外,还可以采取的一项措施是
尽可能吸收完全,除了控制适当搅拌速率外,还可以采取的一项措施是___________ 。
③写出三颈烧瓶中析出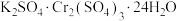 晶体的化学方程式
晶体的化学方程式___________ 。
(2)实验室利用 溶液并采用滴定法(用二苯胺磺酸钠作指示剂)测定含有少量杂质(不参与反应)的
溶液并采用滴定法(用二苯胺磺酸钠作指示剂)测定含有少量杂质(不参与反应)的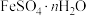 中的n值。具体实验过程如下:
中的n值。具体实验过程如下:
实验Ⅰ:称取a g试样,用足量稀硫酸在烧杯中充分溶解后,将烧杯中的溶液沿玻璃棒注入100mL容量瓶,用少量蒸馏水洗涤玻璃棒和烧杯内壁2~3次,将洗涤液也都注入该容器;加蒸馏水至___________ ,改用胶头滴管加蒸馏水至溶液的凹液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀。移取溶液25.00mL于锥形瓶中,___________ ,用c
 溶液滴定至终点(
溶液滴定至终点( 被还原为
被还原为 ),记录消耗
),记录消耗 溶液体积。重复上述实验2次,测得消耗
溶液体积。重复上述实验2次,测得消耗 溶液的体积为V mL(三次实验的平均值)。
溶液的体积为V mL(三次实验的平均值)。
实验Ⅱ:称取a g试样,隔绝空气加热至恒重(杂质及 未发生分解),固体质量减少了b g。
未发生分解),固体质量减少了b g。
①请补充完整实验Ⅰ的实验方案。
②实验Ⅰ接近滴定终点时,向锥形瓶中滴入半滴标准液的操作为___________ (填序号)。___________ (用含字母的表达式表示),若盛放标准液的滴定管未润洗,则测定的n值___________ (填“偏大”“偏小”或“无影响”)
 )广泛应用于化学合成和定量分析。
)广泛应用于化学合成和定量分析。(1)钾铬矾[
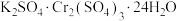 ]在鞣革、纺织等工业上有广泛的用途,可通过
]在鞣革、纺织等工业上有广泛的用途,可通过 还原酸性重铬酸钾溶液制得,实验装置如图。
还原酸性重铬酸钾溶液制得,实验装置如图。
 而不用稀硫酸的原因是
而不用稀硫酸的原因是②装置B中为了使
 尽可能吸收完全,除了控制适当搅拌速率外,还可以采取的一项措施是
尽可能吸收完全,除了控制适当搅拌速率外,还可以采取的一项措施是③写出三颈烧瓶中析出
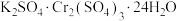 晶体的化学方程式
晶体的化学方程式(2)实验室利用
 溶液并采用滴定法(用二苯胺磺酸钠作指示剂)测定含有少量杂质(不参与反应)的
溶液并采用滴定法(用二苯胺磺酸钠作指示剂)测定含有少量杂质(不参与反应)的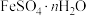 中的n值。具体实验过程如下:
中的n值。具体实验过程如下:实验Ⅰ:称取a g试样,用足量稀硫酸在烧杯中充分溶解后,将烧杯中的溶液沿玻璃棒注入100mL容量瓶,用少量蒸馏水洗涤玻璃棒和烧杯内壁2~3次,将洗涤液也都注入该容器;加蒸馏水至

 溶液滴定至终点(
溶液滴定至终点( 被还原为
被还原为 ),记录消耗
),记录消耗 溶液体积。重复上述实验2次,测得消耗
溶液体积。重复上述实验2次,测得消耗 溶液的体积为V mL(三次实验的平均值)。
溶液的体积为V mL(三次实验的平均值)。实验Ⅱ:称取a g试样,隔绝空气加热至恒重(杂质及
 未发生分解),固体质量减少了b g。
未发生分解),固体质量减少了b g。①请补充完整实验Ⅰ的实验方案。
②实验Ⅰ接近滴定终点时,向锥形瓶中滴入半滴标准液的操作为
A. B.
B. C.
C. D.
D.
您最近半年使用:0次
2024-04-27更新
|
266次组卷
|
2卷引用:福建省龙岩市2024届高三下学期二模考试化学试题
名校
解题方法
9 . 过二硫酸钾( )具有强氧化性,常用于水池及封闭循环处理水中有害物质的氧化降解。请回答下列问题:
)具有强氧化性,常用于水池及封闭循环处理水中有害物质的氧化降解。请回答下列问题:
Ⅰ. 中含有过氧键,与过氧化氢相似,可以和
中含有过氧键,与过氧化氢相似,可以和 发生氧化还原反应,由此构成原电池装置(质子交换膜只允许
发生氧化还原反应,由此构成原电池装置(质子交换膜只允许 通过),如图。
通过),如图。______ (填“a”或“b”)极,b极的电极反应式为______________________ 。
(2)下列关于a,b极的电极材料合理的是________ (填标号)。
Ⅱ.制备过二硫酸钾( )。
)。
往 溶液中加入硫酸及硫酸钾粉末,搅拌,常温下反应半小时,然后在搅拌下使物料冷却至14℃,
溶液中加入硫酸及硫酸钾粉末,搅拌,常温下反应半小时,然后在搅拌下使物料冷却至14℃, 以结晶析出,溶液中含有硫酸氢盐。
以结晶析出,溶液中含有硫酸氢盐。
(3)制备 的化学方程式为
的化学方程式为_____________________ 。
Ⅲ.产品提纯。
在450mL 0.5 KOH水溶液中,边搅拌边加入
KOH水溶液中,边搅拌边加入 粗产品,缓慢加热到70℃,待结晶完全溶解后,冷却到14℃,使
粗产品,缓慢加热到70℃,待结晶完全溶解后,冷却到14℃,使 重新结晶,再在90~95℃下气流干燥,即得成品。
重新结晶,再在90~95℃下气流干燥,即得成品。
(4)现用KOH固体配制上述KOH水溶液,需称量_________ g KOH固体,所需仪器如图所示,其中不需要的仪器是________________ (填标号),还缺少的仪器为_______________________ (写仪器名称)。 (
(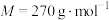 )含量测定。
)含量测定。
取a g样品全部溶解在烧杯中,加入20.00mL 0.1
 溶液,恰好完全反应。
溶液,恰好完全反应。
(5)反应生成 写出该反应的离子方程式:
写出该反应的离子方程式:________________ 。
(6)此样品中 的质量分数为
的质量分数为________________ 。
 )具有强氧化性,常用于水池及封闭循环处理水中有害物质的氧化降解。请回答下列问题:
)具有强氧化性,常用于水池及封闭循环处理水中有害物质的氧化降解。请回答下列问题:Ⅰ.
 中含有过氧键,与过氧化氢相似,可以和
中含有过氧键,与过氧化氢相似,可以和 发生氧化还原反应,由此构成原电池装置(质子交换膜只允许
发生氧化还原反应,由此构成原电池装置(质子交换膜只允许 通过),如图。
通过),如图。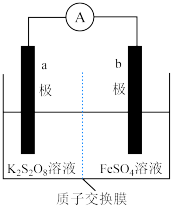
(2)下列关于a,b极的电极材料合理的是
选项 | a极 | b极 |
A | Pt | Pt |
B | 石墨 | 石墨 |
C | 石墨 | Zn |
D | Al | Cu |
Ⅱ.制备过二硫酸钾(
 )。
)。往
 溶液中加入硫酸及硫酸钾粉末,搅拌,常温下反应半小时,然后在搅拌下使物料冷却至14℃,
溶液中加入硫酸及硫酸钾粉末,搅拌,常温下反应半小时,然后在搅拌下使物料冷却至14℃, 以结晶析出,溶液中含有硫酸氢盐。
以结晶析出,溶液中含有硫酸氢盐。(3)制备
 的化学方程式为
的化学方程式为Ⅲ.产品提纯。
在450mL 0.5
 KOH水溶液中,边搅拌边加入
KOH水溶液中,边搅拌边加入 粗产品,缓慢加热到70℃,待结晶完全溶解后,冷却到14℃,使
粗产品,缓慢加热到70℃,待结晶完全溶解后,冷却到14℃,使 重新结晶,再在90~95℃下气流干燥,即得成品。
重新结晶,再在90~95℃下气流干燥,即得成品。(4)现用KOH固体配制上述KOH水溶液,需称量

 (
(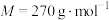 )含量测定。
)含量测定。取a g样品全部溶解在烧杯中,加入20.00mL 0.1

 溶液,恰好完全反应。
溶液,恰好完全反应。(5)反应生成
 写出该反应的离子方程式:
写出该反应的离子方程式:(6)此样品中
 的质量分数为
的质量分数为
您最近半年使用:0次
解题方法
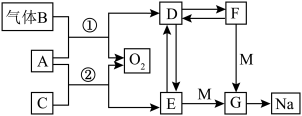
10 . A~G均代表常见化合物,且A、D、E、F、G均含同种金属阳离子,转化关系如图所示,C在常温下为液体,F俗称为小苏打,请回答下列问题:_______ ,F→D:_______ 。
(2)电解熔融G可得到钠和黄绿色气体,该反应的化学方程式为_______ 。
(3)请写出反应②的离子方程式:_____ ,该反应中的氧化剂与还原剂的质量之比为______ 。
(4)检验 溶液中是否存在
溶液中是否存在 的操作及现象为
的操作及现象为_______ 。
(5)取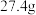 由
由 和
和 组成的某固体粉末充分加热,将产生的全部气体依次通过浓硫酸和碱石灰,碱石灰增重
组成的某固体粉末充分加热,将产生的全部气体依次通过浓硫酸和碱石灰,碱石灰增重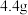 (不考虑气体的逸出),则加热时发生反应的化学方程式为
(不考虑气体的逸出),则加热时发生反应的化学方程式为_______ ,原固体粉末中 的质量分数为
的质量分数为_______ (保留三位有效数字)。
(2)电解熔融G可得到钠和黄绿色气体,该反应的化学方程式为
(3)请写出反应②的离子方程式:
(4)检验
 溶液中是否存在
溶液中是否存在 的操作及现象为
的操作及现象为(5)取
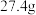 由
由 和
和 组成的某固体粉末充分加热,将产生的全部气体依次通过浓硫酸和碱石灰,碱石灰增重
组成的某固体粉末充分加热,将产生的全部气体依次通过浓硫酸和碱石灰,碱石灰增重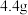 (不考虑气体的逸出),则加热时发生反应的化学方程式为
(不考虑气体的逸出),则加热时发生反应的化学方程式为 的质量分数为
的质量分数为
您最近半年使用:0次



