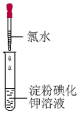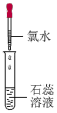1 . 亚硝酸钠( )常用作食品防腐剂,实验室常用NO和过氧化钠反应制得。
)常用作食品防腐剂,实验室常用NO和过氧化钠反应制得。 是白色粉末,易溶于水。
是白色粉末,易溶于水。
(1)滴入浓硝酸前先通入一段时间的 ,目的是
,目的是___________ 。
(2)B中发生反应的化学方程式为___________ 、___________ 。
(3)C中试剂是___________ (填名称)。
(4)装置E的作用是___________ 。
(5)观察到F中溶液由紫红色变为无色,经检验氧化产物是 ,还原产物是
,还原产物是 。写出F中发生反应的离子方程式:
。写出F中发生反应的离子方程式:___________ 。
(6)实验结束后小组同学发现装置A中浓硝酸有剩余,溶液呈绿色,针对这一现象提出猜想。
查阅资料:
ⅰ. 溶于稀硝酸会反应:而溶于浓硝酸不反应,使溶液呈黄色;
溶于稀硝酸会反应:而溶于浓硝酸不反应,使溶液呈黄色;
ⅱ. 与水反应时会有部分发生反应:
与水反应时会有部分发生反应: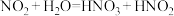 ,
, 是弱酸,无色,不稳定。
是弱酸,无色,不稳定。
ⅲ. 离子颜色为绿色。
离子颜色为绿色。
猜想1: 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色 溶液混合而呈现绿色。
溶液混合而呈现绿色。
猜想2: 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。
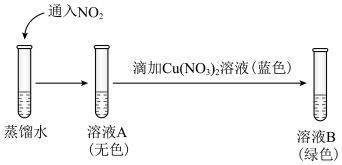
①向浓硝酸中通入 ,溶液呈黄色,加入
,溶液呈黄色,加入___________ (填化学式)后呈绿色,证实猜想1合理。
②研究猜想2是否为所得溶液呈绿色的主要原因,实验如下。 的证据是
的证据是___________ 。
b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想2不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:___________ 。
 )常用作食品防腐剂,实验室常用NO和过氧化钠反应制得。
)常用作食品防腐剂,实验室常用NO和过氧化钠反应制得。 是白色粉末,易溶于水。
是白色粉末,易溶于水。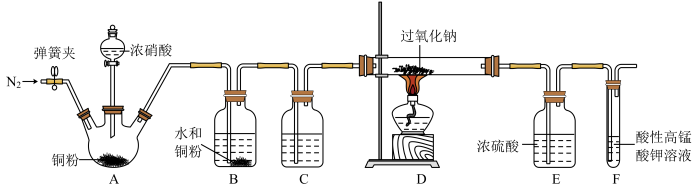
(1)滴入浓硝酸前先通入一段时间的
 ,目的是
,目的是(2)B中发生反应的化学方程式为
(3)C中试剂是
(4)装置E的作用是
(5)观察到F中溶液由紫红色变为无色,经检验氧化产物是
 ,还原产物是
,还原产物是 。写出F中发生反应的离子方程式:
。写出F中发生反应的离子方程式:(6)实验结束后小组同学发现装置A中浓硝酸有剩余,溶液呈绿色,针对这一现象提出猜想。
查阅资料:
ⅰ.
 溶于稀硝酸会反应:而溶于浓硝酸不反应,使溶液呈黄色;
溶于稀硝酸会反应:而溶于浓硝酸不反应,使溶液呈黄色;ⅱ.
 与水反应时会有部分发生反应:
与水反应时会有部分发生反应: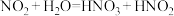 ,
, 是弱酸,无色,不稳定。
是弱酸,无色,不稳定。ⅲ.
 离子颜色为绿色。
离子颜色为绿色。猜想1:
 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色 溶液混合而呈现绿色。
溶液混合而呈现绿色。猜想2:
 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。①向浓硝酸中通入
 ,溶液呈黄色,加入
,溶液呈黄色,加入②研究猜想2是否为所得溶液呈绿色的主要原因,实验如下。
 的证据是
的证据是b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想2不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:
您最近一年使用:0次
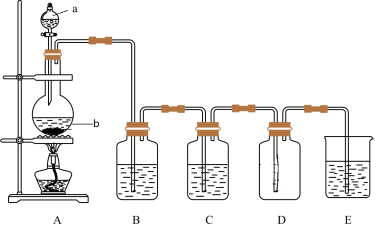
2 . 下图是实验室中制备某种气体或验证某种气体性质的装置图。
(1)仪器a的名称是______ ,仪器b的名称是______ 。
(2)仪器b内发生反应的离子方程式为______ ;
(3)装置B中的溶液为______ 溶液;
(4)烧杯E中溶液的作用为______ 。
Ⅱ.利用图装置,可以证明 具有漂白性、还原性及生成气体中含有
具有漂白性、还原性及生成气体中含有 ;仪器b内加入碳,a中加入浓硫酸,B、D中均为少量品红溶液,C中为足量酸性高锰酸钾溶液,E中为澄清石灰水。
;仪器b内加入碳,a中加入浓硫酸,B、D中均为少量品红溶液,C中为足量酸性高锰酸钾溶液,E中为澄清石灰水。
(5)证明 具有漂白性的装置是
具有漂白性的装置是______ (填装置图对应大写字母),现象是______ ;
(6)证明 具有还原性的现象是
具有还原性的现象是______ ;
(7)证明生成气体中含有 的现象是
的现象是______ ;
(8)D装置的作用是______ 。
(1)仪器a的名称是
(2)仪器b内发生反应的离子方程式为
(3)装置B中的溶液为
(4)烧杯E中溶液的作用为
Ⅱ.利用图装置,可以证明
 具有漂白性、还原性及生成气体中含有
具有漂白性、还原性及生成气体中含有 ;仪器b内加入碳,a中加入浓硫酸,B、D中均为少量品红溶液,C中为足量酸性高锰酸钾溶液,E中为澄清石灰水。
;仪器b内加入碳,a中加入浓硫酸,B、D中均为少量品红溶液,C中为足量酸性高锰酸钾溶液,E中为澄清石灰水。(5)证明
 具有漂白性的装置是
具有漂白性的装置是(6)证明
 具有还原性的现象是
具有还原性的现象是(7)证明生成气体中含有
 的现象是
的现象是(8)D装置的作用是
您最近一年使用:0次
名校
解题方法
3 . 含硫的物质与人们的生活密切相关。已知硫元素常见的化合价有-2、0、+4、+6四种,其不同价态的物质间可相互转化。完成下列填空:
(1)请写出硫在元素周期表的位置:___________ 。
(2)硫与硅为同一周期元素,通过下列事实能比较两者非金属性强弱的是___________。
(3)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是硫酸。以下是二氧化硫形成酸雨的两种途径: 转化成
转化成 的化学方程式:
的化学方程式:___________ 。
你认为减少酸雨产生的无效措施是___________ (填字母序号)
A.少用煤作燃料 B.把工厂烟囱造高 C.燃料脱硫 D.开发新能源
某同学利用如图所示装置探究二氧化硫气体的性质,回答下列问题:___________ 。
(5)当观察到②中溶液颜色变浅时,①中的现象是___________ 。
(6)装置③的作用是___________ 。
(7)②中的现象说明二氧化硫具有的性质是___________ 。
(8)从氧化还原角度制备硫代硫酸钠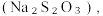 下列方案合理的是(填编号)___________。
下列方案合理的是(填编号)___________。
(9)为进一步减少 的污染并变废为宝,我国正在探索在一定条件下,用CO还原
的污染并变废为宝,我国正在探索在一定条件下,用CO还原 得到单质硫的方法来除去
得到单质硫的方法来除去 写出该反应的化学方程式:
写出该反应的化学方程式:___________ 。
(1)请写出硫在元素周期表的位置:
(2)硫与硅为同一周期元素,通过下列事实能比较两者非金属性强弱的是___________。
A.热稳定性: | B.溶解度: 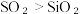 |
C.单质的熔点: | D.酸性:  |
(3)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是硫酸。以下是二氧化硫形成酸雨的两种途径:

 转化成
转化成 的化学方程式:
的化学方程式:你认为减少酸雨产生的无效措施是
A.少用煤作燃料 B.把工厂烟囱造高 C.燃料脱硫 D.开发新能源
某同学利用如图所示装置探究二氧化硫气体的性质,回答下列问题:
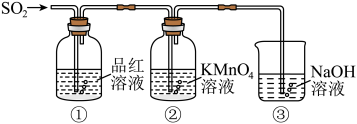
(5)当观察到②中溶液颜色变浅时,①中的现象是
(6)装置③的作用是
(7)②中的现象说明二氧化硫具有的性质是
(8)从氧化还原角度制备硫代硫酸钠
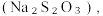 下列方案合理的是(填编号)___________。
下列方案合理的是(填编号)___________。A.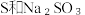 | B. 和浓 和浓 | C. 和 和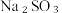 | D.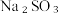 和 和 |
(9)为进一步减少
 的污染并变废为宝,我国正在探索在一定条件下,用CO还原
的污染并变废为宝,我国正在探索在一定条件下,用CO还原 得到单质硫的方法来除去
得到单质硫的方法来除去 写出该反应的化学方程式:
写出该反应的化学方程式:
您最近一年使用:0次
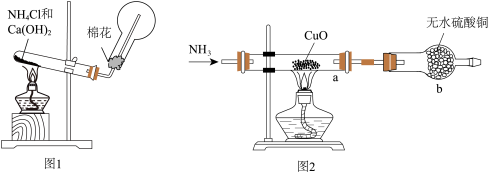
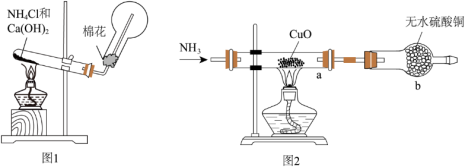
4 . 人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料,某化学兴趣小组利用图1装置制备氨气,图2装置探究其相关性质。
(1)图1装置中生成 的化学方程式为
的化学方程式为________________ ,
(2)检验圆底烧瓶中已收集满氨气的方法是________________ 。
Ⅱ、探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物
(3)无水硫酸铜的作用是________ ,有同学认为需要在无水硫酸铜的后面再接一个装有无水 固体的球形干燥管,这样做的目的是
固体的球形干燥管,这样做的目的是________________ 。
(4)实验中观察到a中 粉末变红,b中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为
粉末变红,b中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为________________ 。
(5)若向a中通入标准状况下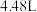 的氨气,最终得到铜的质量为
的氨气,最终得到铜的质量为________ g。
(1)图1装置中生成
 的化学方程式为
的化学方程式为(2)检验圆底烧瓶中已收集满氨气的方法是
Ⅱ、探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物
(3)无水硫酸铜的作用是
 固体的球形干燥管,这样做的目的是
固体的球形干燥管,这样做的目的是(4)实验中观察到a中
 粉末变红,b中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为
粉末变红,b中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为(5)若向a中通入标准状况下
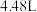 的氨气,最终得到铜的质量为
的氨气,最终得到铜的质量为
您最近一年使用:0次
2024-05-04更新
|
141次组卷
|
2卷引用:天津市第二十一中学2023-2024学年高一下学期第一次月考化学试卷
5 . 人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料,某化学兴趣小组利用图1装置制备氨气,图2装置探究其相关性质。
(1)图1装置中生成NH3的化学方程式为______ 。装置中棉花的作用_______ 。
II.探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。
(2)无水硫酸铜的作用是_______ 。
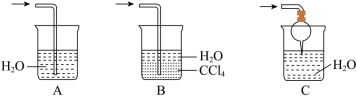
(3)该实验缺少尾气吸收装置。如图中能用来吸收尾气的装置是____ (填字母)。________ ,证明氨气具有_____ (填“氧化”或“还原”)性。
(5)若向a中通入标准状况下3.36L的氨气,最终得到铜的质量为_____ g。
(1)图1装置中生成NH3的化学方程式为
II.探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。
(2)无水硫酸铜的作用是
(3)该实验缺少尾气吸收装置。如图中能用来吸收尾气的装置是
(5)若向a中通入标准状况下3.36L的氨气,最终得到铜的质量为
您最近一年使用:0次
6 . A、B、C、D四物质有如下转化关系反应条件和部分产物已略去,回答下列问题:
A B
B C
C D
D
Ⅰ、若A为气态氢化物和D能通过化合反应生成一种盐,则
(1)①A的电子式为____ ,实验室制取A的方程式为___________________ ,检验气体B的方法_______ ,写出由A生成B的化学方程式________________ 。
②在标准状况下,某同学用干燥的圆底烧瓶收集瓶A气体,用滴入酚酞的水做喷泉实验,能观察到美丽的红色喷泉。用方程式解释喷泉呈红色的原因________________ 。
Ⅱ、若A与B反应能生成一种淡黄色固体单质
(2)写出该反应的化学方程式__________ ,将B通入 溶液,能观察的现象是
溶液,能观察的现象是____________ ,反应的离子方程式为_________________ 。
Ⅲ、喷泉是一种常见的现象,其产生的原理是存在压强差。试回答下列问题:_____________________________________
①用图A装置进行喷泉实验,上部烧瓶已充满干燥的氨气,引发喷泉的操作是______________ 。
②利用图B装置引发喷泉的操作是________________________ 。
(4)利用图C装置,在锥形瓶中分别加入足量的下列物质,可能产生喷泉的有 。
(5)在图D装置的锥形瓶中加入乙醇,瓶外放一水槽,水槽中加入冷水后,再加入足量的下列物质,结果也形成了喷泉,水槽中加入的物质可能是 。
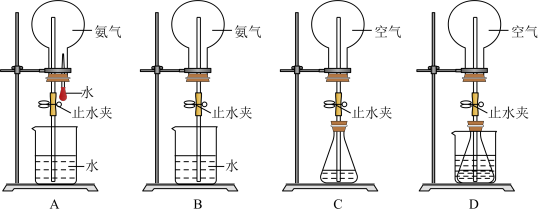
(6)同温同压下,两个等体积的干燥圆底烧瓶中分别充满 和
和 ,进行喷泉实验如图E、F所示,经充分反应后,发现烧瓶a中充满液体,b中有
,进行喷泉实验如图E、F所示,经充分反应后,发现烧瓶a中充满液体,b中有 体积的液体,则两烧瓶内溶质的物质的量浓度的关系是 。
体积的液体,则两烧瓶内溶质的物质的量浓度的关系是 。
A
 B
B C
C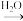 D
DⅠ、若A为气态氢化物和D能通过化合反应生成一种盐,则
(1)①A的电子式为
②在标准状况下,某同学用干燥的圆底烧瓶收集瓶A气体,用滴入酚酞的水做喷泉实验,能观察到美丽的红色喷泉。用方程式解释喷泉呈红色的原因
Ⅱ、若A与B反应能生成一种淡黄色固体单质
(2)写出该反应的化学方程式
 溶液,能观察的现象是
溶液,能观察的现象是Ⅲ、喷泉是一种常见的现象,其产生的原理是存在压强差。试回答下列问题:
①用图A装置进行喷泉实验,上部烧瓶已充满干燥的氨气,引发喷泉的操作是
②利用图B装置引发喷泉的操作是
(4)利用图C装置,在锥形瓶中分别加入足量的下列物质,可能产生喷泉的有 。
| A.Cu与稀盐酸 | B.Fe与稀硫酸 |
| C.Cu与稀硝酸 | D. 溶液与NaOH溶液 溶液与NaOH溶液 |
(5)在图D装置的锥形瓶中加入乙醇,瓶外放一水槽,水槽中加入冷水后,再加入足量的下列物质,结果也形成了喷泉,水槽中加入的物质可能是 。
| A.浓硫酸 | B.食盐 | C.硝酸钾 | D.硫酸铜 |
(6)同温同压下,两个等体积的干燥圆底烧瓶中分别充满
 和
和 ,进行喷泉实验如图E、F所示,经充分反应后,发现烧瓶a中充满液体,b中有
,进行喷泉实验如图E、F所示,经充分反应后,发现烧瓶a中充满液体,b中有 体积的液体,则两烧瓶内溶质的物质的量浓度的关系是 。
体积的液体,则两烧瓶内溶质的物质的量浓度的关系是 。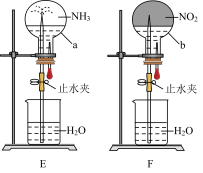
| A.a>b | B.a<b | C.a=b | D.不能确定 |
您最近一年使用:0次
名校
解题方法
7 . 实验室可用如图装置(略去部分夹持仪器)制取SO2并验证其性质。____ 。
(2)装置B的作用之一是通过观察产生气泡的多少判断SO2生成的快慢,其中的液体最好选择______ (填代号)。
a.蒸馏水 b.饱和NaHCO3溶液 c.饱和NaHSO3溶液 d.饱和NaOH溶液
(3)C试管中的试剂可以验证二氧化硫的氧化性,现象为_______ 。
(4)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀。
上述方案中能达到实验目的的是方案____ (填“Ⅰ”“Ⅱ”或“Ⅲ”);试管D中发生反应的离子方程式为_____ 。
(5)装置E的作用是______ 。装置F中为_____ 溶液。
(2)装置B的作用之一是通过观察产生气泡的多少判断SO2生成的快慢,其中的液体最好选择
a.蒸馏水 b.饱和NaHCO3溶液 c.饱和NaHSO3溶液 d.饱和NaOH溶液
(3)C试管中的试剂可以验证二氧化硫的氧化性,现象为
(4)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀。
上述方案中能达到实验目的的是方案
(5)装置E的作用是
您最近一年使用:0次
2024-04-04更新
|
127次组卷
|
2卷引用:天津市静海区第一中学2023-2024学年高一下学期3月月考化学试题
名校
解题方法
8 . 某同学用下列装置完成了浓硫酸和SO2性质实验(夹持装置已省略)。下列说法正确的是
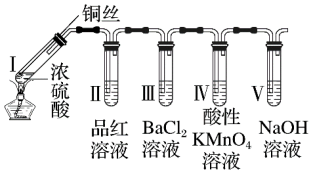
| A.反应后,向试管Ⅰ中的白色固体中加入蒸馏水,溶液呈蓝色 |
| B.取下试管Ⅲ并不断振荡,试管中出现浑浊,是因为生成了BaSO4 |
| C.试管Ⅳ中KMnO4溶液褪色,说明SO2具有氧化性 |
| D.试管Ⅴ中的NaOH溶液可用NaHSO3溶液代替 |
您最近一年使用:0次
2024-04-04更新
|
235次组卷
|
2卷引用:天津市静海区第一中学2023-2024学年高一下学期3月月考化学试题
解题方法
9 . 氯气是一种重要的化工原料,可用于制备盐酸、漂白剂和杀菌消毒剂等。
(1)1774年的舍勒用软锰矿粉末(主要成分是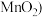 和浓盐酸混合加热制备氯气。反应的化学方程式为:
和浓盐酸混合加热制备氯气。反应的化学方程式为:_______ ;其中,_______ 是还原剂,_______ 是还原产物。
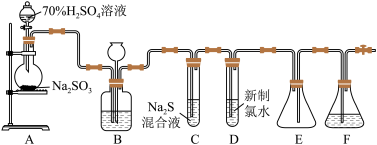
(2)某化学兴趣小组用不同的方法利用下图装置制取并探究氯气的性质。A装置中发生反应的化学方程式为:
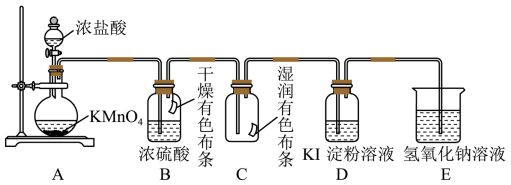
按图组装好实验装置后,首先进行的操作是_______ 。
(3)A装置中盛放浓盐酸的仪器的名称是_______ ,B装置中浓硫酸的作用_______ 。
(4)实验进行一段时间后,可观察到_______ (填“B”或“C” )装置中有色布条褪色。
(5)已知:Cl2+2KI=I2+2KCl。当氯气进入D装置后,可观察到溶液颜色变为_______ (填“红色”或“蓝色”)。
(6)E装置中NaOH溶液的作用是_______ 。
(1)1774年的舍勒用软锰矿粉末(主要成分是
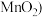 和浓盐酸混合加热制备氯气。反应的化学方程式为:
和浓盐酸混合加热制备氯气。反应的化学方程式为:(2)某化学兴趣小组用不同的方法利用下图装置制取并探究氯气的性质。A装置中发生反应的化学方程式为:


按图组装好实验装置后,首先进行的操作是
(3)A装置中盛放浓盐酸的仪器的名称是
(4)实验进行一段时间后,可观察到
(5)已知:Cl2+2KI=I2+2KCl。当氯气进入D装置后,可观察到溶液颜色变为
(6)E装置中NaOH溶液的作用是
您最近一年使用:0次
10 . 二氧化锰与浓盐酸在加热的条件下会生成氯气,化学小组同学设计如下实验验证氯气的部分性质,并探究氯水的成分和性质。
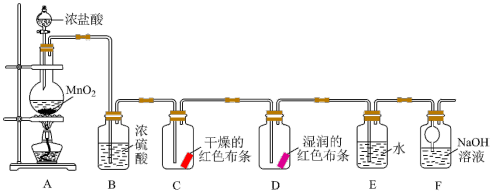
回答下列问题:
(1)验证干燥的氯气没有漂白性的现象为_________ 。
(2)装置F的作用是_________ 。
(3)研究新制氯水成分和性质。以装置E的溶液进行下列实验
资料:淀粉的特征反应——遇I2变蓝色。
①根据实验1可知氧化性:Cl2_________ I2(填“>”或“<”)。
②实验2中证明溶液中含有_________ (填微粒的化学式)。
③若用实验3证明氯水中含有氯离子,用离子方程式表示产生该实验现象的反应:_________ 。
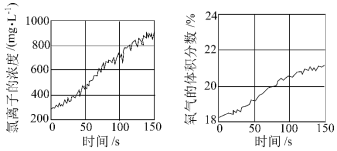
(4)同学们发现久置的氯水会失去漂白性。为探究氯水失效的原因进行实验:用强光照射盛有氯水的密闭广口瓶,并用传感器测定数据,得到如图曲线。两图中曲线变化的原因是_________ (用化学方程式表示)。

回答下列问题:
(1)验证干燥的氯气没有漂白性的现象为
(2)装置F的作用是
(3)研究新制氯水成分和性质。以装置E的溶液进行下列实验
实验序号 | 实验1 | 实验2 | 实验3 |
实验操作 |
|
| |
实验现象 | 溶液变蓝 | 石蕊溶液先变红,后褪色 | 有白色沉淀生成 |
①根据实验1可知氧化性:Cl2
②实验2中证明溶液中含有
③若用实验3证明氯水中含有氯离子,用离子方程式表示产生该实验现象的反应:
(4)同学们发现久置的氯水会失去漂白性。为探究氯水失效的原因进行实验:用强光照射盛有氯水的密闭广口瓶,并用传感器测定数据,得到如图曲线。两图中曲线变化的原因是

您最近一年使用:0次