1 . 某实验小组探究FeCl3溶液与NaHSO3溶液的反应,实验内容及结果如下。
已知:A.K3[Fe(CN)6]可与Fe2+反应生成KFe[Fe(CN)6]沉淀(带有特征蓝色);
B.NaHSO3具有较强还原性,易被空气中的氧气氧化。
下列说法错误的是
| 实验内容 | 实验结果 |
| ①粒子数目相等的FeCl3溶液与NaHSO3溶液在烧杯中混合,得溶液a | 烧杯中无沉淀、无气体,液体呈红褐色 |
| ②取少量液体a用激光笔照射 | 产生丁达尔效应 |
| ③取少量液体a,向其中加入盐酸酸化的BaCl2溶液 | 产生白色沉淀 |
| ④取少量液体a,向其中加入K3[Fe(CN)6]溶液 | 产生特征蓝色沉淀 |
| ⑤取少量液体a,静置一段时间 | 溶液颜色越来越浅,30min后接近无色 |
B.NaHSO3具有较强还原性,易被空气中的氧气氧化。
下列说法错误的是
| A.①、②中的实验现象说明:两种溶液混合生成了氢氧化铁胶体 |
B.③中的实验现象说明:HSO 已经被Fe3+氧化生成了SO 已经被Fe3+氧化生成了SO |
| C.④中产生蓝色沉淀的离子方程式为:K++[Fe(CN)6]3-+Fe2+=KFe[Fe(CN)6]↓ |
| D.④、⑤中的实验现象说明:FeCl3溶液与NaHSO3溶液混合还发生了氧化还原反应。根据氧化还原反应的方程式预测,反应后混合溶液酸性会增强 |
您最近一年使用:0次
2022-10-07更新
|
123次组卷
|
2卷引用:湖北省武汉市第十一中学2022-2023学年高一上学期10月月考化学试题
解题方法
2 . 某化学兴趣小组为探究 SO2的性质,按如图所示装置进行实验。

请回答下列问题:
(1)装置 A 中盛放浓硫酸的仪器名称是_______ ,A 中化学方程式为_______ 。
(2)反应后,装置 B 中发生反应的离子方程式_______ , 装置 C 中的现象是_______ ,表现了SO2具有_______ 性;装置D 中现象是_______ ,发生反应的化学方程式_______ 。
(3)装置E中的现象是_______ ,表现了 SO2具有_______ 性,F装置的作用是_______ ,漏斗的作用是_______ 。

请回答下列问题:
(1)装置 A 中盛放浓硫酸的仪器名称是
(2)反应后,装置 B 中发生反应的离子方程式
(3)装置E中的现象是
您最近一年使用:0次
名校
解题方法
3 . 某化学兴趣小组利用以下装置探究氯气与氨气之间的反应。其中装置A、F分别为氨气和氯气的发生装置,装置C为纯净、干燥的氯气与氨气发生反应的装置。回答下列问题:
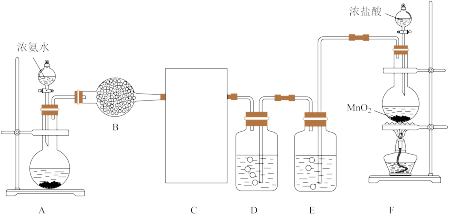
(1)装置F中发生反应的化学方程式是_______ 。
(2)盛有浓氨水的仪器名称是_______ ,E中的试剂是_______ 。
(3)C中的装置应选用图中的_______ (填甲或乙)。

(4)装置C中集气瓶中有大量白烟产生,另一产物是空气主要成分,写出发生反应的化学方程式_______ 。
(5)兴趣小组查资料得知,在催化剂作用下,NH3与NO2能反应生成无污染的产物。另外收集了少量NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子 夹好)
夹好)
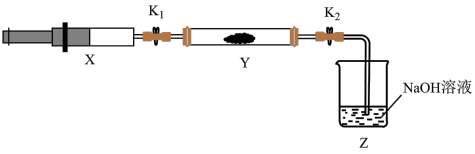
。

(1)装置F中发生反应的化学方程式是
(2)盛有浓氨水的仪器名称是
(3)C中的装置应选用图中的

(4)装置C中集气瓶中有大量白烟产生,另一产物是空气主要成分,写出发生反应的化学方程式
(5)兴趣小组查资料得知,在催化剂作用下,NH3与NO2能反应生成无污染的产物。另外收集了少量NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子
 夹好)
夹好)
| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢入Y管中 | Y管中红棕色气体慢慢变浅 | 反应的化学方程式① |
| 将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
| 打开K2 | ② | ③ |
您最近一年使用:0次
2022-09-09更新
|
127次组卷
|
2卷引用:湖北省沙市中学2022-2023学年高二上学期第一次月考化学试题
名校
4 . 在初中化学“金属的性质”中有如下实验:将无锈铁钉浸入CuSO4溶液,观察到铁钉表面出现红色物质。研究性学习小组对其展开了进一步探究。
【提出问题】Al和CuSO4溶液也能发生化学反应吗?
(1)预测Al能和CuSO4溶液反应,理由是_______ 。
【进行实验】将一端缠绕的铝丝浸入CuSO4溶液(如图),观察现象。

(2)铝丝表面未出现红色物质,原因是_______ 。
【实验改进】用砂纸将铝丝表面打磨光亮,将其浸入CuSO4溶液,观察现象。
(3)填写实验报告单:
【深入探究】为研究上述异常现象,同学们查阅了相关资料,继续开展探究。
资料:①Cu2(OH)2SO4呈蓝绿色,不溶于水;②Cl-可加快铝丝和其他物质的反应速率。
(4)取出铝丝,将试管中的混合物分离得到蓝绿色固体。加入稀硫酸,固体溶解形成蓝色溶液,该反应的化学方程式为_______ 。
(5)欲加快Al和CuSO4溶液的反应,可加入的物质是_______ (填一种即可)。
【拓展应用】通过探究,同学们提出了铝制品使用的注意事项。
(6)下列食品不能长时间用铝制炊具盛放的是_______(填序号)。
【提出问题】Al和CuSO4溶液也能发生化学反应吗?
(1)预测Al能和CuSO4溶液反应,理由是
【进行实验】将一端缠绕的铝丝浸入CuSO4溶液(如图),观察现象。

(2)铝丝表面未出现红色物质,原因是
【实验改进】用砂纸将铝丝表面打磨光亮,将其浸入CuSO4溶液,观察现象。
(3)填写实验报告单:
| 序号 | 实验现象 | 结论与解释 |
| ① | 铝丝表面有少量气泡;铝丝周围出现蓝绿色物质 | CuSO4溶液呈弱酸性,与Al反应产生的气体是 |
| ② | 24h后,铝丝仍光亮;48h后,铝丝表面出现少量红色物质 | 红色物质是 |
| ③ | 铝丝周围溶液逐渐变成无色,铝丝以下溶液仍为蓝色:两层溶液界面清晰 | 反应生成的Al2(SO4)3为无色;Al2(SO4)3溶液的密度 |
【深入探究】为研究上述异常现象,同学们查阅了相关资料,继续开展探究。
资料:①Cu2(OH)2SO4呈蓝绿色,不溶于水;②Cl-可加快铝丝和其他物质的反应速率。
(4)取出铝丝,将试管中的混合物分离得到蓝绿色固体。加入稀硫酸,固体溶解形成蓝色溶液,该反应的化学方程式为
(5)欲加快Al和CuSO4溶液的反应,可加入的物质是
【拓展应用】通过探究,同学们提出了铝制品使用的注意事项。
(6)下列食品不能长时间用铝制炊具盛放的是_______(填序号)。
| A.食醋 | B.食用油 | C.面粉 | D.咸菜 |
您最近一年使用:0次
解题方法
5 . 乳酸亚铁晶体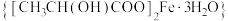 是一种很好的食品铁强化剂,吸收效果比无机铁好,易溶于水,几乎不溶于乙醇,可由乳酸与
是一种很好的食品铁强化剂,吸收效果比无机铁好,易溶于水,几乎不溶于乙醇,可由乳酸与 反应制得。
反应制得。
I.制备碳酸亚铁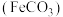
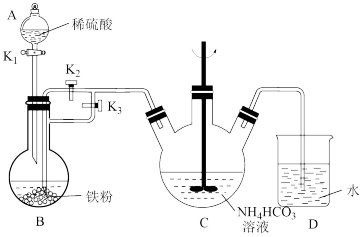
实验步骤如下:
a.检查装置气密性,添加药品,并将导管末端插入D中水面以下;
b.装置B中制取硫酸亚铁,并将整个装置内的空气排净;
c.操作开关,将B中溶液导入C中产生 沉淀;
沉淀;
d.将C中混合物分离提纯,获得纯净的碳酸亚铁产品。
(1)甲同学查阅资料了解到Fe(Ⅱ)易被氧化,以上步骤中,他采用了一些操作避免Fe(Ⅱ)被氧化,请摘抄出相关内容_______ 。
(2)仪器C的名称是_______ ,C中生成 的离子方程式是
的离子方程式是_______ 。
(3)步骤b中应打开的开关是_______ (选填“ ”“
”“ ”或“
”或“ ),步骤c中应如何操作开关?
),步骤c中应如何操作开关?_______ (选填“ ”“
”“ ”或“
”或“ )。
)。
II.制备乳酸亚铁晶体
将制得的 加入到乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后加入适量乳酸。冷却,加入乙醇,过滤,再洗涤和干燥,得到产品。
加入到乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后加入适量乳酸。冷却,加入乙醇,过滤,再洗涤和干燥,得到产品。
(4)配制乳酸亚铁溶液时,加入少量铁粉的目的是_______ 。
(5)冷却,加入乙醇的目的是_______ 。
III.探究乳酸亚铁晶体中铁元素的含量
乙同学称取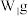 样品溶于水,用
样品溶于水,用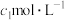 的酸性
的酸性 标准溶液滴定,当溶液恰好显浅红色,且30s内浅红色不褪去,停止滴定,测得消耗标准溶液
标准溶液滴定,当溶液恰好显浅红色,且30s内浅红色不褪去,停止滴定,测得消耗标准溶液 。
。
(6)乙同学方案是否正确?_______ (选填“是”或“否”),如填“是”,计算铁元素的质量分数(用含有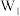 、
、 、
、 的代数式表示)。如填“否”,说明偏高还是偏低,并写出理由。
的代数式表示)。如填“否”,说明偏高还是偏低,并写出理由。_______ 。
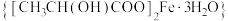 是一种很好的食品铁强化剂,吸收效果比无机铁好,易溶于水,几乎不溶于乙醇,可由乳酸与
是一种很好的食品铁强化剂,吸收效果比无机铁好,易溶于水,几乎不溶于乙醇,可由乳酸与 反应制得。
反应制得。I.制备碳酸亚铁
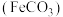

实验步骤如下:
a.检查装置气密性,添加药品,并将导管末端插入D中水面以下;
b.装置B中制取硫酸亚铁,并将整个装置内的空气排净;
c.操作开关,将B中溶液导入C中产生
 沉淀;
沉淀;d.将C中混合物分离提纯,获得纯净的碳酸亚铁产品。
(1)甲同学查阅资料了解到Fe(Ⅱ)易被氧化,以上步骤中,他采用了一些操作避免Fe(Ⅱ)被氧化,请摘抄出相关内容
(2)仪器C的名称是
 的离子方程式是
的离子方程式是(3)步骤b中应打开的开关是
 ”“
”“ ”或“
”或“ ),步骤c中应如何操作开关?
),步骤c中应如何操作开关? ”“
”“ ”或“
”或“ )。
)。II.制备乳酸亚铁晶体
将制得的
 加入到乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后加入适量乳酸。冷却,加入乙醇,过滤,再洗涤和干燥,得到产品。
加入到乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后加入适量乳酸。冷却,加入乙醇,过滤,再洗涤和干燥,得到产品。(4)配制乳酸亚铁溶液时,加入少量铁粉的目的是
(5)冷却,加入乙醇的目的是
III.探究乳酸亚铁晶体中铁元素的含量
乙同学称取
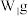 样品溶于水,用
样品溶于水,用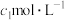 的酸性
的酸性 标准溶液滴定,当溶液恰好显浅红色,且30s内浅红色不褪去,停止滴定,测得消耗标准溶液
标准溶液滴定,当溶液恰好显浅红色,且30s内浅红色不褪去,停止滴定,测得消耗标准溶液 。
。(6)乙同学方案是否正确?
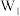 、
、 、
、 的代数式表示)。如填“否”,说明偏高还是偏低,并写出理由。
的代数式表示)。如填“否”,说明偏高还是偏低,并写出理由。
您最近一年使用:0次
6 . 用如图所示装置进行Fe与水蒸气反应的实验,下列有关说法正确的是

| A.实验时,先点燃酒精喷灯再点燃酒精灯 |
| B.反应中H2O作氧化剂,发生反应的化学方程式为2Fe+3H2O=Fe2O3+3H2 |
| C.干燥管中加入的固体干燥剂可以是无水氯化钙 |
| D.收集反应产生的气体选用装置② |
您最近一年使用:0次
2022-07-18更新
|
1123次组卷
|
13卷引用:湖北省十堰市2020-2021学年高一上学期期末考试化学试题
湖北省十堰市2020-2021学年高一上学期期末考试化学试题吉林省磐石一中、伊通一中、梅河口五中、四平一中等2020-2021学年高一上学期期末考试化学试题安徽省皖西南联盟2020-2021学年高一上学期期末考试化学试题江西省抚州市2020-2021学年高一上学期学生学业发展水平测试(期末考试) 化学(B卷) 试题(已下线)新人教必修1第3章第一节第1课时铁的单质(课后)(已下线)《新教材变化解读及考法剖析 》(人教版2019必修第一册)第三章河北省衡水市第十四中学2020-2021学年高一下学期摸底考试化学试题黑龙江省哈尔滨师范大学附属中学2021-2022学年高一下学期期末考试化学试题(已下线)第三章 铁 金属材料(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)福建省龙岩第一中学2022-2023学年高一上学期第二次月考化学试题(已下线)考点巩固卷03 金属及其化合物(4大考点48题)-2024年高考化学一轮复习考点通关卷(新高考通用)吉林省吉林市第一中学2023-2024学年高一上学期11月期中化学试题(已下线)课时1 铁的单质
7 . 某实验小组用下列装置进行乙醇的实验,试回答下列问题:
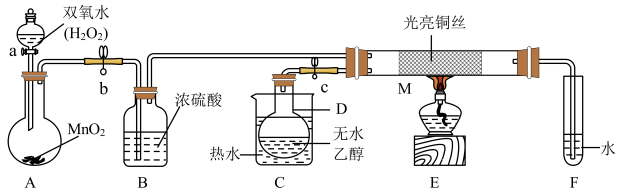
(1)A中发生反应的化学方程式为___________ ,还可以用___________ 代替 的作用。
的作用。
(2)实验过程中M处铜丝网有红色和黑色交替出现的现象,请用化学方程式解释原因。现象①:红色变黑色:_______ ;现象②:黑色变红色:______ ,其反应类型为_______ 。
(3)由于反应速率不易控制,在F装置中有可能产生倒吸,所以F装置可改用____ 装置(填字母)。

(4)实验室可对E部分采取合理的操作方法以防止安全隐患,请对此提出你的意见:_____ 。
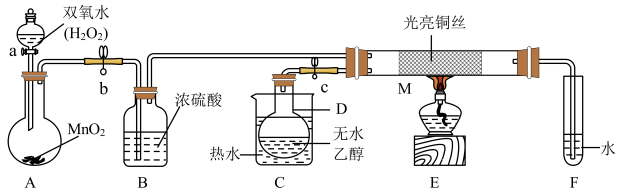
(1)A中发生反应的化学方程式为
 的作用。
的作用。(2)实验过程中M处铜丝网有红色和黑色交替出现的现象,请用化学方程式解释原因。现象①:红色变黑色:
(3)由于反应速率不易控制,在F装置中有可能产生倒吸,所以F装置可改用

(4)实验室可对E部分采取合理的操作方法以防止安全隐患,请对此提出你的意见:
您最近一年使用:0次
2022-07-14更新
|
409次组卷
|
2卷引用:湖北省华中师范大学第一附属中学2021-2022学年高一下学期期末考试化学试题
8 .  与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐。某兴趣小组利用如图装置以
与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐。某兴趣小组利用如图装置以 分别与KOH溶液和NaOH溶液反应为原理,制备
分别与KOH溶液和NaOH溶液反应为原理,制备 和NaClO,并探究
和NaClO,并探究 和NaClO的部分性质。
和NaClO的部分性质。
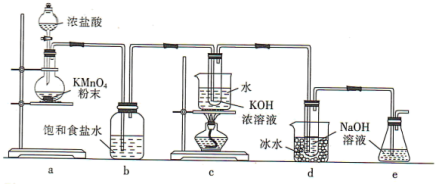
回答下列问题:
(1)a装置所用玻璃仪器的名称为______ (任意写一种);发生反应的离子方程式为____________ 。
(2)b装置的作用是____________ ;e装置的作用是____________ 。
(3)已知:c装置中得到的是 ,d装置中得到的是NaClO。
,d装置中得到的是NaClO。
①由此判断氯气与碱反应时,影响产物的因素有____________ 。
②NaClO溶液常温时稳定,受热时会生成两种盐,NaBrO溶液在0℃时稳定,常温时会生成两种盐,则常温时, 与KOH溶液反应的离子方程式为
与KOH溶液反应的离子方程式为____________ 。
(4)取少量c、d装置中生成的 和NaClO溶液(两溶液均调至碱性),分别置于1号和2号试管中,向两试管中分别滴加等量且适量的KI溶液。1号试管溶液颜色不变;2号试管溶液颜色变为棕色,加入
和NaClO溶液(两溶液均调至碱性),分别置于1号和2号试管中,向两试管中分别滴加等量且适量的KI溶液。1号试管溶液颜色不变;2号试管溶液颜色变为棕色,加入 ,振荡、静置后
,振荡、静置后 层显
层显_______ 色。由此可推知,在碱性条件下, 的氧化能力
的氧化能力______ (填“>”或“<”)NaClO的氧化能力。
(5)该兴趣小组在40℃条件下,将一定量的 通入600 mL
通入600 mL  NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和
NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和 ,则参加反应的
,则参加反应的 的物质的量为
的物质的量为______ mol。
 与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐。某兴趣小组利用如图装置以
与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐。某兴趣小组利用如图装置以 分别与KOH溶液和NaOH溶液反应为原理,制备
分别与KOH溶液和NaOH溶液反应为原理,制备 和NaClO,并探究
和NaClO,并探究 和NaClO的部分性质。
和NaClO的部分性质。
回答下列问题:
(1)a装置所用玻璃仪器的名称为
(2)b装置的作用是
(3)已知:c装置中得到的是
 ,d装置中得到的是NaClO。
,d装置中得到的是NaClO。①由此判断氯气与碱反应时,影响产物的因素有
②NaClO溶液常温时稳定,受热时会生成两种盐,NaBrO溶液在0℃时稳定,常温时会生成两种盐,则常温时,
 与KOH溶液反应的离子方程式为
与KOH溶液反应的离子方程式为(4)取少量c、d装置中生成的
 和NaClO溶液(两溶液均调至碱性),分别置于1号和2号试管中,向两试管中分别滴加等量且适量的KI溶液。1号试管溶液颜色不变;2号试管溶液颜色变为棕色,加入
和NaClO溶液(两溶液均调至碱性),分别置于1号和2号试管中,向两试管中分别滴加等量且适量的KI溶液。1号试管溶液颜色不变;2号试管溶液颜色变为棕色,加入 ,振荡、静置后
,振荡、静置后 层显
层显 的氧化能力
的氧化能力(5)该兴趣小组在40℃条件下,将一定量的
 通入600 mL
通入600 mL  NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和
NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和 ,则参加反应的
,则参加反应的 的物质的量为
的物质的量为
您最近一年使用:0次
2022-07-12更新
|
112次组卷
|
2卷引用:湖北省恩施州高中教育联盟2021-2022学年高二下学期期末考试化学试题
名校
解题方法
9 . 亚硝酸钠(NaNO2)的外观与NaCl相似,有毒。它在工业上可作染料、助染剂,医药上能用作器碱消毒剂、防腐剂等。
已知:①NaNO2有强氧化性又有还原性;
②NO能被酸性KMnO4氧化成硝酸根离子;
③亚硝酸是弱酸,很不稳定,易分解为NO2、NO和水。
某兴趣小组用下列装置(夹持仪器已省略)制取较纯净的NaNO2。
反应原理为:2NO+Na2O2=2NaNO2

回答下列问题:
(1)乙装置的仪器名称是____ ,装置乙的作用是____ 。
(2)甲中滴入稀硝酸前需先通入N2,原因是____ 。
(3)甲装置中发生反应的离子方程式为____ 。
(4)反应过程中观察到丙中的现象为___ 。
(5)丁中酸性KMnO4的作用是____ 。
(6)设计实验证明丙装置有NaNO2生成____ (写出操作、试剂和现象)。
已知:①NaNO2有强氧化性又有还原性;
②NO能被酸性KMnO4氧化成硝酸根离子;
③亚硝酸是弱酸,很不稳定,易分解为NO2、NO和水。
某兴趣小组用下列装置(夹持仪器已省略)制取较纯净的NaNO2。
反应原理为:2NO+Na2O2=2NaNO2

回答下列问题:
(1)乙装置的仪器名称是
(2)甲中滴入稀硝酸前需先通入N2,原因是
(3)甲装置中发生反应的离子方程式为
(4)反应过程中观察到丙中的现象为
(5)丁中酸性KMnO4的作用是
(6)设计实验证明丙装置有NaNO2生成
您最近一年使用:0次
2022-07-12更新
|
325次组卷
|
2卷引用:湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题
10 . FeCl3(易升华)是常见的化学试剂。某学习小组开展了与FeCl3相关的系列实验。回答下列问题:
Ⅰ.铁粉制备FeCl3(实验装置如图所示)
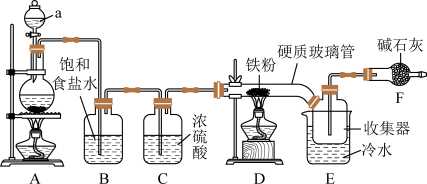
(1)仪器a的名称为_______
(2)制取Cl2的化学方程式为_______ 。
(3)饱和食盐水的作用是_______
(4)硬质玻璃管直接接入收集器的优点是_______ 。
Ⅱ.探究FeCl3溶液与Cu的反应
(5)配制FeCl3溶液时加入少量盐酸的原因是_______ 。
(6)向FeCl3溶液中滴加几滴KSCN溶液,溶液颜色变红,再加入过量Cu粉,发现溶液的红色褪去。用离子方程式解释红色褪去的原因:_______ 。
(7)已知(6)中除了红色褪去,还产生了白色沉淀。小组成员查阅得知CuCl和CuSCN均为白色沉淀。为探究白色沉淀的主要成分,小组成员完成了以下实验:向4 mL 0.1 mol·L-1FeCl3溶液中加入过量Cu粉,静置,取上层清液于试管中,滴加3滴KSCN溶液,有白色沉淀生成。由此现象可知此白色沉淀为_______ (填化学式)。
小组成员进一步查阅资料发现, Cu2+与SCN-可发生如下两种反应。
反应i: Cu2+ + 4SCN- =[ Cu(SCN)4]2 -(淡黄色)
反应ii: 2Cu2+ + 4SCN- = 2CuSCN↓+ (SCN)2
设计实验如下:
由此现象可知,反应速率较快的为_______ (填“反应i”或“反应ii”)。 小组成员得出结论,反应ii不是CuSCN产生的主要原因。
(8)根据上述分析可知,Cu2+、 Fe2+和SCN-可直接发生反应,生成CuSCN和Fe3+,写出反应的离子方程式:_______ 。
Ⅰ.铁粉制备FeCl3(实验装置如图所示)

(1)仪器a的名称为
(2)制取Cl2的化学方程式为
(3)饱和食盐水的作用是
(4)硬质玻璃管直接接入收集器的优点是
Ⅱ.探究FeCl3溶液与Cu的反应
(5)配制FeCl3溶液时加入少量盐酸的原因是
(6)向FeCl3溶液中滴加几滴KSCN溶液,溶液颜色变红,再加入过量Cu粉,发现溶液的红色褪去。用离子方程式解释红色褪去的原因:
(7)已知(6)中除了红色褪去,还产生了白色沉淀。小组成员查阅得知CuCl和CuSCN均为白色沉淀。为探究白色沉淀的主要成分,小组成员完成了以下实验:向4 mL 0.1 mol·L-1FeCl3溶液中加入过量Cu粉,静置,取上层清液于试管中,滴加3滴KSCN溶液,有白色沉淀生成。由此现象可知此白色沉淀为
小组成员进一步查阅资料发现, Cu2+与SCN-可发生如下两种反应。
反应i: Cu2+ + 4SCN- =[ Cu(SCN)4]2 -(淡黄色)
反应ii: 2Cu2+ + 4SCN- = 2CuSCN↓+ (SCN)2
设计实验如下:
| 操作 | 现象 |
| 在盛有2 mL 0.1mol·L-1 CuSO4溶液的试管中滴加KSCN溶液 | 溶液很快由蓝色变为绿色,未观察到白色沉淀; 2h后溶液为绿色,未观察到白色沉淀;24h后,溶液绿色变浅,试管底部有白色沉淀 |
(8)根据上述分析可知,Cu2+、 Fe2+和SCN-可直接发生反应,生成CuSCN和Fe3+,写出反应的离子方程式:
您最近一年使用:0次



