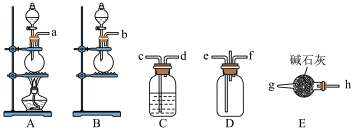
1 . 某化学探究活动小组为制备 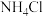 并探究
并探究  的某些性质,进行了以下实验:
的某些性质,进行了以下实验:
(1)该小组用 和HCl合成
和HCl合成 (实验装置如图)。
(实验装置如图)。
①在A装置中利用浓硫酸和 NaCl制备 HCl,写出用 A 装置制备 HCl时发生反应的化学方程式:___________ 。若B装置的分液漏斗中装浓氨水,烧瓶中盛放的试剂为___________ 。
②为使 和HCl充分混合并反应,上述装置的连接顺序为a→c→d→
和HCl充分混合并反应,上述装置的连接顺序为a→c→d→___________ ,___________ ←g←h←b。
③D装置的不足之处为___________ 。
(2)取0.5g 镁粉加入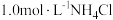 溶液中进行
溶液中进行  性质探究实验,观察到反应剧烈,产生有刺激性气味的气体和灰白色难溶固体。该小组进行以下探究:
性质探究实验,观察到反应剧烈,产生有刺激性气味的气体和灰白色难溶固体。该小组进行以下探究:
①气体成分探究:
用排水(滴加几滴石蕊)法收集一小试管产生的气体,滴有石蕊的水溶液颜色变为___________ ,经检验小试管中气体为 H2。
②沉淀成分探究:
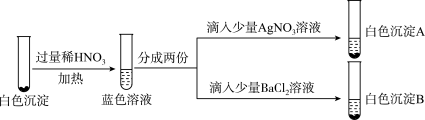
过滤,将得到的灰白色固体洗涤数次,至洗涤液中滴加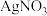 溶液后无明显浑浊。将洗涤后的固体溶于稀 HNO3,再滴加 AgNO3溶液,出现白色沉淀。灰白色固体可能是
溶液后无明显浑浊。将洗涤后的固体溶于稀 HNO3,再滴加 AgNO3溶液,出现白色沉淀。灰白色固体可能是___________ (填化学式)。
③反应机理探究:
猜想一:NH4Cl溶液中c(H⁺)大,与Mg反应快。
猜想二:NH 与Mg反应剧烈,产生氢气。
与Mg反应剧烈,产生氢气。
资料显示:a.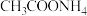 溶液呈中性;b.Cl⁻对该反应几乎无影响。
溶液呈中性;b.Cl⁻对该反应几乎无影响。
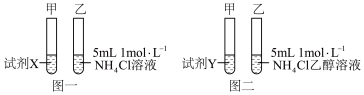
为验证猜想一,小组设计如图一实验,分别向两试管中加入0.5g Mg粉,结果两试管反应剧烈程度相当,说明猜想 不合理,试剂X应为___________ 。
为验证猜想二,小组设计如图二实验,分别向两试管中加入0.5g Mg粉,结果甲试管无现象,乙试管反应剧烈,说明猜想二合理,试剂Y应为___________ 。
 并探究
并探究  的某些性质,进行了以下实验:
的某些性质,进行了以下实验:(1)该小组用
 和HCl合成
和HCl合成 (实验装置如图)。
(实验装置如图)。
①在A装置中利用浓硫酸和 NaCl制备 HCl,写出用 A 装置制备 HCl时发生反应的化学方程式:
②为使
 和HCl充分混合并反应,上述装置的连接顺序为a→c→d→
和HCl充分混合并反应,上述装置的连接顺序为a→c→d→③D装置的不足之处为
(2)取0.5g 镁粉加入
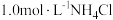 溶液中进行
溶液中进行  性质探究实验,观察到反应剧烈,产生有刺激性气味的气体和灰白色难溶固体。该小组进行以下探究:
性质探究实验,观察到反应剧烈,产生有刺激性气味的气体和灰白色难溶固体。该小组进行以下探究:①气体成分探究:
用排水(滴加几滴石蕊)法收集一小试管产生的气体,滴有石蕊的水溶液颜色变为
②沉淀成分探究:
过滤,将得到的灰白色固体洗涤数次,至洗涤液中滴加
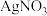 溶液后无明显浑浊。将洗涤后的固体溶于稀 HNO3,再滴加 AgNO3溶液,出现白色沉淀。灰白色固体可能是
溶液后无明显浑浊。将洗涤后的固体溶于稀 HNO3,再滴加 AgNO3溶液,出现白色沉淀。灰白色固体可能是③反应机理探究:
猜想一:NH4Cl溶液中c(H⁺)大,与Mg反应快。
猜想二:NH
 与Mg反应剧烈,产生氢气。
与Mg反应剧烈,产生氢气。资料显示:a.
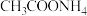 溶液呈中性;b.Cl⁻对该反应几乎无影响。
溶液呈中性;b.Cl⁻对该反应几乎无影响。为验证猜想一,小组设计如图一实验,分别向两试管中加入0.5g Mg粉,结果两试管反应剧烈程度相当,说明猜想 不合理,试剂X应为

为验证猜想二,小组设计如图二实验,分别向两试管中加入0.5g Mg粉,结果甲试管无现象,乙试管反应剧烈,说明猜想二合理,试剂Y应为
您最近一年使用:0次
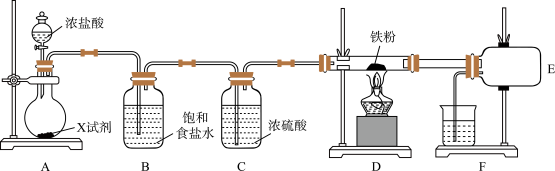
2 . 某化学小组制取无水三氯化铁并研究其与铜的反应,设计如下实验。
I.制备无水三氯化铁实验装置如图。(已知无水三氯化铁易潮解,100℃左右升华)___________ 。
(2)整个装置充满黄绿色气体后,才开始加热D装置的目的是___________ 。
(3)若实验过程中三氯化铁沉积在D与E的导管之间,导致导管内径变小,除去沉积的三氯化铁的简易操作是___________ ;此装置存在明显的缺陷,你的改进方案是___________ 。
II.探究三氯化铁与铜反应的实验如图:(已知:KSCN中的C为+4价)___________ 。
(5)为了进一步研究白色沉淀进行如图实验。___________ (填化学式)。
②白色沉淀之一(用D表示)与过量稀硝酸反应生成白色沉淀B含有阴离子,同时生成 、NO、
、NO、 气体。D与硝酸反应中还原剂与氧化剂物质的量之比为
气体。D与硝酸反应中还原剂与氧化剂物质的量之比为___________ 。
I.制备无水三氯化铁实验装置如图。(已知无水三氯化铁易潮解,100℃左右升华)
(2)整个装置充满黄绿色气体后,才开始加热D装置的目的是
(3)若实验过程中三氯化铁沉积在D与E的导管之间,导致导管内径变小,除去沉积的三氯化铁的简易操作是
II.探究三氯化铁与铜反应的实验如图:(已知:KSCN中的C为+4价)
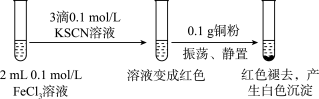
(5)为了进一步研究白色沉淀进行如图实验。
②白色沉淀之一(用D表示)与过量稀硝酸反应生成白色沉淀B含有阴离子,同时生成
 、NO、
、NO、 气体。D与硝酸反应中还原剂与氧化剂物质的量之比为
气体。D与硝酸反应中还原剂与氧化剂物质的量之比为
您最近一年使用:0次
解题方法
3 . 以下探究目的对应的实验方案最合适的是
| 实验方案 | 探究目的 | |
| A | 向 溶液中加入金属 溶液中加入金属 | 比较 和 和 的还原能力 的还原能力 |
| B | 分别向稀硝酸和稀醋酸中加入铜粉 | 比较稀硝酸和稀醋酸的酸性强弱 |
| C | 将浓硫酸滴入乙醇中,加热至 ,生成的气体通入酸性重铬酸钾溶液 ,生成的气体通入酸性重铬酸钾溶液 | 验证乙烯具有还原性 |
| D | 向 溶液中同时通入 溶液中同时通入 和 和 | 比较 和 和 的氧化能力 的氧化能力 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-01-23更新
|
985次组卷
|
5卷引用:2024届陕西省咸阳市乾县第一中学高三下学期第一次模拟考试理综试题-高中化学
2024届陕西省咸阳市乾县第一中学高三下学期第一次模拟考试理综试题-高中化学2024年1月江西普通高等学校招生考试适应性测试化学试题(已下线)2024年1月“九省联考”江西卷真题完全解读与考后提升(已下线)选择题1-5(已下线)热点08 表格型实验方案的设计与评价
4 . 某小组探究镁与醋酸溶液反应的实质。
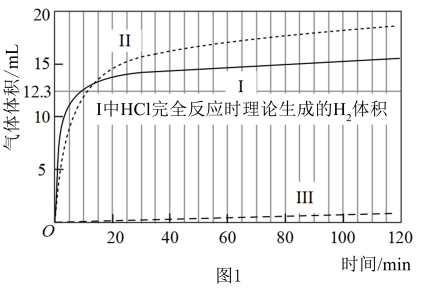
【实验】在常温水浴条件下进行实验Ⅰ~Ⅲ,记录生成气体的体积和溶液 变化,如图1、2。
变化,如图1、2。
Ⅰ.取 光亮的镁屑(过量)放入
光亮的镁屑(过量)放入 溶液中;
溶液中;
Ⅱ.取 光亮的镁屑放入
光亮的镁屑放入 溶液(
溶液( )中;
)中;
Ⅲ.取 光亮的镁屑放入
光亮的镁屑放入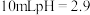 的
的 溶液中。
溶液中。
【数据】
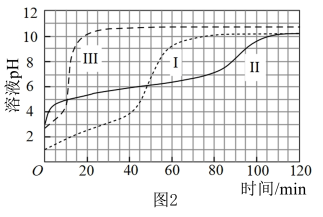
(1)起始阶段Ⅰ中主要反应的离子方程式为___________ 。
(2)Ⅱ起始溶液中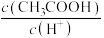 约为
约为___________ (用“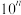 ”表示)。
”表示)。
(3)起始阶段,导致Ⅱ和Ⅲ中气体生成速率差异的主要因素不是 ,实验证据是
,实验证据是___________ 。
基于溶液组成预测Ⅱ的气体生成速率快于Ⅲ的原因是 能直接与
能直接与 反应。
反应。
验证:【实验Ⅳ】室温下,将一小段打磨光亮的镁条投入 冰醋酸中,立即产生大量气体。
冰醋酸中,立即产生大量气体。
(4)选择冰醋酸的理由是___________ 。
探究醋酸溶液中与 反应的主要微粒。
反应的主要微粒。
【实验Ⅴ】与实验Ⅱ相同的条件和试剂用量,将溶液换成含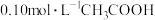 和
和 的
的 混合溶液(
混合溶液( )。各时刻气体生成的瞬时速率(
)。各时刻气体生成的瞬时速率( )对比如下。
)对比如下。
(5)①将a~c时刻对应溶液中的粒子浓度进行排序: :
:___________ (用“>”或“=”连接表示,下同);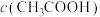 :
:___________ 。
②结合a~c中微粒浓度的比值分析, 和
和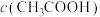 中哪一因素对气体生成速率影响更大:
中哪一因素对气体生成速率影响更大:___________ 。
(6)综合以上实验得出结论:
①镁与醋酸溶液反应时, 、
、 、
、 均能与镁反应产生氢气。
均能与镁反应产生氢气。
② 反应产生气体的主要微粒是
反应产生气体的主要微粒是___________ 。
【实验】在常温水浴条件下进行实验Ⅰ~Ⅲ,记录生成气体的体积和溶液
 变化,如图1、2。
变化,如图1、2。Ⅰ.取
 光亮的镁屑(过量)放入
光亮的镁屑(过量)放入 溶液中;
溶液中;Ⅱ.取
 光亮的镁屑放入
光亮的镁屑放入 溶液(
溶液( )中;
)中;Ⅲ.取
 光亮的镁屑放入
光亮的镁屑放入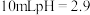 的
的 溶液中。
溶液中。【数据】


(1)起始阶段Ⅰ中主要反应的离子方程式为
(2)Ⅱ起始溶液中
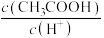 约为
约为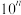 ”表示)。
”表示)。(3)起始阶段,导致Ⅱ和Ⅲ中气体生成速率差异的主要因素不是
 ,实验证据是
,实验证据是基于溶液组成预测Ⅱ的气体生成速率快于Ⅲ的原因是
 能直接与
能直接与 反应。
反应。验证:【实验Ⅳ】室温下,将一小段打磨光亮的镁条投入
 冰醋酸中,立即产生大量气体。
冰醋酸中,立即产生大量气体。(4)选择冰醋酸的理由是
探究醋酸溶液中与
 反应的主要微粒。
反应的主要微粒。【实验Ⅴ】与实验Ⅱ相同的条件和试剂用量,将溶液换成含
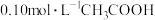 和
和 的
的 混合溶液(
混合溶液( )。各时刻气体生成的瞬时速率(
)。各时刻气体生成的瞬时速率( )对比如下。
)对比如下。| a.Ⅴ起始速率 | b.Ⅱ起始速率 | c.Ⅱ进行到 时速率 时速率 |
| 2.1 | 2.3 | 0.8 |
(5)①将a~c时刻对应溶液中的粒子浓度进行排序:
 :
: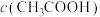 :
:②结合a~c中微粒浓度的比值分析,
 和
和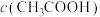 中哪一因素对气体生成速率影响更大:
中哪一因素对气体生成速率影响更大:(6)综合以上实验得出结论:
①镁与醋酸溶液反应时,
 、
、 、
、 均能与镁反应产生氢气。
均能与镁反应产生氢气。②
 反应产生气体的主要微粒是
反应产生气体的主要微粒是
您最近一年使用:0次
5 . 浓硫酸、五氧化二磷都是常用的酸性干燥剂。某小组为了探究它们的干燥能力,设计如下实验(加热装置省略),实验中观察到B中白色粉末变蓝,D中产生白色沉淀,且品红溶液不褪色。回答下列问题:

部分信息如下:
①已知几种物质的熔点、沸点如下表所示:
②Ba3(PO4)2为白色固体,难溶于水。
(1)仪器M的名称是___________ 。D中倒置漏斗的作用是___________ 。
(2)根据B中现象,可推断从A中逸出的物质含___________ (填化学式)。
(3)D中反应的离子方程式为___________ 。
(4)根据实验结果推知,五氧化二磷的干燥能力___________ (填“强于”、“弱于”或“等于”)98.3%硫酸。
(5)下列气体可以用98.3%硫酸干燥,也可以用五氧化二磷干燥的是___________ (填标号)。
a.硫化氢 b.氨气 c.二氧化氮 d.氯气
(6)加热A装置时温度不宜超过213℃,其原因是___________ 。

部分信息如下:
①已知几种物质的熔点、沸点如下表所示:
| 98.3%硫酸 | 磷酸 | 三氧化硫 | |
| 熔点/℃ | 10.5 | 42 | 16.8 |
| 沸点/℃ | 338 | 213 | 44.8 |
(1)仪器M的名称是
(2)根据B中现象,可推断从A中逸出的物质含
(3)D中反应的离子方程式为
(4)根据实验结果推知,五氧化二磷的干燥能力
(5)下列气体可以用98.3%硫酸干燥,也可以用五氧化二磷干燥的是
a.硫化氢 b.氨气 c.二氧化氮 d.氯气
(6)加热A装置时温度不宜超过213℃,其原因是
您最近一年使用:0次
2023-08-31更新
|
198次组卷
|
5卷引用:陕西省部分学校2024届高三上学期8月入学考试化学试题
解题方法
6 . 某研究小组为探究 和
和 溶液反应的实验。设计了如图所示装置进行实验。请回答:
溶液反应的实验。设计了如图所示装置进行实验。请回答:

(1)装置 中仪器
中仪器 的名称为
的名称为___________ 。
(2)装置B中产生了白色沉淀,其成分是___________ 。
(3)下列能作为 尾气处理试剂的是
尾气处理试剂的是___________ (填字母)。
A.酸性高锰酸钾溶液B.浓氢氧化钠溶液C.品红溶液D.氯化钙水溶液E.浓硝酸
(4)欲推测 中产生白色沉淀的原因,有以下三种观点:
中产生白色沉淀的原因,有以下三种观点:
观点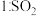 与
与 反应;
反应;
观点2:在酸性条件下 与
与 反应;
反应;
观点3:装置内的氧气将 氧化。
氧化。
①若观点1正确,除产生白色沉淀外,还应观察到的现象是___________
②按观点2,装置 中反应的离子方程式是
中反应的离子方程式是___________
③若要排除观点3的干扰,需要进行的实验操作是___________
(5)若装置 中溶液为
中溶液为 ,充分反应后,溶液中
,充分反应后,溶液中 和
和 消耗完全,则
消耗完全,则 装置中产生的沉淀质量为
装置中产生的沉淀质量为___________ g。
 和
和 溶液反应的实验。设计了如图所示装置进行实验。请回答:
溶液反应的实验。设计了如图所示装置进行实验。请回答:
(1)装置
 中仪器
中仪器 的名称为
的名称为(2)装置B中产生了白色沉淀,其成分是
(3)下列能作为
 尾气处理试剂的是
尾气处理试剂的是A.酸性高锰酸钾溶液B.浓氢氧化钠溶液C.品红溶液D.氯化钙水溶液E.浓硝酸
(4)欲推测
 中产生白色沉淀的原因,有以下三种观点:
中产生白色沉淀的原因,有以下三种观点:观点
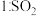 与
与 反应;
反应;观点2:在酸性条件下
 与
与 反应;
反应;观点3:装置内的氧气将
 氧化。
氧化。①若观点1正确,除产生白色沉淀外,还应观察到的现象是
②按观点2,装置
 中反应的离子方程式是
中反应的离子方程式是③若要排除观点3的干扰,需要进行的实验操作是
(5)若装置
 中溶液为
中溶液为 ,充分反应后,溶液中
,充分反应后,溶液中 和
和 消耗完全,则
消耗完全,则 装置中产生的沉淀质量为
装置中产生的沉淀质量为
您最近一年使用:0次
解题方法
7 . 某化学兴趣小组制取SO2并探究SO2与FeCl3溶液的反应,所用装置如图所示。下列说法错误的是

| A.甲中浓硫酸浓度不宜过大,以防止氧化亚硫酸钠 |
| B.乙中反应的氧化剂与还原剂物质的量之比为2:1 |
| C.为尽快观察到乙中的实验现象,可增大FeCl3溶液浓度或加热 |
| D.丙装置的作用是吸收剩余的SO2,防止污染空气,但是应该连接倒扣漏斗 |
您最近一年使用:0次
解题方法
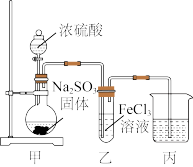
8 . 某兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示:
(1)SO2气体还原Fe3+,其还原产物是_______ (填离子符号),参加反应的SO2和Fe3+的物质的量之比是_______ 。
(2)下列实验方案适用于在实验室制取所需SO2的是_______。
(3)装置C的作用是_______ 。
(4)B中看到的现象是_______ ,发生的化学反应是_______ 。
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是_______ ,原因是_______ 。

(1)SO2气体还原Fe3+,其还原产物是
(2)下列实验方案适用于在实验室制取所需SO2的是_______。
| A.Na2SO3溶液与HNO3 | B.Na2SO3固体与浓硫酸 |
| C.固体硫在纯氧中燃烧 | D.铜与热浓H2SO4 |
(4)B中看到的现象是
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是
您最近一年使用:0次
名校
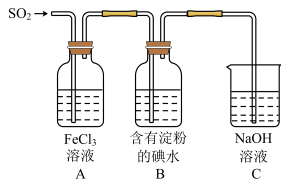
9 . 化学是一门以实验为基础的学科,某同学为探究FeCl3溶液的性质进行如下实验,操作如图所示,根据实验现象,下列分析正确的是

| A.向②后试管加入足量稀盐酸,沉淀全部溶解 |
| B.①~④的变化中,有1处涉及氧化还原反应 |
| C.若将FeCl3溶液滴加到Na2S溶液中,产生的现象与图中①、②现象相同 |
| D.若用Na2SO3代替Na2CO3进行实验,可产生相同现象 |
您最近一年使用:0次
2022-09-15更新
|
833次组卷
|
5卷引用:陕西省咸阳市实验中学2022-2023学年高三上学期第二次月考化学试题
10 . 过二硫酸钾( )是一种白色结晶性粉末,溶于水、不溶于乙醇,具有强氧化性,加热至100℃时会完全分解。某学习小组拟探究过二硫酸钾的性质。
)是一种白色结晶性粉末,溶于水、不溶于乙醇,具有强氧化性,加热至100℃时会完全分解。某学习小组拟探究过二硫酸钾的性质。
实验(一):探究过二硫酸钾的强氧化性。
探究 溶液与
溶液与 溶液反应,实验操作与现象如下:
溶液反应,实验操作与现象如下:
(1)同学甲用碰撞理论分析,实验Ⅰ中 和
和 反应很慢的主要原因是
反应很慢的主要原因是___________
(2)同学乙猜想实验Ⅱ中 起催化作用,其总反应分两步进行:
起催化作用,其总反应分两步进行:
(ⅰ)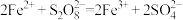 ;(ⅱ)___________。
;(ⅱ)___________。
①补充反应(ⅱ):___________ 。
②请你设计实验证明同学乙的猜想:___________ 。
(3)查阅文献知,氧化性: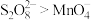 。在稀硫酸酸化的
。在稀硫酸酸化的 溶液中滴加1滴
溶液中滴加1滴 溶液作催化剂,再滴加
溶液作催化剂,再滴加 溶液,实验现象是
溶液,实验现象是___________ ,该反应的离子方程式为___________ 。
实验(二):探究过二硫酸钾的热稳定性。
已知几种气体的熔点、沸点如下表所示:
取适量的 装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D。实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D。实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
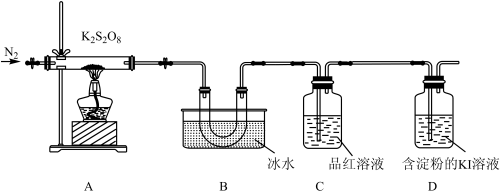
(4)加热之前,先通入一段时间 ,当观察到D中
,当观察到D中___________ (填实验现象)时点燃酒精灯。
(5)B中U形管收集的物质是___________ (填化学式)。
(6)当A中硬质玻璃管中固体完全分解,停止加热,残留的固体产物只有一种。待冷却至室温时取少量残留固体于试管,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。A中 完全分解发生反应的化学方程式为
完全分解发生反应的化学方程式为___________ 。
 )是一种白色结晶性粉末,溶于水、不溶于乙醇,具有强氧化性,加热至100℃时会完全分解。某学习小组拟探究过二硫酸钾的性质。
)是一种白色结晶性粉末,溶于水、不溶于乙醇,具有强氧化性,加热至100℃时会完全分解。某学习小组拟探究过二硫酸钾的性质。实验(一):探究过二硫酸钾的强氧化性。
探究
 溶液与
溶液与 溶液反应,实验操作与现象如下:
溶液反应,实验操作与现象如下:| 实验 | 操作 | 现象 |
| Ⅰ | 在10L含淀粉的 的 的 溶液中滴加 溶液中滴加   溶液 溶液 | 一段时间后,溶液缓慢变蓝 |
| Ⅱ | 在 含淀粉的 含淀粉的 的 的 溶液中先滴几滴 溶液中先滴几滴 的 的 溶液,再滴加 溶液,再滴加   溶液 溶液 | 溶液迅速变蓝 |
 和
和 反应很慢的主要原因是
反应很慢的主要原因是(2)同学乙猜想实验Ⅱ中
 起催化作用,其总反应分两步进行:
起催化作用,其总反应分两步进行:(ⅰ)
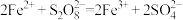 ;(ⅱ)___________。
;(ⅱ)___________。①补充反应(ⅱ):
②请你设计实验证明同学乙的猜想:
(3)查阅文献知,氧化性:
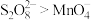 。在稀硫酸酸化的
。在稀硫酸酸化的 溶液中滴加1滴
溶液中滴加1滴 溶液作催化剂,再滴加
溶液作催化剂,再滴加 溶液,实验现象是
溶液,实验现象是实验(二):探究过二硫酸钾的热稳定性。
已知几种气体的熔点、沸点如下表所示:
| 气体 |  |  |  |
| 熔点/℃ | 16.8 | -72.7 | -218.4 |
| 沸点/℃ | 44.8 | -10 | -182.9 |
 装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D。实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D。实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
(4)加热之前,先通入一段时间
 ,当观察到D中
,当观察到D中(5)B中U形管收集的物质是
(6)当A中硬质玻璃管中固体完全分解,停止加热,残留的固体产物只有一种。待冷却至室温时取少量残留固体于试管,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。A中
 完全分解发生反应的化学方程式为
完全分解发生反应的化学方程式为
您最近一年使用:0次
2022-04-13更新
|
533次组卷
|
5卷引用:陕西省榆林市2022届高三第二次联考化学试题
陕西省榆林市2022届高三第二次联考化学试题(已下线)秘籍21 性质探究实验-备战2022年高考化学抢分秘籍(全国通用)甘肃省平凉市2022届高三下学期第二次模拟考试理科综合化学试题甘肃省兰州第一中学2022-2023学年高三上学期期中考试化学试题热点1物质性质探究类实验



