解题方法
1 . 工业上处理含苯酚废水的过程如下。回答下列问题:
Ⅰ.测定废水中苯酚的含量。
测定原理:

测定步骤:
步骤1:准确量取 待测废水于
待测废水于 锥形瓶中。
锥形瓶中。
步骤2:将
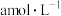 浓溴水(量)迅速加入到锥形瓶中,塞紧瓶塞,振荡。
浓溴水(量)迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中迅速加入

 溶液(过量),塞紧瓶塞,振荡。
溶液(过量),塞紧瓶塞,振荡。
步骤4:滴入2~3滴指示剂,再用
 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 (反应原理:
(反应原理: )。待测废水换为蒸馏水,重复上述步骤(即进行空白实验),消耗
)。待测废水换为蒸馏水,重复上述步骤(即进行空白实验),消耗 溶液
溶液 。
。
(1)“步骤1”量取待测废水所用仪器是________ 。
(2)为了防止溴的挥发,上述步骤中采取的措施包括迅速加入试剂和________ 。
(3)“步骤4”滴定终点的现象为________ 。
(4)该废水中苯酚的含量为________  (用含
(用含 、
、 的代数式表示)。如果空白实验中“步骤2”忘记塞紧瓶塞,则测得的废水中苯酚的含量
的代数式表示)。如果空白实验中“步骤2”忘记塞紧瓶塞,则测得的废水中苯酚的含量________ (填“偏高”“偏低”或“无影响”,下同);如果空白实验中“步骤4”滴定至终点时俯视读数,则测得的废水中苯酚的含量________ 。
Ⅱ.处理废水。采用 基
基 为阳极,不锈钢为阴极,含苯酚的废水为电解液,通过电解,阳极上产生羟基(·
为阳极,不锈钢为阴极,含苯酚的废水为电解液,通过电解,阳极上产生羟基(· ),阴极上产生
),阴极上产生 。通过交排列的阴阳两极的协同作用,在各自区域将苯酚深度氧化为
。通过交排列的阴阳两极的协同作用,在各自区域将苯酚深度氧化为 和
和 。
。
(5)写出阳极的电极反应式:________ 。
(6)写出苯酚在阴极附近被 深度氧化的化学方程式:
深度氧化的化学方程式:________ 。
Ⅰ.测定废水中苯酚的含量。
测定原理:

测定步骤:
步骤1:准确量取
 待测废水于
待测废水于 锥形瓶中。
锥形瓶中。步骤2:将

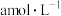 浓溴水(量)迅速加入到锥形瓶中,塞紧瓶塞,振荡。
浓溴水(量)迅速加入到锥形瓶中,塞紧瓶塞,振荡。步骤3:打开瓶塞,向锥形瓶中迅速加入


 溶液(过量),塞紧瓶塞,振荡。
溶液(过量),塞紧瓶塞,振荡。步骤4:滴入2~3滴指示剂,再用

 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 (反应原理:
(反应原理: )。待测废水换为蒸馏水,重复上述步骤(即进行空白实验),消耗
)。待测废水换为蒸馏水,重复上述步骤(即进行空白实验),消耗 溶液
溶液 。
。(1)“步骤1”量取待测废水所用仪器是
(2)为了防止溴的挥发,上述步骤中采取的措施包括迅速加入试剂和
(3)“步骤4”滴定终点的现象为
(4)该废水中苯酚的含量为
 (用含
(用含 、
、 的代数式表示)。如果空白实验中“步骤2”忘记塞紧瓶塞,则测得的废水中苯酚的含量
的代数式表示)。如果空白实验中“步骤2”忘记塞紧瓶塞,则测得的废水中苯酚的含量Ⅱ.处理废水。采用
 基
基 为阳极,不锈钢为阴极,含苯酚的废水为电解液,通过电解,阳极上产生羟基(·
为阳极,不锈钢为阴极,含苯酚的废水为电解液,通过电解,阳极上产生羟基(· ),阴极上产生
),阴极上产生 。通过交排列的阴阳两极的协同作用,在各自区域将苯酚深度氧化为
。通过交排列的阴阳两极的协同作用,在各自区域将苯酚深度氧化为 和
和 。
。(5)写出阳极的电极反应式:
(6)写出苯酚在阴极附近被
 深度氧化的化学方程式:
深度氧化的化学方程式:
您最近一年使用:0次
2020高三·全国·专题练习
解题方法
2 . 水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I−还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(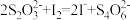 )。
)。
回答下列问题:
(1)“氧的固定”中发生反应的化学方程式为_______________ 。
(2)Na2S2O3溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和____________ ;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除____ 及二氧化碳。
(3)取100.00 mL水样经固氧、酸化后,用a mol·L−1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为_________ ;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为_________ mg·L−1。
(4)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测量结果偏___________ 。(填“高”或“低”)
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I−还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(
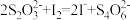 )。
)。回答下列问题:
(1)“氧的固定”中发生反应的化学方程式为
(2)Na2S2O3溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和
(3)取100.00 mL水样经固氧、酸化后,用a mol·L−1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为
(4)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测量结果偏
您最近一年使用:0次
3 . 牛奶和奶粉中添加三聚氰胺,主要是因为它能冒充蛋白质。已知三聚氰胺中含有碳、氢、氮三种元素,其相对分子质量为126,为测定三聚氰胺的组成,用下列各仪器装置,在过量的氧气流中将2.52g三聚氰胺样品氧化成CO2、H2O和N2,装置F中CuO的作用是氧化没有燃烧完全的CO。回答下列问题:
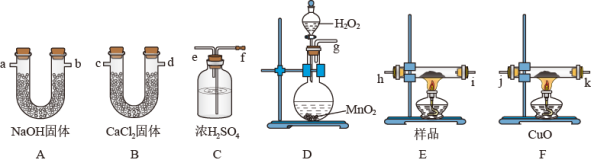
(1)产生的氧气按从左向右流向,所选装置各导管的连接顺序是:g接 、 接 、 接j、k接 、 接 ;___
(2)装置C的作用是___ ;装置D中发生反应的化学方程式是___ ;
(3)实验前后称得A、B两装置的质量分别增加2.64g和1.08g,则三聚氰胺分子中碳、氢、氮的原子个数比为___ ;
(4)目前较多采用以尿素为原料,在0.1MPa下,390℃左右时,以硅胶做催化剂合成三聚氰胺。反应过程中,除生成CO2外,还生成一种使湿润的红色石蕊试纸变蓝的气体,试写出制备三聚氰胺的化学方程式(有机物可用分子式表示)___ ;
(5)按(1)的连接方法,此实验装置存在的缺点是___ ,原因是___ 。

(1)产生的氧气按从左向右流向,所选装置各导管的连接顺序是:g接 、 接 、 接j、k接 、 接 ;
(2)装置C的作用是
(3)实验前后称得A、B两装置的质量分别增加2.64g和1.08g,则三聚氰胺分子中碳、氢、氮的原子个数比为
(4)目前较多采用以尿素为原料,在0.1MPa下,390℃左右时,以硅胶做催化剂合成三聚氰胺。反应过程中,除生成CO2外,还生成一种使湿润的红色石蕊试纸变蓝的气体,试写出制备三聚氰胺的化学方程式(有机物可用分子式表示)
(5)按(1)的连接方法,此实验装置存在的缺点是
您最近一年使用:0次
名校
4 . 废水中过量的氨氮( 和
和 )会导致水体富营养化。某科研小组用
)会导致水体富营养化。某科研小组用 氧化法处理氨氮废水。已知:①
氧化法处理氨氮废水。已知:① 的氧化性比
的氧化性比 强;②
强;② 比
比 更易被氧化;③国家相关标准要求经处理过的氨氮废水
更易被氧化;③国家相关标准要求经处理过的氨氮废水 要控制在6~9。
要控制在6~9。
(1) 时,
时, 可与
可与 反应生成
反应生成 等无污染物质,该反应的离子方程式为
等无污染物质,该反应的离子方程式为___________ 。
(2)进水 对氨氮去除率和出水pH的影响分别如图1和图2所示:
对氨氮去除率和出水pH的影响分别如图1和图2所示:

图1 图2
①进水 在1.25~2.75范围内时,氨氮去除率随
在1.25~2.75范围内时,氨氮去除率随 的升高迅速下降的原因是
的升高迅速下降的原因是__________ 。
②进水 在2.75~6范围内时,氨氮去除率随
在2.75~6范围内时,氨氮去除率随 的升高而上升的原因是
的升高而上升的原因是___________ 。
③进水 应控制在
应控制在____________ 左右为宜。
(3)为研究空气对 氢化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是
氢化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是______ (填序号)
a. 的氧化性比
的氧化性比 弱
弱
b. 氧化氨氮速率比
氧化氨氮速率比 慢
慢
c. 在废水中溶解度比较小
在废水中溶解度比较小
d.空气中的 进入废水中
进入废水中
 和
和 )会导致水体富营养化。某科研小组用
)会导致水体富营养化。某科研小组用 氧化法处理氨氮废水。已知:①
氧化法处理氨氮废水。已知:① 的氧化性比
的氧化性比 强;②
强;② 比
比 更易被氧化;③国家相关标准要求经处理过的氨氮废水
更易被氧化;③国家相关标准要求经处理过的氨氮废水 要控制在6~9。
要控制在6~9。(1)
 时,
时, 可与
可与 反应生成
反应生成 等无污染物质,该反应的离子方程式为
等无污染物质,该反应的离子方程式为(2)进水
 对氨氮去除率和出水pH的影响分别如图1和图2所示:
对氨氮去除率和出水pH的影响分别如图1和图2所示:
图1 图2
①进水
 在1.25~2.75范围内时,氨氮去除率随
在1.25~2.75范围内时,氨氮去除率随 的升高迅速下降的原因是
的升高迅速下降的原因是②进水
 在2.75~6范围内时,氨氮去除率随
在2.75~6范围内时,氨氮去除率随 的升高而上升的原因是
的升高而上升的原因是③进水
 应控制在
应控制在(3)为研究空气对
 氢化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是
氢化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是a.
 的氧化性比
的氧化性比 弱
弱b.
 氧化氨氮速率比
氧化氨氮速率比 慢
慢c.
 在废水中溶解度比较小
在废水中溶解度比较小d.空气中的
 进入废水中
进入废水中
您最近一年使用:0次
2020-03-05更新
|
720次组卷
|
5卷引用:【全国百强校】江苏省海安高级中学2018-2019学年高一6月月考化学试题
名校
5 . 砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图:
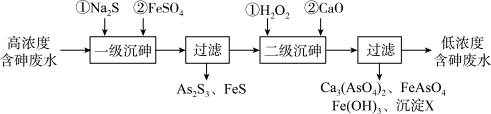
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为____ ;砷酸的第一步电离方程式为______ 。
(2)“一级沉砷”中FeSO4的作用是_____ ;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_______ 。
(3)沉淀X为____ (填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
(4)AsH3的电子式为______ 。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图:

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)
 2AsS33-(aq);
2AsS33-(aq);②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为
(2)“一级沉砷”中FeSO4的作用是
(3)沉淀X为
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
(4)AsH3的电子式为
您最近一年使用:0次
2019-09-27更新
|
339次组卷
|
2卷引用:河北省秦皇岛市六校2020届高三上学期期初检测联考化学试题
6 . “治污水”是“五水共治”工程中一项重要举措。
(1)某污水中的有机污染物为三氯乙烯 (C2HCl3),向此污水中加入一定浓度的酸性重铬酸钾(K2Cr2O7还原产物为Cr3+)溶液可将三氯乙烯除去,氧化产物只有CO2。写出该反应的离子反应方程式_____ 。
(2)化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度。COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量。某学习小组用重铬酸钾法测定某水样的COD。主要的实验装置、仪器及具体操作步骤如下:

操作步骤:
Ⅰ量取20.00mL水样于圆底烧瓶中,并加入数粒碎瓷片;
Ⅱ量取10.00mL重铬酸钾标准溶液中加入到圆底烧瓶中,安装反应装置(如上图所示)。从冷凝管上口加入30.00mL的H2SO4—Ag2SO4溶液,混匀后加热回流2h,充分反应后停止加热;
Ⅲ待反应液冷却后加入指示剂2滴,用硫酸亚铁铵溶液滴定多余重铬酸钾,至溶液由绿色变成红褐色。发生的化学反应方程式为Cr2O72-+14H++6Fe2+=6Fe3++2Cr3++7H2O。
请回答:
①量取10.00mL重铬酸钾标准溶液用到的仪器是_______________ (填仪器a或仪器b)。
②下列有关说法正确的是_________________ (用相应编号填写)。
A. 配制重铬酸钾标准溶液时所有需用到仪器有:天平(含砝码)、玻璃棒、烧杯和容量瓶
B. 滴定前锥形瓶、滴定管均需用蒸馏水洗后再用待取液进行润洗
C. 滴定时用左手控制旋塞,眼睛注视锥形瓶内液体颜色变化,右手摇动锥形瓶,使溶液向同一方向旋转
D. 加热回流结束后,未用蒸馏水冲洗冷凝管管壁,则滴定测得的硫酸亚铁铵体积偏小
③已知:重铬酸钾标准溶液的c(Cr2O72-)=0.02000mol·L-1,硫酸亚铁铵溶液的c(Fe2+)=0.01000mol·L-1,滴定终点时所消耗的硫酸亚铁铵溶液的体积为18.00mL,则按上述实验方法,测得的该水样的化学需氧量COD=_______ mg/L。
(3)工业上常用铁炭(铁屑和活性炭混合物)微电解法处理污水。保持反应时间等条件不变,测得铁碳混合物中铁的体积分数、污水溶液pH对污水COD去除率的影响分别如图1、图2 所示。

①由图1、图2可知下列推论不合理 的是________________ 。
A. 活性炭对污水中的还原性物质具有一定的吸附作用
B. 酸性条件下,铁屑和活性炭会在溶液中形成微电池,铁为负极,溶液中有大量的Fe2+、Fe3+
C. 当铁碳混合物中铁的体积分数大于50%时,COD的去除率随着铁的质量分数增加而下降的主要原因是溶液中微电池数目减少
D. 工业降低污水COD的最佳条件为:铁的体积分数占50%;污水溶液pH约为3
②根据图2分析,COD的脱除率降低的原因可能为_______________________________ 。
(1)某污水中的有机污染物为三氯乙烯 (C2HCl3),向此污水中加入一定浓度的酸性重铬酸钾(K2Cr2O7还原产物为Cr3+)溶液可将三氯乙烯除去,氧化产物只有CO2。写出该反应的离子反应方程式
(2)化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度。COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量。某学习小组用重铬酸钾法测定某水样的COD。主要的实验装置、仪器及具体操作步骤如下:

操作步骤:
Ⅰ量取20.00mL水样于圆底烧瓶中,并加入数粒碎瓷片;
Ⅱ量取10.00mL重铬酸钾标准溶液中加入到圆底烧瓶中,安装反应装置(如上图所示)。从冷凝管上口加入30.00mL的H2SO4—Ag2SO4溶液,混匀后加热回流2h,充分反应后停止加热;
Ⅲ待反应液冷却后加入指示剂2滴,用硫酸亚铁铵溶液滴定多余重铬酸钾,至溶液由绿色变成红褐色。发生的化学反应方程式为Cr2O72-+14H++6Fe2+=6Fe3++2Cr3++7H2O。
请回答:
①量取10.00mL重铬酸钾标准溶液用到的仪器是
②下列有关说法正确的是
A. 配制重铬酸钾标准溶液时所有需用到仪器有:天平(含砝码)、玻璃棒、烧杯和容量瓶
B. 滴定前锥形瓶、滴定管均需用蒸馏水洗后再用待取液进行润洗
C. 滴定时用左手控制旋塞,眼睛注视锥形瓶内液体颜色变化,右手摇动锥形瓶,使溶液向同一方向旋转
D. 加热回流结束后,未用蒸馏水冲洗冷凝管管壁,则滴定测得的硫酸亚铁铵体积偏小
③已知:重铬酸钾标准溶液的c(Cr2O72-)=0.02000mol·L-1,硫酸亚铁铵溶液的c(Fe2+)=0.01000mol·L-1,滴定终点时所消耗的硫酸亚铁铵溶液的体积为18.00mL,则按上述实验方法,测得的该水样的化学需氧量COD=
(3)工业上常用铁炭(铁屑和活性炭混合物)微电解法处理污水。保持反应时间等条件不变,测得铁碳混合物中铁的体积分数、污水溶液pH对污水COD去除率的影响分别如图1、图2 所示。

①由图1、图2可知下列推论
A. 活性炭对污水中的还原性物质具有一定的吸附作用
B. 酸性条件下,铁屑和活性炭会在溶液中形成微电池,铁为负极,溶液中有大量的Fe2+、Fe3+
C. 当铁碳混合物中铁的体积分数大于50%时,COD的去除率随着铁的质量分数增加而下降的主要原因是溶液中微电池数目减少
D. 工业降低污水COD的最佳条件为:铁的体积分数占50%;污水溶液pH约为3
②根据图2分析,COD的脱除率降低的原因可能为
您最近一年使用:0次
解题方法
7 . K2Cr2O7是一种有致癌性的强氧化剂,含Cr2O72—的酸性工业废水必须经过处理才能排放。工业上通常采用Fe电极电解法处理,调节pH值使之以Cr(OH)3沉淀形式除去。某化学兴趣小组在实验室里探究了该处理工艺,具体实验日志如下:

I.原理探查
查阅文献发现,电解时阳极产生Fe2+,在阴极附近(如图),Cr2O72—被Fe2+还原成Cr3+,而Fe3+则在阴极表面还原为Fe2+,如此循环。
(1)用离子方程式表示Cr2O72—与Fe2+的反应:______________________________ 。
II.实验探究
实验一:探究不同电压对Cr2O72-降解效率的影响
各取6份100 mL 1 mol/L 酸性K2Cr2O7溶液,均以Fe为电极,分别用不同电压电解5 min。取电解后溶液10 mL,测定Cr2O72-的含量,所测溶液中Cr2O72-物质的量与电解电压关系如下图所示。(假设电解前后溶液体积不变)
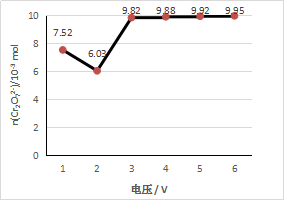
(2)实验结果显示,最佳电解电压应选择_______ V。
(3)电压为6 V时,用Cr2O72-表示5 min内平均反应速率为_________ mol·L—1·min—1。
(4)当电压高于3 V时,阴阳两极在电解过程中不断有气泡产生,且测得体积比约等于2:1。因此,阳极产生气泡的电极反应式为:__________________________________ 。
实验二:探究其他影响Cr2O72-降解效率的因素
以1A电流电解500mL K2Cr2O7稀溶液,通电时间30min,考察影响Cr2O72-降解效率的其他因素。具体方法和数据如下表所示。
(5)以上实验中,Cr2O72-降解效率最高的是实验组_____ (填编号),该实验组阳极电极反应式为:__________________________________ 。
(6)对比②和③,Cr2O72-降解效率③>②的原因是:__________________________ 。
(7)由实验组①和②,可认为Cr2O72-能直接在阴极放电还原,电极反应式为:__________________________________ 。
(8)法拉第提出了电解定律,为电化学的发展作出了巨大贡献。根据法拉第电解定律: Q=It=n(e-)F,[I为电流强度单位为A,t为时间单位为s,n(e-)为通过电路的电子的物质的量,F为法拉第常数(每摩电子电量,F=96500 C·mol-1)],则实验组②中的电流效率 =
=______________ 。(保留三位有效数字;假设电解前后溶液体积不变,且没有副反应发生。)

I.原理探查
查阅文献发现,电解时阳极产生Fe2+,在阴极附近(如图),Cr2O72—被Fe2+还原成Cr3+,而Fe3+则在阴极表面还原为Fe2+,如此循环。
(1)用离子方程式表示Cr2O72—与Fe2+的反应:
II.实验探究
实验一:探究不同电压对Cr2O72-降解效率的影响
各取6份100 mL 1 mol/L 酸性K2Cr2O7溶液,均以Fe为电极,分别用不同电压电解5 min。取电解后溶液10 mL,测定Cr2O72-的含量,所测溶液中Cr2O72-物质的量与电解电压关系如下图所示。(假设电解前后溶液体积不变)

(2)实验结果显示,最佳电解电压应选择
(3)电压为6 V时,用Cr2O72-表示5 min内平均反应速率为
(4)当电压高于3 V时,阴阳两极在电解过程中不断有气泡产生,且测得体积比约等于2:1。因此,阳极产生气泡的电极反应式为:
实验二:探究其他影响Cr2O72-降解效率的因素
以1A电流电解500mL K2Cr2O7稀溶液,通电时间30min,考察影响Cr2O72-降解效率的其他因素。具体方法和数据如下表所示。
| 实验组 | ① | ② | ③ | ④ | |
| 加入硫酸铁 /g | 0 | 0 | 5.0 | 0 | |
| 加入浓硫酸 /mL | 0 | 1.0 | 1.0 | 1.0 | |
| 电极材料 | 阴极 | 石墨 | 石墨 | 石墨 | 石墨 |
| 阳极 | 石墨 | 石墨 | 石墨 | 铁 | |
| Cr2O72-浓度 / mol·L-1 | 初始 | 0.00651 | 0.00651 | 0.00651 | 0.00651 |
| 结束 | 0.00645 | 0.00568 | 0.00516 | 0.00278 | |
(6)对比②和③,Cr2O72-降解效率③>②的原因是:
(7)由实验组①和②,可认为Cr2O72-能直接在阴极放电还原,电极反应式为:
(8)法拉第提出了电解定律,为电化学的发展作出了巨大贡献。根据法拉第电解定律: Q=It=n(e-)F,[I为电流强度单位为A,t为时间单位为s,n(e-)为通过电路的电子的物质的量,F为法拉第常数(每摩电子电量,F=96500 C·mol-1)],则实验组②中的电流效率
 =
=
您最近一年使用:0次
解题方法
8 . 有科学家预青,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。
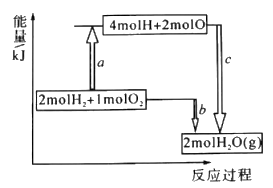
(1)已知破坏1molH-H键、1molO=O键、1molH -O键时分别需要吸收436kJ、498kJ、465kJ的能量,下图表示H2、O2转化为H2O的反应过程中的能量变化,则b=_______ 。
(2)在l0lkPa下,lg氢气完全燃烧生成液态水放出142. 9kJ的热量,该反应的热化学方程式为_______ 。
(3)为探究实验室制氢气反应的热效应,选择下图装置进行实验。

①若x为水,y为生石灰,则实验过程中U形管中可观察到的现象是___________ 。
②若x为稀盐酸,y为锌粒,观察到与①相同的实验现象,则说明锌与稀盐酸制氢气的反应是_________ (填“放热反应”或“吸热反应”)。
(4)已知:
H2SO4 (aq) +2KOH (aq)=K2SO4 (aq)+2H2O(1) △H =Q1kJ/mol
H2SO4(浓)+2NaOH(aq) =Na2SO4 (aq) +2H2O(1) △H =Q2 kJ/mol
HNO3 (aq)+KOH(aq)=KNO3 (aq)+H2O(l) △H =Q3 kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3值的大小关系为________ 。
(1)已知破坏1molH-H键、1molO=O键、1molH -O键时分别需要吸收436kJ、498kJ、465kJ的能量,下图表示H2、O2转化为H2O的反应过程中的能量变化,则b=

(2)在l0lkPa下,lg氢气完全燃烧生成液态水放出142. 9kJ的热量,该反应的热化学方程式为
(3)为探究实验室制氢气反应的热效应,选择下图装置进行实验。

①若x为水,y为生石灰,则实验过程中U形管中可观察到的现象是
②若x为稀盐酸,y为锌粒,观察到与①相同的实验现象,则说明锌与稀盐酸制氢气的反应是
(4)已知:
H2SO4 (aq) +2KOH (aq)=K2SO4 (aq)+2H2O(1) △H =Q1kJ/mol
H2SO4(浓)+2NaOH(aq) =Na2SO4 (aq) +2H2O(1) △H =Q2 kJ/mol
HNO3 (aq)+KOH(aq)=KNO3 (aq)+H2O(l) △H =Q3 kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3值的大小关系为
您最近一年使用:0次
名校
解题方法
9 . 已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为10 mL):
(1)其他条件不变时:探究温度对化学反应速率的影响,应选择_______________ (填实验编号);
(2)探究浓度对化学反应速率的影响,应选择________________ (填实验编号);
(3)若同时选择①②③溶液变浑浊的时间,探究_____________________ 对化学反应速率的影响。
(4)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子。该反应的离子方程式是_____________________________________________________________________________ 。
甲同学设计如下实验流程探究Na2S2O3的化学性质。
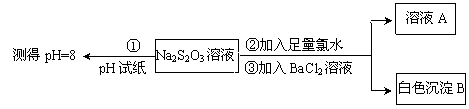
(5)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和_______________ 性。
(6)加入BaCl2溶液生成白色沉淀B的离子方程式是________________________________ 。
(7)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是____________ (填“甲”或“乙”),理由是__________________________________ 。
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol·L-1 | c(H2SO4)/mol·L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
(2)探究浓度对化学反应速率的影响,应选择
(3)若同时选择①②③溶液变浑浊的时间,探究
(4)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子。该反应的离子方程式是
甲同学设计如下实验流程探究Na2S2O3的化学性质。

(5)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和
(6)加入BaCl2溶液生成白色沉淀B的离子方程式是
(7)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是
您最近一年使用:0次
2016-12-09更新
|
354次组卷
|
2卷引用:2016届河北正定中学高三上学期期中考试化学试卷



