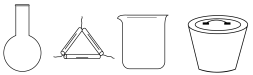
1 . 碘和碘化合物的用途广泛,实验室从海带中提取碘的步骤为:①海带灼烧,②溶解过滤,③在滤液中加入稀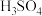 和
和 氧化,④用
氧化,④用 萃取,⑤蒸馏。下列装置在该实验中不能达到目的的是
萃取,⑤蒸馏。下列装置在该实验中不能达到目的的是
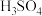 和
和 氧化,④用
氧化,④用 萃取,⑤蒸馏。下列装置在该实验中不能达到目的的是
萃取,⑤蒸馏。下列装置在该实验中不能达到目的的是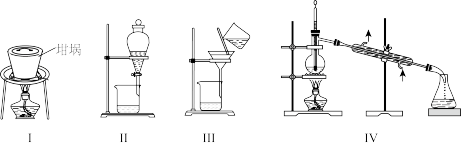
| A.用Ⅰ装置灼烧海带 | B.用Ⅱ装置萃取 | C.用Ⅲ装置过滤 | D.用Ⅳ装置蒸馏 |
您最近一年使用:0次
2022-04-09更新
|
387次组卷
|
4卷引用:选择题6-10
名校
2 . 碘元素是人体中重要的微量元素之一,被称为“智力元素”。实验室从海带中提取碘单质的操作流程如图所示。下列说法正确的是


| A.步骤①的操作名称是研磨 |
| B.步骤③中玻璃棒的作用是搅拌 |
C.步骤④中理论上每生成 ,需消耗 ,需消耗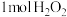 |
D.步骤⑤可以选用 或乙醇 或乙醇 |
您最近一年使用:0次
2023-07-09更新
|
221次组卷
|
2卷引用:广东省肇庆市2022-2023学年高一下学期期末教学质量检测化学试题
3 . 海带中含有碘元素,从海带中提取碘的实验过程如下所示。
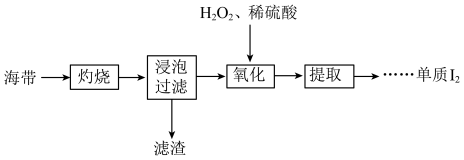
(1)“灼烧”时用到下列仪器中的___________。
(2)“浸泡过滤”后滤液中含有I-,“氧化”的离子方程式为___________ 。
(3)检验“氧化”产生I2的操作:取“氧化”后的少量溶液于试管中,___________ (实验操作及现象)。
(4)“提取”存在以下两种方案。
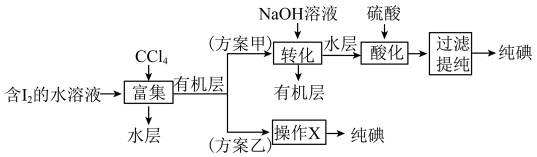
已知: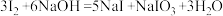 ;酸性条件下,I2在水溶液中的溶解度很小。
;酸性条件下,I2在水溶液中的溶解度很小。
①方案乙中“操作X”的名称是___________ 。
②方案甲中,“酸化”步骤氧化剂与还原剂物质的量之比为___________ 。
③该流程可循环利用的物质是___________ 。
④采用方案乙得到纯碘的产率较低,原因是___________ 。

(1)“灼烧”时用到下列仪器中的___________。
| A.酒精灯 | B.漏斗 | C.蒸发皿 | D.坩埚 |
(3)检验“氧化”产生I2的操作:取“氧化”后的少量溶液于试管中,
(4)“提取”存在以下两种方案。

已知:
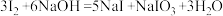 ;酸性条件下,I2在水溶液中的溶解度很小。
;酸性条件下,I2在水溶液中的溶解度很小。①方案乙中“操作X”的名称是
②方案甲中,“酸化”步骤氧化剂与还原剂物质的量之比为
③该流程可循环利用的物质是
④采用方案乙得到纯碘的产率较低,原因是
您最近一年使用:0次
4 . 碘元素是我们身体必不可少的一种微量元素。海带中含有碘元素,从海带中提取碘的实验过程如图所示:

回答下列问题
(1)“灼烧”中用到下列仪器中的_______ (填仪器名称)。
(2) 的电子式为
的电子式为_______ ,“滤液”中发生反应的离子方程式为_______ 。
(3)“萃取”操作需用到分液漏斗,该仪器使用前应进行的操作为_______ , 的
的 溶液应从分液漏斗的
溶液应从分液漏斗的_______ (填“上口”或“下口”)放出。
(4)某小组发现该实验的成功率不高,很容易出现萃取后有机层出现无色或者出现淡粉色的现象。为了提高海带提碘实验的成功率,小组同学对该实验中引起碘元素流失的操作步骤进行了探究。
提出假设 实验中不同浸取温度和不同洗涤液对碘元素流失有影响。
设计方案并完成实验 灼烧海带30min后,用15.00mL蒸馏水浸取,进行实验:
已知: 溶液颜色越深,数值A越大,且
溶液颜色越深,数值A越大,且 。
。
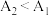 可能的原因为
可能的原因为_______ ,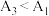 可能的原因为
可能的原因为_______ 。
(5)海带中含有钙元素。写出一种含钙元素物质的化学式及其用途:_______ 。

回答下列问题
(1)“灼烧”中用到下列仪器中的

(2)
 的电子式为
的电子式为(3)“萃取”操作需用到分液漏斗,该仪器使用前应进行的操作为
 的
的 溶液应从分液漏斗的
溶液应从分液漏斗的(4)某小组发现该实验的成功率不高,很容易出现萃取后有机层出现无色或者出现淡粉色的现象。为了提高海带提碘实验的成功率,小组同学对该实验中引起碘元素流失的操作步骤进行了探究。
提出假设 实验中不同浸取温度和不同洗涤液对碘元素流失有影响。
设计方案并完成实验 灼烧海带30min后,用15.00mL蒸馏水浸取,进行实验:
| 序号 | 浸取温度/℃ | 洗涤液 | 稀硫酸溶液滴数 | 氧化剂 |  溶液颜色深浅数值A 溶液颜色深浅数值A |
| 1 | 常温 | 20滴50%的乙醇 | 15滴 | 1.00mL10% |  |
| 2 | 常温 | 20滴蒸馏水 | 15滴 | 1.00mL10% |  |
| 3 | 加热 | 20滴50%的乙醇 | 15滴 | 1.00mL10% | 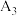 |
 溶液颜色越深,数值A越大,且
溶液颜色越深,数值A越大,且 。
。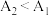 可能的原因为
可能的原因为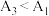 可能的原因为
可能的原因为(5)海带中含有钙元素。写出一种含钙元素物质的化学式及其用途:
您最近一年使用:0次
名校
5 . 海水是巨大的资源宝库,工业上从海水中获取某些重要化工原料的流程如下图示。 、
、 和
和 等。回答下列问题:
等。回答下列问题:
(1)请列举除蒸馏法外海水淡化的一种方法:____________________ 。
(2)试剂1最好选用__________ (填编号)。
a. b.
b.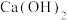 c.
c. d.NaOH
d.NaOH
(3)提取溴单质时,往苦卤中通入氯气和酸,其酸化的目的是____________________ 。
(4)将吹出后的含 的空气按一定速率通入吸收塔,用
的空气按一定速率通入吸收塔,用 和水进行吸收,吸收后的空气进行循环利用。
和水进行吸收,吸收后的空气进行循环利用。
①流程中可用热空气吹出溴的原因为_____________________ 。
②“吸收塔”内发生反应的离子方程式:_____________________ 。
③流程中不是将酸和氯气氧化后的苦卤直接蒸馏,而是经过“空气吹出”、“二氧化硫吸收”、“氢气氧化”再蒸馏得到液溴,目的是_____________________ 。
(5)检验吸收塔里的溶液是否含 的方法是
的方法是_______________________ 。
(6)海带灰中富含以 形式存在的碘元素。实验室提取
形式存在的碘元素。实验室提取 的途径如图所示:
的途径如图所示:__________ (填一种仪器名称)中加热灼烧。
②向酸化的滤液中加入过氧化氢溶液,可将 氧化为
氧化为 ,请写出该反应的离子方程式:
,请写出该反应的离子方程式:__________________ 。

 、
、 和
和 等。回答下列问题:
等。回答下列问题:(1)请列举除蒸馏法外海水淡化的一种方法:
(2)试剂1最好选用
a.
 b.
b.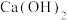 c.
c. d.NaOH
d.NaOH(3)提取溴单质时,往苦卤中通入氯气和酸,其酸化的目的是
(4)将吹出后的含
 的空气按一定速率通入吸收塔,用
的空气按一定速率通入吸收塔,用 和水进行吸收,吸收后的空气进行循环利用。
和水进行吸收,吸收后的空气进行循环利用。①流程中可用热空气吹出溴的原因为
②“吸收塔”内发生反应的离子方程式:
③流程中不是将酸和氯气氧化后的苦卤直接蒸馏,而是经过“空气吹出”、“二氧化硫吸收”、“氢气氧化”再蒸馏得到液溴,目的是
(5)检验吸收塔里的溶液是否含
 的方法是
的方法是(6)海带灰中富含以
 形式存在的碘元素。实验室提取
形式存在的碘元素。实验室提取 的途径如图所示:
的途径如图所示: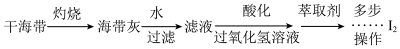
②向酸化的滤液中加入过氧化氢溶液,可将
 氧化为
氧化为 ,请写出该反应的离子方程式:
,请写出该反应的离子方程式:
您最近一年使用:0次
名校
6 . 碘在科研与生活中有重要作用。
Ⅰ.实验室按如下实验流程提取海带中的碘。___________ (从下列图中选择,写出名称)。___________ 。
(3)海带灰中含有的其他可溶性无机盐,是在___________ (从以上流程中选填实验操作名称)中实现与碘分离。
Ⅱ.测定反应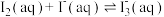 的平衡常数K
的平衡常数K
常温下,取2个碘量瓶分别加入下表中的药品,振荡半小时,均有少量固体不溶。取一定体积的上层清液,加入淀粉作指示剂,用c1 mol L-1 Na2S2O3溶液进行滴定(发生反应
L-1 Na2S2O3溶液进行滴定(发生反应 ),测定
),测定 和
和 的总浓度,进而可以测得K。
的总浓度,进而可以测得K。
(注:在本实验中,认为碘在水中和KI溶液中达到饱和时,它们的碘分子浓度c(I2)相等)
(4)Na2S2O3溶液也可以滴定 的原因是
的原因是___________ (用平衡移动原理回答);滴定终点的实验现象为___________ 。
(5)实验I中,c( )=
)=___________ mol/L(用含c1、c2、c3或c4的式子表示,下同),反应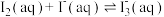 的平衡常数K=
的平衡常数K=___________ 。
(6)若所加的碘偏少,导致实验I中碘量瓶振荡半小时后无固体剩余(不饱和),而实验Ⅱ的碘量瓶中仍有固体不溶,则测得的K将___________ (填“偏大”、“偏小”或“无影响”)。
Ⅰ.实验室按如下实验流程提取海带中的碘。


(3)海带灰中含有的其他可溶性无机盐,是在
Ⅱ.测定反应
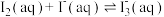 的平衡常数K
的平衡常数K常温下,取2个碘量瓶分别加入下表中的药品,振荡半小时,均有少量固体不溶。取一定体积的上层清液,加入淀粉作指示剂,用c1 mol
 L-1 Na2S2O3溶液进行滴定(发生反应
L-1 Na2S2O3溶液进行滴定(发生反应 ),测定
),测定 和
和 的总浓度,进而可以测得K。
的总浓度,进而可以测得K。(注:在本实验中,认为碘在水中和KI溶液中达到饱和时,它们的碘分子浓度c(I2)相等)
| 碘量瓶 (实验Ⅰ) | 碘量瓶 (实验Ⅱ) | |
| 药品 | 0.5 g研细的碘,100 mL c2 mol L-1 KI L-1 KI | 0.5 g研细的碘,100 mL H2O |
| I2和I3-的总浓度 | c3 mol L-1 L-1 | c4 mol L-1 L-1 |
 的原因是
的原因是(5)实验I中,c(
 )=
)=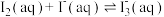 的平衡常数K=
的平衡常数K=(6)若所加的碘偏少,导致实验I中碘量瓶振荡半小时后无固体剩余(不饱和),而实验Ⅱ的碘量瓶中仍有固体不溶,则测得的K将
您最近一年使用:0次
名校
解题方法
7 . 海洋中蕴含着丰富的化学元素,是人类资源的宝库。
I.某学校兴趣小组在实验室按如下实验流程提取海带中的碘。

(1)海带灼烧的目的是___________ 。海带灰中含有的其他可溶性无机盐,是在___________ (从以上流程中选填实验操作名称)中实现与碘分离。上述实验流程中不需要用到的仪器是___________ (从下列图中选择,写出名称)。

(2)“氧化”时加入3mol·L-1H2SO4和3%H2O2溶液,发生反应的离子方程式为___________ 。
(3)加碘食盐中的碘以KIO3形式存在,证明食盐中存在IO ,必须使用的物质是
,必须使用的物质是___________ (填序号)。
①pH试纸 ②蓝色石蕊试纸 ③碘化钾淀粉试纸 ④蒸馏水 ⑤食醋 ⑥醇
Ⅱ.某学校兴趣小组从海水晒盐后的盐卤(含MgCl2、NaCl、KCl、MgSO4等)中模拟工业生产来提取镁,主要过程如图甲:
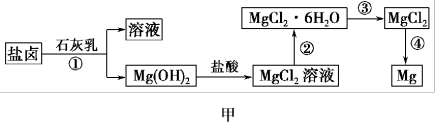
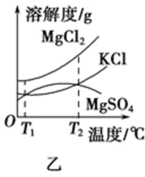
(4)图乙是盐卤中某些物质的溶解度曲线,将盐卤加热到T2℃以上,根据溶解度曲线,首先从盐卤中分离出来的晶体是___________ 。步骤③的具体操作为___________ 。
(5)写出步骤④制备金属镁的化学方程式:___________ 。该过程得到的镁蒸气需要在特定的循环中冷却,可选用___________ (填字母)作冷却剂。
A.Ar B.CO2 C.空气 D.O2 E.水蒸气
I.某学校兴趣小组在实验室按如下实验流程提取海带中的碘。

(1)海带灼烧的目的是

(2)“氧化”时加入3mol·L-1H2SO4和3%H2O2溶液,发生反应的离子方程式为
(3)加碘食盐中的碘以KIO3形式存在,证明食盐中存在IO
 ,必须使用的物质是
,必须使用的物质是①pH试纸 ②蓝色石蕊试纸 ③碘化钾淀粉试纸 ④蒸馏水 ⑤食醋 ⑥醇
Ⅱ.某学校兴趣小组从海水晒盐后的盐卤(含MgCl2、NaCl、KCl、MgSO4等)中模拟工业生产来提取镁,主要过程如图甲:

(4)图乙是盐卤中某些物质的溶解度曲线,将盐卤加热到T2℃以上,根据溶解度曲线,首先从盐卤中分离出来的晶体是

(5)写出步骤④制备金属镁的化学方程式:
A.Ar B.CO2 C.空气 D.O2 E.水蒸气
您最近一年使用:0次



