湖南省邵阳市邵阳县第二中学2020-2021学年高二上学期第二次月考化学(高考班)试题
湖南
高二
阶段练习
2020-10-16
251次
整体难度:
容易
考查范围:
化学反应原理、认识化学科学
湖南省邵阳市邵阳县第二中学2020-2021学年高二上学期第二次月考化学(高考班)试题
湖南
高二
阶段练习
2020-10-16
251次
整体难度:
容易
考查范围:
化学反应原理、认识化学科学
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
1. 参照反应Br+H2 HBr+H的反应历程示意图,下列叙述中正确的是
HBr+H的反应历程示意图,下列叙述中正确的是

 HBr+H的反应历程示意图,下列叙述中正确的是
HBr+H的反应历程示意图,下列叙述中正确的是
| A.该反应的反应热△H=E2﹣E1 |
| B.正反应为吸热反应 |
| C.吸热反应一定要加热后才能发生 |
| D.升高温度可增大正反应速率,降低逆反应速率 |
您最近一年使用:0次
2018-12-17更新
|
188次组卷
|
6卷引用:【全国省级联考】浙江省名校协作体2018-2019学年高二上学期9月联考化学试题
单选题
|
较易(0.85)
名校
2. 合成氨的反应是:N2(g)+3H2(g) 2NH3(g);△H<0。使产率增大的方法是
2NH3(g);△H<0。使产率增大的方法是
 2NH3(g);△H<0。使产率增大的方法是
2NH3(g);△H<0。使产率增大的方法是| A.升高温度 | B.降低压强 | C.使用催化剂 | D.及时分离出NH3 |
您最近一年使用:0次
2016-12-09更新
|
132次组卷
|
4卷引用:2015-2016学年江苏省海安实验中学高二上学期期中选修化学试卷
单选题
|
适中(0.65)
3. 下列关于电离平衡常数(K)的说法中正确的是( )
| A.电离平衡常数(K)与温度无关 |
B.H2CO3的电离常数表达式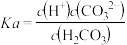 |
| C.同温下,电离平衡常数越小表示弱电解质电离能力越弱 |
| D.多元弱酸各步电离平衡常数相互关系为:K1<K2<K3 |
【知识点】 电离平衡常数及影响因素解读
您最近一年使用:0次
2017-12-20更新
|
338次组卷
|
4卷引用:福建省福州市2016-2017学年高二上学期期中考试化学试题
单选题
|
较易(0.85)
名校
4. 下表中物质的分类组合完全正确的是( )
| 编号 | A | B | C | D |
| 强电解质 | Ba(OH)2 | 盐酸 | HClO4 | BaSO4 |
| 弱电解质 | HI | CaCO3 | HClO | NH3·H2O |
| 非电解质 | SO2 | NH3 | Cl2 | 酒精 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-03-25更新
|
615次组卷
|
12卷引用:2010年福建省福州高级中学高二第二学期期末考试化学试题
(已下线)2010年福建省福州高级中学高二第二学期期末考试化学试题(已下线)2011届江西省南昌一中高三第一次月考化学试题(已下线)2010-2011学年云南省曲靖市茚旺高中高一10月月考化学试卷2014-2015学年浙江省乐成公立寄宿学校高一下学期期末考试化学试卷2015-2016学年河北省邯郸市曲周一中高二下学期期末化学试卷2015-2016学年河北省唐山一中高一下期末化学试卷2017届四川省绵阳市丰谷中学高三上学期第一次月考化学试卷【全国百强校】甘肃省静宁县第一中学2018-2019学年高二(普通班)上学期期末考试化学试题【全国百强校】甘肃省静宁县第一中学2018-2019学年高二(实验班)上学期期末考试化学试题(已下线)2019年9月27日 《每日一题》选修4—— 强电解质与弱电解质的判断湖南省邵阳市邵阳县第二中学2020-2021学年高二上学期第二次月考化学(高考班)试题安徽省砀山县第四中学2021-2022学年高二学期12月月考化学试题
单选题
|
容易(0.94)
解题方法
5. 下列说法正确的是( )
| A.物质燃烧都需要氧气 |
| B.在101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热 |
| C.CO与氧气反应生成CO2的反应一定是吸热反应 |
| D.物质燃烧放出热量的多少与外界条件有关 |
您最近一年使用:0次
单选题
|
较易(0.85)
6. 下列物质溶于水后因电离显酸性的是
| A.NaCl | B.NaHSO4 | C.NH4Cl | D.NaHCO3 |
【知识点】 溶液的酸碱性与pH 盐类水解规律理解及应用解读
您最近一年使用:0次
2019-09-18更新
|
267次组卷
|
2卷引用:浙江省温州市十五校联盟联合体2018-2019学年高二下学期期末考试化学试题
单选题
|
适中(0.65)
名校
7. 对于可逆反应:2SO2(g)+O2(g) 2SO3(g),下列措施能使反应物中活化分子百分数和化学反应速率都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数和化学反应速率都变化的是( )
 2SO3(g),下列措施能使反应物中活化分子百分数和化学反应速率都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数和化学反应速率都变化的是( )| A.增大压强 | B.升高温度 | C.增加SO3浓度 | D.多充入O2 |
【知识点】 影响化学反应速率的外因
您最近一年使用:0次
2019-09-02更新
|
248次组卷
|
4卷引用:黑龙江省大庆铁人中学2019-2020学年高二上学期入学考试化学试题
单选题
|
适中(0.65)
8. 反应4A(g)+5B(g) 4C(g)+6D(g)△H=-QkJ/mol,(Q>0)在一定温度下达到化学平衡状态时,下列说法正确的是( )
4C(g)+6D(g)△H=-QkJ/mol,(Q>0)在一定温度下达到化学平衡状态时,下列说法正确的是( )
 4C(g)+6D(g)△H=-QkJ/mol,(Q>0)在一定温度下达到化学平衡状态时,下列说法正确的是( )
4C(g)+6D(g)△H=-QkJ/mol,(Q>0)在一定温度下达到化学平衡状态时,下列说法正确的是( )| A.若增大压强,A和B的转化率都增大 |
| B.若升高温度最终能生成更多的C和D |
| C.单位时间里有4nmolA消耗,同时有5nmolB生成 |
| D.容器里A、B、C、D的浓度比是4:5:4:6 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
9. 醋酸的下列性质中,可以证明它是弱电解质的是
①1 mol·L-1的CH3COOH溶液中c(H+)=10-2mol·L-1
②CH3COOH以任意比与H2O互溶
③在相同条件下,CH3COOH溶液的导电性比盐酸弱
④10 mL 1 mol·L-1的CH3COOH溶液恰好与10 mL 1 mol·L−1的NaOH溶液完全反应
⑤同浓度同体积的CH3COOH溶液和HCl溶液与Fe反应时,CH3COOH溶液中放出H2的速率慢
⑥CH3COOH溶液中CH3COOH、CH3COO-、H+同时存在
①1 mol·L-1的CH3COOH溶液中c(H+)=10-2mol·L-1
②CH3COOH以任意比与H2O互溶
③在相同条件下,CH3COOH溶液的导电性比盐酸弱
④10 mL 1 mol·L-1的CH3COOH溶液恰好与10 mL 1 mol·L−1的NaOH溶液完全反应
⑤同浓度同体积的CH3COOH溶液和HCl溶液与Fe反应时,CH3COOH溶液中放出H2的速率慢
⑥CH3COOH溶液中CH3COOH、CH3COO-、H+同时存在
| A.①③⑤⑥ | B.②③④⑤ | C.①④⑤⑥ | D.③⑤⑥ |
您最近一年使用:0次
2018-09-27更新
|
996次组卷
|
7卷引用:2018年9月28日《每日一题》人教选修4-强电解质与弱电解质的判断
(已下线)2018年9月28日《每日一题》人教选修4-强电解质与弱电解质的判断吉林省长春市一五O中2018-2019学年高二上学期期中考试化学试题(已下线)2019年9月27日 《每日一题》选修4—— 强电解质与弱电解质的判断甘肃省静宁县第一中学2019-2020学年高二上学期第一次月考化学试题湖南省邵阳市邵阳县第二中学2020-2021学年高二上学期第二次月考化学(高考班)试题(已下线)专题07 电解质溶液——备战2021年高考化学纠错笔记天津市第三中学2022-2023学年高二上学期期中考试化学试题
单选题
|
适中(0.65)
10. 关于常温下pH=11的NaOH溶液和氨水,下列说法正确的是
| A.c(NH4+)+c(NH3·H2O)=c(Na+) |
| B.氨水的导电能力明显强于NaOH溶液 |
| C.向等体积的两溶液中加盐酸溶液至中性,NaOH溶液消耗的盐酸溶液体积多 |
| D.该氨水溶液与等体积,pH=3的盐酸溶液混合后:c(OHˉ)>c(H+) |
您最近一年使用:0次
2019-09-18更新
|
364次组卷
|
2卷引用:浙江省温州市十五校联盟联合体2018-2019学年高二下学期期末考试化学试题
单选题
|
适中(0.65)
11. 反应2SO2+O2 2SO3经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L·s),则这段时间为( )
2SO3经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L·s),则这段时间为( )
 2SO3经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L·s),则这段时间为( )
2SO3经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L·s),则这段时间为( )| A.0.1s | B.2s | C.4s | D.5s |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
12. 反应N2O4(g)⇌NO2(g)△H=+57kJ•mol﹣1,在温度为T时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的为


| A.A、C两点的反应速率:v(A)>v(C) |
| B.A、C两点气体的颜色:A深,C浅 |
| C.B点正逆反应速率:v(正)>v(逆) |
| D.A、C两点气体的平均相对分子质量:A>C |
【知识点】 压强对化学反应速率的影响解读 压强对化学平衡移动的影响解读
您最近一年使用:0次
2016-12-09更新
|
330次组卷
|
8卷引用:2016届湖南省衡阳市高三上学期第一次联考化学试卷
单选题
|
较易(0.85)
名校
解题方法
13. 在300℃时,改变起始反应物中n(H2)对反应N2(g)+3H2(g) 2NH3(g)ΔH(ΔH<0)的影响如图所示。下列说法正确的是( )
2NH3(g)ΔH(ΔH<0)的影响如图所示。下列说法正确的是( )
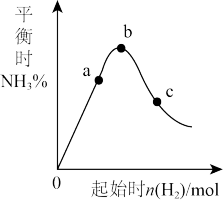
 2NH3(g)ΔH(ΔH<0)的影响如图所示。下列说法正确的是( )
2NH3(g)ΔH(ΔH<0)的影响如图所示。下列说法正确的是( )
| A.反应在b点达到平衡 |
| B.b点H2的转化率最高 |
| C.c点N2的转化率最高 |
| D.a、b、c三点的平衡常数Kb>Ka>Kc |
您最近一年使用:0次
2020-10-14更新
|
483次组卷
|
4卷引用:湖南省邵阳市邵阳县第二中学2020-2021学年高二上学期第二次月考化学(高考班)试题
湖南省邵阳市邵阳县第二中学2020-2021学年高二上学期第二次月考化学(高考班)试题(已下线)第2章 化学反应速率和化学平衡(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)(已下线)2.2.2 化学平衡常数(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)甘肃省张掖市高台县第一中学2023-2024学年高二上学期10月月考化学试题
单选题
|
适中(0.65)
名校
解题方法
14. 在pH均为9的NaOH和CH3COONa两种溶液中,假设由水电离产生的OH- 离子浓度分别为Amol/L与Bmol/L,则A和B关系为:
| A.A>B | B.A=10-4B | C.B=10-4 A | D.A=B |
您最近一年使用:0次
2019-12-11更新
|
1151次组卷
|
44卷引用:2010-2011年福建省福州八中高二下学期期末考试化学试卷
(已下线)2010-2011年福建省福州八中高二下学期期末考试化学试卷(已下线)2011-2012学年吉林省长春外国语学校高二第二次月考化学试卷(已下线)2011-2012年江苏宿迁泗洪县洪翔中学高二下学期期中考试化学试卷(已下线)2012年人教版高中化学选修4 3.3盐类的水解练习卷(已下线)2012-2013学年浙江省桐乡一中高二下学期期中考试化学试卷(已下线)2012-2013学年四川省资阳市高二下学期期末检测化学试卷(已下线)2013-2014学年湖北省荆门市高二上学期期末质量检测化学试卷(已下线)2013-2014学年湖北省荆门市高二上学期期末考试化学试卷(已下线)2014-2015学年吉林省实验中学高二上学期模块一测试化学试卷2014-2015甘肃省兰州一中高二上学期期末化学试卷2014-2015学年云南省昆明三中、滇池中学高二下期中化学试卷2015-2016学年青海师大附属二中高二下4月月考化学试卷2016-2017学年宁夏育才中学高二上月考二化学卷12016-2017学年宁夏育才中学高二上月考二化学卷22016-2017学年安徽省合肥一中等名校高二上期末化学卷2016-2017学年甘肃省嘉峪关市酒钢三中高二上学期期末考试化学试卷河南省濮阳市2016-2017学年高二下学期升级(期末)考试(A卷)化学试题辽宁省庄河市高级中学2017-2018学年高二上学期期中考试化学试题安徽省淮南市第二中学2017-2018学年高二上学期第二次月考化学试题【全国百强校】内蒙古杭锦后旗奋斗中学2018-2019学年高二下学期第一次月考化学试题黑龙江省绥化市安达市第七中学2019-2020学年高二上学期期中考试化学试题(已下线)专题8.2 水的电离和溶液的pH(练)-《2020年高考一轮复习讲练测》吉林省辽源市田家炳高级中学2019-2020学年高二12月月考化学试题广东省汕头市潮阳新世界中英文学校2019-2020学年高二上学期期中考试化学试题广东省揭阳市惠来县第一中学2019-2020学年高二上学期第二次阶段考试化学试题甘肃省张掖市第二中学2019-2020学年高二上学期期中考试化学(理)试题云南省玉溪市华宁县第二中学2019-2020学年高二上学期期末考试化学试题山西省运城市永济涑北中学2019-2020学年高二上学期12月月考化学试题江西省南昌市进贤一中2019-2020学年高二上学期期末考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——水的电离及溶液的酸碱性(已下线)【南昌新东方】2019 南昌一中 高二上 第二次月考吉林省长春市第二十九中学2019-2020学年高二上学期期末考试化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 章末综合检测卷湖南省邵阳市邵阳县第二中学2020-2021学年高二上学期第二次月考化学(高考班)试题吉林乾安县第七中学2020-2021学年高二上学期第二次质量检测化学试题湖南省邵阳市第十一中学2020-2021学年高二上学期期中考试化学试题安徽省泗县第一中学2020-2021学年高二上学期第二次月考化学试题北京市育才学校2020-2021学年高二上学期12月考化学试题吉林省白城市第一中学2020-2021学年高二下学期3月月考化学试题云南省楚雄天人中学2020-2021学年高二上学期12月月考化学试题浙江省宁波市北仑中学2021-2022学年高二上学期期中考试化学(2-10班)试题(已下线)3.3.1 盐类的水解-同步学习必备知识作业(十七) 盐类的水解(已下线)BBWYhjhx1107.pdf
单选题
|
适中(0.65)
名校
15. 在密闭容器中,可逆反应:aA(g)+bB(g)=cC(g)达平衡后测得此时C的浓度为0.6mol/L。若保持温度不变,将容器的容积压缩为原来的一半,当重新达到平衡后,C的浓度为0.8mol/L,下列说法正确的是( )
| A.物质A的转化率增大 | B.平衡向正反应方向移动 |
| C.物质C的质量分数增大 | D.a+b<c |
【知识点】 压强对化学平衡移动的影响解读 勒夏特列原理的应用解读
您最近一年使用:0次
2020-10-14更新
|
104次组卷
|
2卷引用:湖南省邵阳市邵阳县第二中学2020-2021学年高二上学期第二次月考化学(高考班)试题
单选题
|
适中(0.65)
16. 下列实验操作不能 达到实验目的的是( )
| A.用25mL酸式滴定管准确量取20.00mL酸性KMnO4溶液 |
| B.将金属锂、金属钠保存在煤油中以防止其氧化 |
| C.做中和热测定实验时,在大小烧杯之间填满碎泡沫塑料以防止热量散失 |
| D.做酸碱中和滴定实验时,盛装标准液的滴定管应用标准液润洗1-2次 |
您最近一年使用:0次
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
17. 化学反应中不只有物质的变化,还伴随能量的转化。
(1)经测定,20g氢气在氧气中燃烧生成水蒸气,放热2418.0kJ,写出该反应的热化学方程式__ ;已知:3Fe(s)+2O2(g)=Fe3O4(s)ΔH=-1118.4kJ·mol-1,根据以上信息,则3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)的ΔH=___ 。
(2)某学生实验小组用50mL0.50mol·L-1的盐酸与50mL0.50mol·L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定。

①图中装置缺少一种仪器,该仪器名称为___ 。
②烧杯间填满碎纸条的作用是___ 。
③若大烧杯上不盖硬纸板,求得中和热绝对值___ 。(填“偏大”“偏小”或“无影响”)。
④将反应混合液的___ 温度记为反应的终止温度。
⑤下列说法正确的是___ 。
A.小烧杯内残留有水,会使测得的反应热偏小
B.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅
C.烧杯间填满碎纸条的作用是固定小烧杯
D.可用相同浓度和体积的醋酸代替稀盐酸溶液进行实验
(1)经测定,20g氢气在氧气中燃烧生成水蒸气,放热2418.0kJ,写出该反应的热化学方程式
(2)某学生实验小组用50mL0.50mol·L-1的盐酸与50mL0.50mol·L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定。

①图中装置缺少一种仪器,该仪器名称为
②烧杯间填满碎纸条的作用是
③若大烧杯上不盖硬纸板,求得中和热绝对值
④将反应混合液的
⑤下列说法正确的是
A.小烧杯内残留有水,会使测得的反应热偏小
B.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅
C.烧杯间填满碎纸条的作用是固定小烧杯
D.可用相同浓度和体积的醋酸代替稀盐酸溶液进行实验
【知识点】 中和热的测定与误差分析解读 盖斯定律与热化学方程式解读
您最近一年使用:0次
解答题-实验探究题
|
适中(0.65)
18. 食醋的总酸量即一定体积的食醋原液所含醋酸的质量,单位是g·L-1或g/100mL。国家标准规定酿造食醋总酸含量不得低于3.5g/100mL。
(1)用酸碱滴定法测定某食醋样品中的总酸量时,下列说法中正确的是__ 。
a.用NaOH溶液滴定时反应的离子方程式为H++OH-=H2O
b.用NaOH溶液滴定时,可使用甲基橙作指示剂
c.若测得样品的物质的量浓度为0.75mol·L-1,则其总酸量为45g·L-1
(2)某同学仔细观察该食醋样品的标签,发现其中还含有苯甲酸钠(C6H5COONa),他想用理论验证醋酸与苯甲酸钠会不会发生离子互换反应,需查找在一定温度下醋酸与苯甲酸的__ 。
a.pH b.电离度 c.电离常数 d.溶解度
(3)常温下,用0.1000mol·L-1NaOH溶液分别滴定20.00mL0.1000mol·L-1HCl溶液和20.00mL0.1000mol·L-1CH3COOH溶液,得到两条滴定曲线,如图所示。①滴定醋酸溶液的曲线是___ (填“图1”或“图2”);图1滴定曲线中a=__ mL;

②E(反应终点)点pH>8的原因是:___ (用离子方程式表示)。
(4)用标准NaOH溶液滴定稀释后的醋酸溶液,若以酚酞为指示剂,达到反应终点的依据是___ 。
(5)用标准NaOH溶液滴定稀释后的醋酸溶液,若滴定前尖嘴部分有气泡,滴定后气泡消失,则所测的醋酸总酸含量___ (填“偏大”或“偏小”或“无影响”)。
(1)用酸碱滴定法测定某食醋样品中的总酸量时,下列说法中正确的是
a.用NaOH溶液滴定时反应的离子方程式为H++OH-=H2O
b.用NaOH溶液滴定时,可使用甲基橙作指示剂
c.若测得样品的物质的量浓度为0.75mol·L-1,则其总酸量为45g·L-1
(2)某同学仔细观察该食醋样品的标签,发现其中还含有苯甲酸钠(C6H5COONa),他想用理论验证醋酸与苯甲酸钠会不会发生离子互换反应,需查找在一定温度下醋酸与苯甲酸的
a.pH b.电离度 c.电离常数 d.溶解度
(3)常温下,用0.1000mol·L-1NaOH溶液分别滴定20.00mL0.1000mol·L-1HCl溶液和20.00mL0.1000mol·L-1CH3COOH溶液,得到两条滴定曲线,如图所示。①滴定醋酸溶液的曲线是

②E(反应终点)点pH>8的原因是:
(4)用标准NaOH溶液滴定稀释后的醋酸溶液,若以酚酞为指示剂,达到反应终点的依据是
(5)用标准NaOH溶液滴定稀释后的醋酸溶液,若滴定前尖嘴部分有气泡,滴定后气泡消失,则所测的醋酸总酸含量
【知识点】 酸碱中和滴定指示剂选择解读 酸碱中和滴定原理的应用解读
您最近一年使用:0次
解答题-原理综合题
|
较易(0.85)
19. 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K与温度T的关系如下:
CO(g)+H2O(g),其化学平衡常数K与温度T的关系如下:
请回答下列问题:
(1)该反应的化学平衡常数表达式K=___ 。
(2)上述正反应为___ 反应。(填“吸热”或“放热”)
(3)某温度下,平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为___ ℃。
(4)800℃时,固定容积的密闭容器中放入混合物,起始浓度为c(CO2)=0.01mol·L-1,c(H2)=0.05mol·L-1,c(CO)=0.01mol·L-1,c(H2O)=0.03mol·L-1,则反应开始时,H2O的消耗速率比生成速率__ (填“大”“小”或“不能确定”)。
(5)830℃时,在1L的固定容积的密闭容器中放入2molCO2和1molH2,2min后达到平衡,平衡后CO2的转化率为___ ,(结果保留2位有效数字,下同)H2平均反应速率为__ ;若保持其他条件不变,在上述平衡后降温到800℃,则平衡__ 移动(填“正向”或“逆向”或“不”)。
 CO(g)+H2O(g),其化学平衡常数K与温度T的关系如下:
CO(g)+H2O(g),其化学平衡常数K与温度T的关系如下:| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的化学平衡常数表达式K=
(2)上述正反应为
(3)某温度下,平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为
(4)800℃时,固定容积的密闭容器中放入混合物,起始浓度为c(CO2)=0.01mol·L-1,c(H2)=0.05mol·L-1,c(CO)=0.01mol·L-1,c(H2O)=0.03mol·L-1,则反应开始时,H2O的消耗速率比生成速率
(5)830℃时,在1L的固定容积的密闭容器中放入2molCO2和1molH2,2min后达到平衡,平衡后CO2的转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中(0.65)
20. 亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3 H++H2PO
H++H2PO 。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
(1)亚磷酸水溶液中含有的分子有___ 、___ (写化学式)
(2)亚磷酸与少量NaOH溶液反应生成的盐的化学式为___ 。
(3)根据亚磷酸(H3PO3)的性质可推测室温下Na2HPO3稀溶液的pH__ 7(填“>”“<”或“=”)。
(4)某温度下,0.1000mol·L-1的H3PO3溶液中c(H+)=2.5×10-2mol·L-1,除OH-之外其他离子的浓度由大到小的顺序是___ ,该温度下H3PO3电离平衡的平衡常数K1=___ 。(H3PO3第二步电离忽略不计,结果保留两位有效数字)。
 H++H2PO
H++H2PO 。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。(1)亚磷酸水溶液中含有的分子有
(2)亚磷酸与少量NaOH溶液反应生成的盐的化学式为
(3)根据亚磷酸(H3PO3)的性质可推测室温下Na2HPO3稀溶液的pH
(4)某温度下,0.1000mol·L-1的H3PO3溶液中c(H+)=2.5×10-2mol·L-1,除OH-之外其他离子的浓度由大到小的顺序是
【知识点】 弱电解质的电离平衡 电离平衡常数及影响因素解读 盐类水解规律
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:化学反应原理、认识化学科学
试卷题型(共 20题)
题型
数量
单选题
16
解答题
4
试卷难度
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 根据△H=生成物的总能量之和-反应物的总能量之和进行计算 活化能及其对反应速率的影响 | |
| 2 | 0.85 | 浓度对化学平衡移动的影响 温度对化学平衡移动的影响 勒夏特列原理的应用 合成氨条件的选择 | |
| 3 | 0.65 | 电离平衡常数及影响因素 | |
| 4 | 0.85 | 电解质与非电解质 非电解质、电解质物质类别判断 强电解质和弱电解质的判断 强电解质与弱电解质 | |
| 5 | 0.94 | 吸热反应和放热反应 燃烧热概念 根据△H=生成物的总能量之和-反应物的总能量之和进行计算 | |
| 6 | 0.85 | 溶液的酸碱性与pH 盐类水解规律理解及应用 | |
| 7 | 0.65 | 影响化学反应速率的外因 | |
| 8 | 0.65 | 化学平衡状态的判断方法 温度对化学平衡移动的影响 压强对化学平衡移动的影响 | |
| 9 | 0.65 | 强电解质和弱电解质的判断 一元强酸与一元弱酸的比较 弱电解质在水溶液中的电离平衡 | |
| 10 | 0.65 | 一元强酸与一元弱酸的比较 弱电解质在水溶液中的电离平衡 盐溶液中离子浓度大小的比较 | |
| 11 | 0.65 | 化学反应速率计算 | |
| 12 | 0.65 | 压强对化学反应速率的影响 压强对化学平衡移动的影响 | |
| 13 | 0.85 | 化学平衡图像分析 化学平衡常数的影响因素及应用 与转化率变化有关图像的分析 | |
| 14 | 0.65 | 影响水电离的因素 水溶液中水的电离程度及的计算 盐类水解的原理 | |
| 15 | 0.65 | 压强对化学平衡移动的影响 勒夏特列原理的应用 | |
| 16 | 0.65 | 酸碱中和滴定实验基本操作及步骤 酸碱中和滴定实验相关仪器 | |
| 二、解答题 | |||
| 17 | 0.65 | 中和热的测定与误差分析 盖斯定律与热化学方程式 | 实验探究题 |
| 18 | 0.65 | 酸碱中和滴定指示剂选择 酸碱中和滴定原理的应用 | 实验探究题 |
| 19 | 0.85 | 温度对化学平衡移动的影响 化学平衡常数的概念及表达方式 化学平衡常数的影响因素及应用 化学平衡常数的有关计算 | 原理综合题 |
| 20 | 0.65 | 弱电解质的电离平衡 电离平衡常数及影响因素 盐类水解规律 | 原理综合题 |



