云南省丽江市2019-2020学年高二下学期期末教学质量监测理综化学试题
云南
高二
期末
2021-06-18
243次
整体难度:
适中
考查范围:
有机化学基础、化学与STSE、认识化学科学、物质结构与性质、常见无机物及其应用、化学反应原理、化学实验基础
云南省丽江市2019-2020学年高二下学期期末教学质量监测理综化学试题
云南
高二
期末
2021-06-18
243次
整体难度:
适中
考查范围:
有机化学基础、化学与STSE、认识化学科学、物质结构与性质、常见无机物及其应用、化学反应原理、化学实验基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
1. 化学与环境、工农业生产等密切相关,下列说法不正确的是
| A.浸有酸性高锰酸钾溶液的硅藻土可用于水果保鲜 |
| B.二氧化氯泡腾片和酒精均可杀灭新型冠状病毒,二者消毒原理相同 |
| C.废旧电池中含有镍、镉等重金属,不可用填埋法处理 |
| D.淀粉可用于制取葡萄糖、乙醇、乙酸 |
您最近一年使用:0次
2021-06-17更新
|
150次组卷
|
2卷引用:云南省丽江市2019-2020学年高二下学期期末教学质量监测理综化学试题
单选题
|
适中(0.65)
2. 设 NA为阿伏加德罗常数的值,下列说法正确的是
| A.1mol Mg 在空气中完全燃烧生成MgO和Mg3N2 ,转移的电子数为NA |
| B.46g有机物C2H6O的分子结构中含有的C-H键数目一定为5NA |
C.1 L 0.2 mol/L NH4NO3溶液中,  的数目小于0.2NA 的数目小于0.2NA |
| D.Fe与水蒸气反应生成22.4L氢气,转移电子数为2NA |
您最近一年使用:0次
单选题
|
适中(0.65)
3. W、X、Y、Z是原子序数依次增大的短周期主族元素,W的族序数是周期数的2倍,X原子的最外层电子数等于W原子的核外电子总数,X、Y组成的淡黄色固体中既含离子键又含共价键,Z与X同主族。下列说法错误的是
| A.W、X、Z的简单氢化物中,X的沸点最高 |
B.简单离子半径: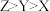 |
| C.Z最高价氧化物对应水化物酸性比W强 |
| D.Y、Z两种元素形成的化合物的水溶液显碱性 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
4. 用下列装置或操作进行实验,能达到实验目的且操作正确的是
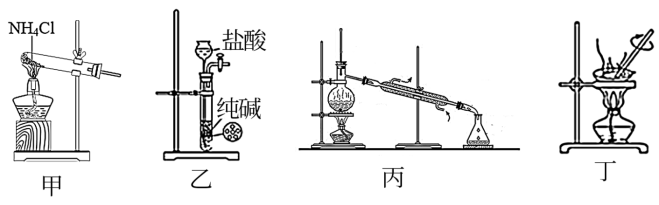

| A.图甲:制取NH3 | B.图乙:制取少量CO2气体 |
| C.图丙:蒸馏 | D.图丁:加热AlCl3溶液制AlCl3 |
【知识点】 氨气的实验室制法解读 盐类水解的应用 化学实验方案的设计与评价
您最近一年使用:0次
单选题
|
适中(0.65)
5. 某有机物X结构简式如下图所示,则下列有关说法中正确的是


A.X的分子式为 |
| B.X在一定条件下能发生氧化、加成、加聚、取代、消去等反应 |
| C. 在Ni作催化剂的条件下,1 mol X最多只能与2 mol H2加成 |
| D.X能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色,褪色原理不相同 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
6. 利用CH4燃料电池电解制备Ca(H2PO4)并得到副产物NaOH、H2、Cl2,装置如图所示。下列说法不正确的是
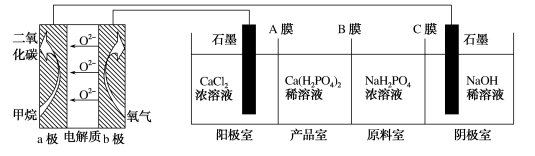

A.a极反应: |
| B.A膜和C膜均为阳离子交换膜 |
| C.可用铁电极替换阴极的石墨电极 |
| D.a极上通入2.24L甲烷,阳极室Ca2+减少0.4mol |
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
7. 下列说法中正确的是
A. NH4HCO3溶液中存在: |
| B.常温下pH=12的NaOH溶液,升高温度,其pH增大 |
C.强酸的水溶液中不存在 |
D.相同pH的氨水和NaOH的溶液中, |
您最近一年使用:0次
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
解题方法
8. CuCl广泛应用于化工和印染等行业。某研究性学习小组模拟热分解CuCl2•2H2O制备CuCl,并进行相关探究。
【资料查阅】
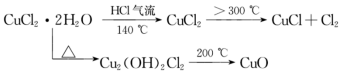
【实验探究】
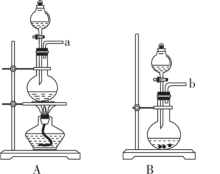
Ⅰ.氯气的制备
实验室用二氧化锰和浓盐酸制氯气选用上述装置___________ (A或B),如何检验装置的气密性___________ ,离子反应方程式___________ 。
Ⅱ.用下图所示装置进行实验(夹持仪器已省略),制备CuCl。

请回答下列问题:
(1)实验操作的先后顺序是a
___________  e (填操作的字母代号)。
e (填操作的字母代号)。
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却 c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热 e.停止通入HCl,然后通入N2
(2)在实验过程中,观察到C中试纸的颜色变化是先变红后褪色。通过C中的现象,一定可以证明新制氯水具有的性质有___________ (填字母代号)。
A.酸性 B.漂白性 C.酸性、漂白性 D.前面性质均无法证明
(3)装置D中发生的氧化还原反应的离子方程式是___________ 。
【探究反思】
(4)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:若杂质是CuCl2,则产生的原因是_____________ 。若杂质是CuO,则产生的原因是_____________ 。
【资料查阅】
【实验探究】

Ⅰ.氯气的制备
实验室用二氧化锰和浓盐酸制氯气选用上述装置
Ⅱ.用下图所示装置进行实验(夹持仪器已省略),制备CuCl。

请回答下列问题:
(1)实验操作的先后顺序是a

 e (填操作的字母代号)。
e (填操作的字母代号)。a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却 c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热 e.停止通入HCl,然后通入N2
(2)在实验过程中,观察到C中试纸的颜色变化是先变红后褪色。通过C中的现象,一定可以证明新制氯水具有的性质有
A.酸性 B.漂白性 C.酸性、漂白性 D.前面性质均无法证明
(3)装置D中发生的氧化还原反应的离子方程式是
【探究反思】
(4)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:若杂质是CuCl2,则产生的原因是
您最近一年使用:0次
解答题-工业流程题
|
较难(0.4)
解题方法
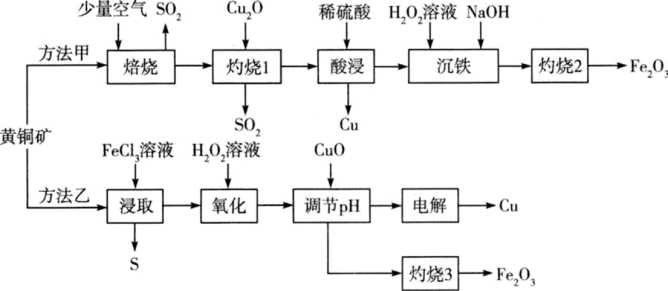
9. 工业上常以黄铜矿(主要成分是CuFeS2)为原料制备铜以及副产物铁红(Fe2O3),其工艺流程如下:
已知“焙烧”时发生反应的化学方程式为

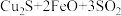 。
。
回答下列问题:
(1)方法甲中为了加快“焙烧”速率,可以采取的措施有___________ (任写两点);“焙烧”时发生的反应中起氧化作用的物质是___________ 。
(2)方法甲中“灼烧1”时Cu2S发生反应的化学方程式为___________ 。
(3)方法甲中“沉铁”时,要使溶液中的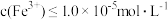 ,则需要调节溶液的pH最小值为
,则需要调节溶液的pH最小值为 ____________ {已知 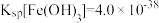 ,
,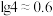 }。
}。
(4)方法乙中“氧化”时加入H2O2溶液发生反应的离子方程式为____________ ;加入CuO调节溶液pH的目的是 ____________ 。
(5)方法甲中得到的粗铜必须电解精炼才能制得纯铜,工艺上一般利用如图装置对粗铜进行电解精炼。
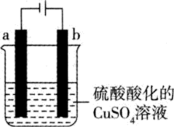
电解精炼时,b极材料是___________ (填“粗铜”或“纯铜”),电池工作时 移向
移向___________ (填“a”或“b”)极区。若电解前两电极质量相等,工作一段时间后测得溶液增重m g(假设阳极只有锌溶解),则电路中转移电子的数目为___________ 。

已知“焙烧”时发生反应的化学方程式为


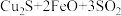 。
。回答下列问题:
(1)方法甲中为了加快“焙烧”速率,可以采取的措施有
(2)方法甲中“灼烧1”时Cu2S发生反应的化学方程式为
(3)方法甲中“沉铁”时,要使溶液中的
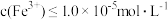 ,则需要调节溶液的pH最小值为
,则需要调节溶液的pH最小值为 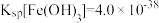 ,
,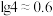 }。
}。(4)方法乙中“氧化”时加入H2O2溶液发生反应的离子方程式为
(5)方法甲中得到的粗铜必须电解精炼才能制得纯铜,工艺上一般利用如图装置对粗铜进行电解精炼。

电解精炼时,b极材料是
 移向
移向
您最近一年使用:0次
解答题-原理综合题
|
较难(0.4)
解题方法
10. 环境是人类赖以生存的基础,当前人类使用的能源石油产品中含有多种硫化物,如H2 S、H2S、COS、CH3SH等,为了保护环境,石油加工的脱硫技术研究意义重大。
请回答下列问题:

(1)科学研究一种复合组分催化剂,能实现CH4把SO2转化为S,同时生成CO2和H2O。已知CH4和S的燃烧热分别为 和
和 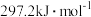 ,则CH4和SO2反应的热化学方程式为
,则CH4和SO2反应的热化学方程式为____________ 。
(2)一定条件下,焦炭可以还原SO2,其化学方程式为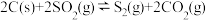 ,在恒容密闭容器中,
,在恒容密闭容器中,  与足量的焦炭反应,SO2的转化率随温度变化曲线如图甲所示。则该反应的
与足量的焦炭反应,SO2的转化率随温度变化曲线如图甲所示。则该反应的
____________ 0(选填“>”或“<”);该反应自发进行的依据是 ____________ 。
(3)真空克劳斯法脱硫,可以用过量K2CO3溶液吸收少量H2S,其化学方程式为____________ ,该反应的平衡常数为 ____________ 。(已知H2CO3的 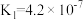 ,
,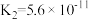 ;H2S的
;H2S的 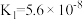 ,
,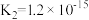 )
)
(4)COS的水解反应为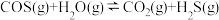
 。某温度时,用活性
。某温度时,用活性 作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比
作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比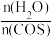 的转化关系如图乙所示。其他条件相同时,改变反应温度,测得一定时间内COS的转化率如图丙所示。
的转化关系如图乙所示。其他条件相同时,改变反应温度,测得一定时间内COS的转化率如图丙所示。
①起始向容器中投入一定量反应物,在一定条件下,可以判断反应到达平衡状态的是___________ (填字母)。
A.容器中气体密度不变时
B.压强保持不变时
C.容器中气体的平均相对分子质量保持不变时
D.
②若减小投料比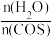 ,H2O的转化率
,H2O的转化率 ___________ (选填“增大”“减小”或“不变”)。
③请你分析该反应进行的温度不宜过高的可能原因是____________ 。
请回答下列问题:

(1)科学研究一种复合组分催化剂,能实现CH4把SO2转化为S,同时生成CO2和H2O。已知CH4和S的燃烧热分别为
 和
和 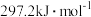 ,则CH4和SO2反应的热化学方程式为
,则CH4和SO2反应的热化学方程式为(2)一定条件下,焦炭可以还原SO2,其化学方程式为
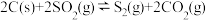 ,在恒容密闭容器中,
,在恒容密闭容器中,  与足量的焦炭反应,SO2的转化率随温度变化曲线如图甲所示。则该反应的
与足量的焦炭反应,SO2的转化率随温度变化曲线如图甲所示。则该反应的
(3)真空克劳斯法脱硫,可以用过量K2CO3溶液吸收少量H2S,其化学方程式为
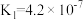 ,
,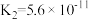 ;H2S的
;H2S的 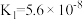 ,
,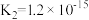 )
)(4)COS的水解反应为
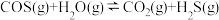
 。某温度时,用活性
。某温度时,用活性 作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比
作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比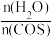 的转化关系如图乙所示。其他条件相同时,改变反应温度,测得一定时间内COS的转化率如图丙所示。
的转化关系如图乙所示。其他条件相同时,改变反应温度,测得一定时间内COS的转化率如图丙所示。①起始向容器中投入一定量反应物,在一定条件下,可以判断反应到达平衡状态的是
A.容器中气体密度不变时
B.压强保持不变时
C.容器中气体的平均相对分子质量保持不变时
D.

②若减小投料比
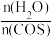 ,H2O的转化率
,H2O的转化率 ③请你分析该反应进行的温度不宜过高的可能原因是
您最近一年使用:0次
解答题-结构与性质
|
适中(0.65)
11. 铬铁合金作为钢的添加料生产多种具有高强度、耐高温、耐腐蚀等优良性能的特种钢,这类特种钢中含有碳、硅、氧、氮、磷、硫等元素。
(1)基态Cr原子的价电子排布式为___________ 。
(2) C、N、O、Si三种元素的第一电离能由大到小的顺序为___________ 。
(3)PO 的空间构型为
的空间构型为___________ ,中心原子的杂化方式为___________ 。
(4)SiO2晶体常伴生于各种矿石中,其晶体结构中,最小的环上有___________ 个原子;Si与C元素位于同一主族,比较SiO2与CO2的键角大小:SiO2___________ CO2(填写“大于”、“小于”或“等于”),原因是___________ 。
(5)无水CrCl3和氨分子作用能形成某种配合物,该配合物的组成相当于CrCl3·6NH3.已知:若加入AgNO3溶液,能从该配合物的水溶液中将所有的氯沉淀为AgCl;若加入NaOH溶液并加热,无刺激性气体产生。请从配合物的形式推算出它的内界和外界,写出该配合物的结构简式___________ ,配位数___________ ,1 mol该配合物中含有σ键的数目为___________ 。
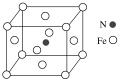
(6)铁和氮形成一种晶体,晶胞结构如图所示,则该晶体的化学式为___________ ,若该晶体的晶胞密度ρg·cm-3,用NA表示阿伏加德罗常数的值,则该晶胞的体积是___________ cm3。
(1)基态Cr原子的价电子排布式为
(2) C、N、O、Si三种元素的第一电离能由大到小的顺序为
(3)PO
 的空间构型为
的空间构型为(4)SiO2晶体常伴生于各种矿石中,其晶体结构中,最小的环上有
(5)无水CrCl3和氨分子作用能形成某种配合物,该配合物的组成相当于CrCl3·6NH3.已知:若加入AgNO3溶液,能从该配合物的水溶液中将所有的氯沉淀为AgCl;若加入NaOH溶液并加热,无刺激性气体产生。请从配合物的形式推算出它的内界和外界,写出该配合物的结构简式
(6)铁和氮形成一种晶体,晶胞结构如图所示,则该晶体的化学式为

您最近一年使用:0次
解答题-有机推断题
|
适中(0.65)
12. 芳香化合物F是有机化工的重要原料,也可制毒,受公安部管制。已知:苯环上有烷烃基时,新引入的取代基连在烷烃基的邻对位上;苯环上有羧基时,新引入的取代基连在羧基的间位上。
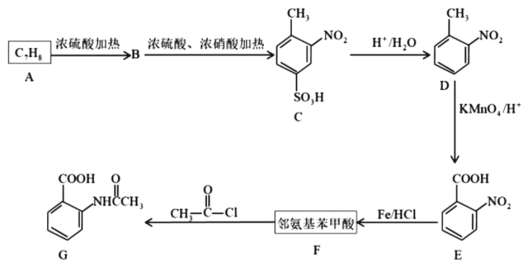
(1)D物质的名称为___________ ,G中官能团的名称为___________ 、___________ 。
(2)A、F的结构简式分别为___________ 、___________ ,E生成F的反应类型是___________ 。
(3)写出产生较多的副产物的结构简式___________ ,该流程未采用甲苯直接硝化的方法制取D,而是经历几步反应才制得D的目的是___________ 。
(4)F在一定条件下能发生聚合反应,请写出其化学反应方程式___________ 。
(5)F的同分异构体中,氨基直接连在苯环上、且能发生银镜反应的芳香族化合物共___________ 种(不含立体结构)。
(6)请以甲苯为原料,写出合成间氨基苯甲酸的流程图___________ (无机试剂任选)。合成流程图表示方法示例:CH2=CH2H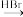 CH3CH2Br
CH3CH2Br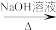 CH3CH2OH
CH3CH2OH

(1)D物质的名称为
(2)A、F的结构简式分别为
(3)写出产生较多的副产物的结构简式
(4)F在一定条件下能发生聚合反应,请写出其化学反应方程式
(5)F的同分异构体中,氨基直接连在苯环上、且能发生银镜反应的芳香族化合物共
(6)请以甲苯为原料,写出合成间氨基苯甲酸的流程图
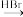 CH3CH2Br
CH3CH2Br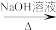 CH3CH2OH
CH3CH2OH
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:有机化学基础、化学与STSE、认识化学科学、物质结构与性质、常见无机物及其应用、化学反应原理、化学实验基础
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 乙烯的用途 蛋白质的变性 化学科学对人类文明发展的意义 金属废弃物的回收及利用 | |
| 2 | 0.65 | 阿伏加德罗常数的应用 结合气体物质与NA相关推算 结合氧化还原反应知识与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 3 | 0.65 | 同周期元素性质递变规律理解及应用 微粒半径大小的比较方法 根据原子结构进行元素种类推断 | |
| 4 | 0.65 | 氨气的实验室制法 盐类水解的应用 化学实验方案的设计与评价 | |
| 5 | 0.65 | 单烯烃的加成反应 烯烃与强氧化性物质的反应 醇的消去反应 多官能团有机物的结构与性质 | |
| 6 | 0.65 | 原电池电极反应式书写 原电池、电解池综合考查 根据电解产物进行相关推断 电解池电极反应式及化学方程式的书写与判断 | |
| 7 | 0.85 | 弱电解质的电离平衡 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 二、解答题 | |||
| 8 | 0.65 | 氯气的实验室制法 氯水的成分及检验 盐类水解的原理 化学实验方案的设计与评价 | 实验探究题 |
| 9 | 0.4 | 溶度积常数相关计算 电解原理的应用 电解池有关计算 常见无机物的制备 | 工业流程题 |
| 10 | 0.4 | 盖斯定律与热化学方程式 化学平衡状态的判断方法 化学平衡的移动 化学平衡常数的有关计算 | 原理综合题 |
| 11 | 0.65 | 物质结构与性质综合考查 电离能变化规律 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 | 结构与性质 |
| 12 | 0.65 | 同分异构体书写 根据题给物质选择合适合成路线 有机推断综合考查 有机化学基础知识综合考查 | 有机推断题 |



