河南省豫南省级示范高中联盟2022届高三下学期考前模拟四理科综合化学试题
河南
高三
模拟预测
2022-07-08
231次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、化学与STSE、认识化学科学、物质结构与性质、化学反应原理、化学实验基础
河南省豫南省级示范高中联盟2022届高三下学期考前模拟四理科综合化学试题
河南
高三
模拟预测
2022-07-08
231次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、化学与STSE、认识化学科学、物质结构与性质、化学反应原理、化学实验基础
一、单选题 添加题型下试题
单选题
|
适中(0.65)
解题方法
1. 化学与人类生产、生活密切相关。下列说法错误的是
| A.疫情期间“网课”是主要学习方式,网络光缆是利用光导纤维传输信号,光导纤维的主要成分是晶体硅 |
| B.驰援武汉首次使用我国自主研发大飞机“运20”,其机身材料采用了大量低密度高强度的铝锂合金 |
| C.2022年北京冬奥会吉祥物“冰墩墩”使用的聚乙烯属于高分子材料 |
| D.白居易的《问刘十九》中“绿蚁新醅酒,红泥小火炉”,优质红泥明亮且橙中略带红光,是因其含有含量较高的氧化铁 |
您最近一年使用:0次
2021-03-26更新
|
602次组卷
|
3卷引用:吉林省吉林市2021届高三下学期第三次调研测试(3月)理科综合化学试题
吉林省吉林市2021届高三下学期第三次调研测试(3月)理科综合化学试题(已下线)【浙江新东方】高中化学20210513-007【2021】【高二下】河南省豫南省级示范高中联盟2022届高三下学期考前模拟四理科综合化学试题
单选题
|
适中(0.65)
名校
2. 硫化钠可用于生产非那西丁等解热药,硫化钠的一种制法Na2SO4+2C Na2S+2CO2↑。设NA为阿伏加德罗常数的值,下列说法正确的是
Na2S+2CO2↑。设NA为阿伏加德罗常数的值,下列说法正确的是
 Na2S+2CO2↑。设NA为阿伏加德罗常数的值,下列说法正确的是
Na2S+2CO2↑。设NA为阿伏加德罗常数的值,下列说法正确的是| A.每生成1molCO2时转移电子数为8NA |
| B.常温常压下,2.24LCO2中含质子的数目为2.2NA |
| C.4.2g14C原子所含的中子数目为2.4NA |
| D.1L1mol/LNa2SO4溶液中含有钠原子的数目为4NA |
您最近一年使用:0次
2021-03-26更新
|
502次组卷
|
4卷引用:吉林省吉林市2021届高三下学期第三次调研测试(3月)理科综合化学试题
单选题
|
适中(0.65)
名校
3. W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法正确的是
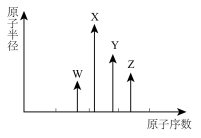

| A.对应简单离子半径:W<X |
| B.对应气态氢化物的稳定性:Y>Z |
| C.化合物XZW既含离子键,又含极性共价键 |
| D.Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应 |
您最近一年使用:0次
2021-03-26更新
|
662次组卷
|
6卷引用:吉林省吉林市2021届高三下学期第三次调研测试(3月)理科综合化学试题
吉林省吉林市2021届高三下学期第三次调研测试(3月)理科综合化学试题(已下线)小题15 元素周期表、律(根据物质性质角度的元素推断)——备战2021年高考化学经典小题考前必刷(全国通用)广西南宁市普通高中联盟2021-2022学年高二上学期期末联考化学试题四川省成都外国语学校2021-2022学年高一下学期3月月考化学试题河南省豫南省级示范高中联盟2022届高三下学期考前模拟四理科综合化学试题四川省泸州市泸县第五中学2022-2023学年高二上学期12月月考试化学试题
单选题
|
较易(0.85)
解题方法
4. 对下列中学化学常见实验装置的判断正确的是


| A.甲装置可用来探究碳酸氢钠受热是否发生分解反应 |
| B.乙装置中一段时间后,铁钉被腐蚀,红墨水向右移动 |
| C.丙装置中溶液a为溴水或Na2S溶液,均可验证SO2具有还原性 |
| D.丁装置在圆底烧瓶中加入苯、铁粉、溴水,用于制备溴苯 |
您最近一年使用:0次
2021-03-26更新
|
407次组卷
|
2卷引用:吉林省吉林市2021届高三下学期第三次调研测试(3月)理科综合化学试题
单选题
|
适中(0.65)
5. 有机物X、Y、Z的结构简式分别为 、
、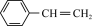 、
、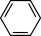 ,下列分析错误的是
,下列分析错误的是
 、
、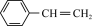 、
、 ,下列分析错误的是
,下列分析错误的是| A.X、Y互为同分异构体 |
| B.Y中最多有4个C原子处于同一直线上 |
| C.X、Z的二氯代物数目相同 |
| D.不能用酸性KMnO4溶液一次区分X、Y、Z三种物质 |
您最近一年使用:0次
2021-03-26更新
|
774次组卷
|
7卷引用:吉林省吉林市2021届高三下学期第三次调研测试(3月)理科综合化学试题
吉林省吉林市2021届高三下学期第三次调研测试(3月)理科综合化学试题(已下线)专题讲座(十一) 同分异构体的书写与数目判断(精练)-2022年高考化学一轮复习讲练测(已下线)考点37 烃-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点37 烃和卤代烃-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)专题15 有机物的结构分析与判断-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)河南省豫南省级示范高中联盟2022届高三下学期考前模拟四理科综合化学试题突破超重点 有机化学基础 超重点7 烃及其衍生物的结构与性质
单选题
|
较易(0.85)
解题方法
6. 我国科研人员研究了在Cu-ZnO-ZrO2催化剂上CO2加氢制甲醇过程中水的作用机理,其主反应历程如图所示(H2→*H+*H)。下列说法错误的是
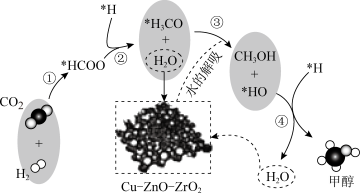

| A.CO2、H2O、CH3OH均是共价化合物 |
| B.第④步的反应式为:*HO+*H→H2O |
| C.CO2加氢制甲醇过程中原子利用率小于100% |
| D.增大催化剂的比表面积可提高反应速率及CO2的转化率 |
【知识点】 催化剂对化学反应速率的影响解读 共价键的形成及主要类型解读
您最近一年使用:0次
2021-03-26更新
|
329次组卷
|
2卷引用:吉林省吉林市2021届高三下学期第三次调研测试(3月)理科综合化学试题
单选题
|
适中(0.65)
7. 25℃时,Ka(CH3COOH)=1.7×10-5,该温度下,用0.1mol/L的醋酸溶液滴定10.00mL0.1mol/L的MOH溶液,滴定过程中加入醋酸溶液的体积(V)与溶液中lg 的关系如图所示,当V=0时,lg
的关系如图所示,当V=0时,lg =-12。下列说法正确的是
=-12。下列说法正确的是
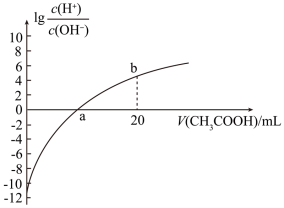
 的关系如图所示,当V=0时,lg
的关系如图所示,当V=0时,lg =-12。下列说法正确的是
=-12。下列说法正确的是
| A.MOH是一元弱碱 |
| B.a点:V(CH3COOH)=10.00mL |
| C.b点:c(CH3COOH)>c(M+)>c(H+)>c(OH-) |
| D.25℃时,CH3COO-的水解平衡常数约为5.9×10-10 |
您最近一年使用:0次
2021-03-26更新
|
361次组卷
|
2卷引用:吉林省吉林市2021届高三下学期第三次调研测试(3月)理科综合化学试题
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
8. 二氯异氰尿酸钠(NaC3N3O3Cl2)是一种高效广谱杀菌消毒剂,它常温下为白色固体,难溶于冷水。其制备原理:2NaClO+C3H3N3O3 NaC3N3O3Cl2+NaOH+H2O。请选择下列部分装置制备二氯异氰尿酸钠并探究其性质。
NaC3N3O3Cl2+NaOH+H2O。请选择下列部分装置制备二氯异氰尿酸钠并探究其性质。
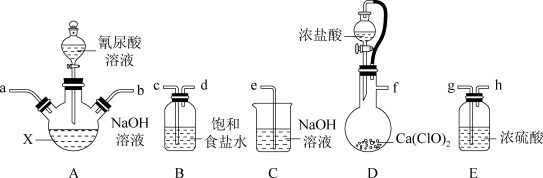
请回答下列问题:
(1)仪器X的名称是___________ 。
(2)装置B的作用是___________ 。
(3)D中发生反应的化学方程式为___________ 。
(4)选择合适装置,按气流从左至右,导管连接顺序为___________ (填字母)。
(5)实验时,先向A中通入氯气,生成高浓度的NaClO溶液后,再加入氰尿酸溶液,并在整个过程中不断通入一定量的氯气,其原因是___________ 。
(6)反应结束后,A中浊液经过滤、___________ 、___________ 得到粗产品mg。
(7)粗产品中NaC3N3O3Cl2含量测定。将mg粗产品溶于无氧蒸馏水中配制成100mL溶液,取20.00mL所配制溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min。用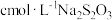 标准溶液进行滴定,加入指示剂,滴定至终点,消耗
标准溶液进行滴定,加入指示剂,滴定至终点,消耗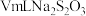 溶液。(假设杂质不与KI反应,涉及的反应为:
溶液。(假设杂质不与KI反应,涉及的反应为: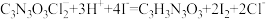 ,
,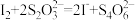 )
)
①滴定终点的现象是___________ 。
②则NaC3N3O3Cl2的百分含量为___________ %。(用含m,c,V的代数式表示)
 NaC3N3O3Cl2+NaOH+H2O。请选择下列部分装置制备二氯异氰尿酸钠并探究其性质。
NaC3N3O3Cl2+NaOH+H2O。请选择下列部分装置制备二氯异氰尿酸钠并探究其性质。
请回答下列问题:
(1)仪器X的名称是
(2)装置B的作用是
(3)D中发生反应的化学方程式为
(4)选择合适装置,按气流从左至右,导管连接顺序为
(5)实验时,先向A中通入氯气,生成高浓度的NaClO溶液后,再加入氰尿酸溶液,并在整个过程中不断通入一定量的氯气,其原因是
(6)反应结束后,A中浊液经过滤、
(7)粗产品中NaC3N3O3Cl2含量测定。将mg粗产品溶于无氧蒸馏水中配制成100mL溶液,取20.00mL所配制溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min。用
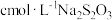 标准溶液进行滴定,加入指示剂,滴定至终点,消耗
标准溶液进行滴定,加入指示剂,滴定至终点,消耗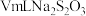 溶液。(假设杂质不与KI反应,涉及的反应为:
溶液。(假设杂质不与KI反应,涉及的反应为: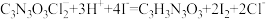 ,
,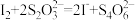 )
)①滴定终点的现象是
②则NaC3N3O3Cl2的百分含量为
您最近一年使用:0次
2022-03-28更新
|
148次组卷
|
3卷引用:江西省宜春市上高二中2021-2022学年高三下学期第八次月考试题(3月)理综化学
9. 镍及其化合物在工业上有广泛应用,红土镍矿是镍资源的主要来源。以某地红土镍矿[主要成分Mg3Si2O5(OH)4、Fe2MgO4、NiO、FeO、Fe2O3]为原料,采用硫酸铵焙烧法选择性提取镍,可减少其他金属杂质浸出,工艺流程如图所示。
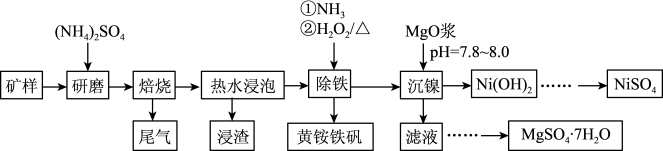
已知:①2[Mg3Si2O5(OH)4]+9(NH4)2SO4 3(NH4)2Mg2(SO4)3+12NH3↑+4SiO2+10H2O↑;
3(NH4)2Mg2(SO4)3+12NH3↑+4SiO2+10H2O↑;
②2Fe2MgO4+15(NH4)2SO4 (NH4)2Mg2(SO4)3+16NH3↑+4(NH4)3Fe(SO4)3+8H2O↑
(NH4)2Mg2(SO4)3+16NH3↑+4(NH4)3Fe(SO4)3+8H2O↑
③加热情况下,Fe3+可水解生成一种难溶于水的黄色固体-FeO(OH)
④常温下,NiSO4易溶于水,NiOOH不溶于水。
(1)“焙烧”前将“矿样”与(NH4)2SO4混合研磨的目的是___________ 。
(2)经分析矿样中大部分铁仍以氧化物形式存在于“浸渣”中,只有部分FeO在空气中焙烧时与(NH4)2SO4反应生成Fe2(SO4)3,该反应的化学方程式为___________ ,“浸渣"的主要成分除铁的氧化物外还有___________ (填化学式)。
(3)焙烧温度对浸出率的影响如图所示,最佳焙烧温度是___________(填序号)左右。
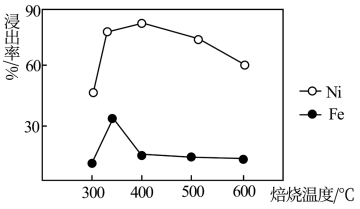
(4)若残留在浸出液中的铁完全转化为黄铵铁矾除去,“除铁”时通入NH3调节溶液pH的范围是___________ 。该工艺条件下,Ni2+生成Ni(OH)2沉淀,Fe3+生成Fe(OH)3或黄铵铁矾沉淀定,开始沉淀和沉淀完全时的pH如下表:
(5)“沉镍"时pH调为8.0,滤液中Ni2+浓度约为___________ mol/L(100.4≈2.5)。
(6)NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式是___________ 。

已知:①2[Mg3Si2O5(OH)4]+9(NH4)2SO4
 3(NH4)2Mg2(SO4)3+12NH3↑+4SiO2+10H2O↑;
3(NH4)2Mg2(SO4)3+12NH3↑+4SiO2+10H2O↑;②2Fe2MgO4+15(NH4)2SO4
 (NH4)2Mg2(SO4)3+16NH3↑+4(NH4)3Fe(SO4)3+8H2O↑
(NH4)2Mg2(SO4)3+16NH3↑+4(NH4)3Fe(SO4)3+8H2O↑③加热情况下,Fe3+可水解生成一种难溶于水的黄色固体-FeO(OH)
④常温下,NiSO4易溶于水,NiOOH不溶于水。
(1)“焙烧”前将“矿样”与(NH4)2SO4混合研磨的目的是
(2)经分析矿样中大部分铁仍以氧化物形式存在于“浸渣”中,只有部分FeO在空气中焙烧时与(NH4)2SO4反应生成Fe2(SO4)3,该反应的化学方程式为
(3)焙烧温度对浸出率的影响如图所示,最佳焙烧温度是___________(填序号)左右。

| A.300℃ | B.350℃ | C.400℃ | D.600℃ |
| 沉淀物 | Ni(OH)2 | Fe(OH)3 | 黄铵铁矾 |
| 开始沉淀时的pH | 7.1 | 2.7 | 1.3 |
| 沉淀完全(c=1×10-5 mol/L)时的pH | 9.2 | 3.7 | 2.3 |
(6)NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式是
您最近一年使用:0次
2022-03-28更新
|
197次组卷
|
2卷引用:江西省宜春市上高二中2021-2022学年高三下学期第八次月考试题(3月)理综化学
解答题-原理综合题
|
适中(0.65)
名校
解题方法
10. CO2资源化是实现“双碳”目标的重要途径。
方法1:化学还原CO2制备CH3CH2OH。
已知:①2H2(g)+O2(g)=2H2O(g) ΔH1=-484.0kJ·mol-1
②C2H5OH(g)完全燃烧的能量变化如图所示。
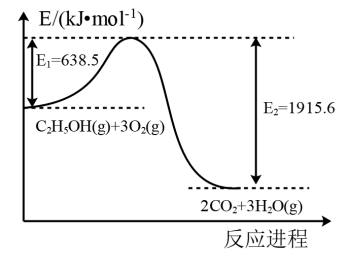
(1)根据上述数据,_______ (填“能”或“不能”)计算C2H5OH(g)的燃烧热。
(2)2CO2(g)+6H2(g)⇌C2H5OH(g)+3H2O(g) ΔH=_______ kJ·mol-1
(3)在恒温恒容条件下,发生反应2CO2(g)+6H2(g)⇌C2H5OH(g)+3H2O(g),下列情况表明反应达到平衡状态的是_______(填标号)。
(4)在容积相同、起始温度相同的甲、乙两个容器中都充入1molCO2(g)、3molH2(g),发生反应2CO2(g)+6H2(g)⇌C2H5OH(g)+3H2O(g),在不同条件下达到平衡,如下表所示:
则K甲_______ (填“>”、“<”或“=”,下同)K乙;t甲_______ t乙。
(5)在一定温度下,向容积为1L的恒容密闭容器中,充入1molCO2(g)、xmolH2(g),发生反应2CO2(g)+6H2(g)⇌C2H5OH(g)+3H2O(g),测得平衡体系中,C2H5OH(g)的体积分数φ与x的关系如图所示。

在m、n、p点中,CO2的转化率最大的是_______ (填字母)点。在该温度下,平衡常数K为_______ 。
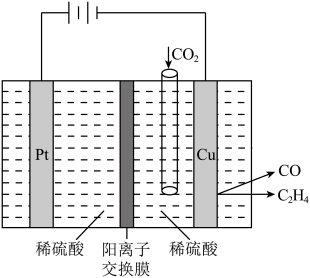
(6)用电解法可将CO2转化为多种原料,原理如图。若铜电极上只产生C2H4和CO气体,写出产生C2H4的电极反应式_______ ;电解后溶液pH_______ (填“变大”、“变小”或“不变”)(忽略溶液体积的变化)。
方法1:化学还原CO2制备CH3CH2OH。
已知:①2H2(g)+O2(g)=2H2O(g) ΔH1=-484.0kJ·mol-1
②C2H5OH(g)完全燃烧的能量变化如图所示。

(1)根据上述数据,
(2)2CO2(g)+6H2(g)⇌C2H5OH(g)+3H2O(g) ΔH=
(3)在恒温恒容条件下,发生反应2CO2(g)+6H2(g)⇌C2H5OH(g)+3H2O(g),下列情况表明反应达到平衡状态的是_______(填标号)。
| A.混合气体密度保持不变 | B.气体总压强保持不变 |
| C.气体平均摩尔质量保持不变 | D.产物浓度之比保持不变 |
| 容器 | 甲 | 乙 |
| 条件 | 恒温、恒容 | 绝热、恒容 |
| 平衡常数K | K甲 | K乙 |
| 达到平衡时所用时间/min | t甲 | t乙 |
(5)在一定温度下,向容积为1L的恒容密闭容器中,充入1molCO2(g)、xmolH2(g),发生反应2CO2(g)+6H2(g)⇌C2H5OH(g)+3H2O(g),测得平衡体系中,C2H5OH(g)的体积分数φ与x的关系如图所示。

在m、n、p点中,CO2的转化率最大的是
(6)用电解法可将CO2转化为多种原料,原理如图。若铜电极上只产生C2H4和CO气体,写出产生C2H4的电极反应式

您最近一年使用:0次
2022-06-25更新
|
268次组卷
|
4卷引用:江西省宜春市上高二中2021-2022学年高三下学期第八次月考试题(3月)理综化学
江西省宜春市上高二中2021-2022学年高三下学期第八次月考试题(3月)理综化学河南省豫南省级示范高中联盟2022届高三下学期考前模拟四理科综合化学试题湖南省娄底市部分学校2022-2023学年高三三模化学试题(已下线)专题15 化学反应原理综合题-2023年高考化学真题题源解密(全国通用)
11. Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Fe原子中,电子填充的能量最高的能级符号为___________ 。
(2)铁的晶体有三种堆积方式,其中两种的堆积方式如下,下列说法正确的是( )
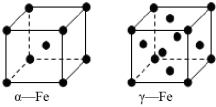
A.空间利用率α-Fe大于γ-Fe
B.α-Fe、γ-Fe晶胞中铁原子个数比为1:2
C.金属铁的导电性是由于通电时自由电子作定向移动
D.α-Fe延展时,可以转变为γ-Fe
(3)在空气中FeO稳定性小于Fe2O3,从电子排布的角度分析,其主要原因是___________ 。
(4)铁氰化钾K3[Fe(CN)6]溶液是检验Fe2+常用的试剂。1 mol [Fe(CN)6]3-含σ键的数目为___________ 。
(5)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是___________ 。配体N 中心原子的杂化类型为
中心原子的杂化类型为___________ 。CoO的熔点是1 935 ℃,CoS的熔点是1 135 ℃,试分析CoO的熔点较高的原因___________ 。
(6)NiO的晶胞结构如图所示,其中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为___________ 。
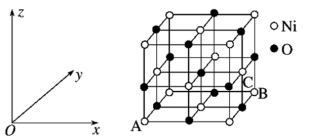
(1)基态Fe原子中,电子填充的能量最高的能级符号为
(2)铁的晶体有三种堆积方式,其中两种的堆积方式如下,下列说法正确的是

A.空间利用率α-Fe大于γ-Fe
B.α-Fe、γ-Fe晶胞中铁原子个数比为1:2
C.金属铁的导电性是由于通电时自由电子作定向移动
D.α-Fe延展时,可以转变为γ-Fe
(3)在空气中FeO稳定性小于Fe2O3,从电子排布的角度分析,其主要原因是
(4)铁氰化钾K3[Fe(CN)6]溶液是检验Fe2+常用的试剂。1 mol [Fe(CN)6]3-含σ键的数目为
(5)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是
 中心原子的杂化类型为
中心原子的杂化类型为(6)NiO的晶胞结构如图所示,其中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为

您最近一年使用:0次
2021-03-04更新
|
222次组卷
|
2卷引用:宁夏银川一中2021届高三下学期返校测试理综化学试题
解答题-有机推断题
|
适中(0.65)
名校
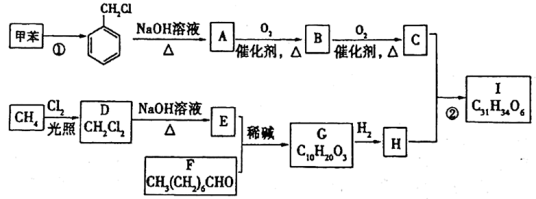
12. 高血脂是一种常见的心血管疾病,治疗高血脂的新药I的合成路线如下:
已知:①RCHO+CH3CHO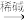
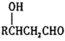
 RCH=CHCHO
RCH=CHCHO
②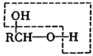
 RCHO
RCHO
回答下列问题:
(1)F中所含官能团的名称是_______ ;C的化学名称为_______ 。
(2)G→H的反应类型是_______ 。
a.取代反应 b.加成反应 c.消去反应 d.还原反应 e.氧化反应
(3)化合物W的相对分子质量比化合物C大14,且满足下列条件:①遇FeCl3溶液显紫色 ②属于芳香族化合物 ③能发生银镜反应 ④核磁共振氢谱显示有5种不同化学环境的氢,峰面积之比为2:2:2:1:1,试写出W的结构简式为_______ 。
(4)用B氧化法生产C,得到的C中往往混有B。
①制备过程中,证明已有C生成的试剂是:_______ 。
②证明生成的C中混有B的方法是:_______ 。
(5)写出由A到B的反应化学方程式_______ 。
(6)设计用甲苯和乙醛为原料制备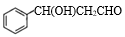 的合成路线,其他无机试剂任选(合成路线常用的表示方式为:A
的合成路线,其他无机试剂任选(合成路线常用的表示方式为:A B……
B…… 目标产物)
目标产物)_______ 。

已知:①RCHO+CH3CHO
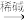
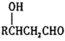
 RCH=CHCHO
RCH=CHCHO②

 RCHO
RCHO回答下列问题:
(1)F中所含官能团的名称是
(2)G→H的反应类型是
a.取代反应 b.加成反应 c.消去反应 d.还原反应 e.氧化反应
(3)化合物W的相对分子质量比化合物C大14,且满足下列条件:①遇FeCl3溶液显紫色 ②属于芳香族化合物 ③能发生银镜反应 ④核磁共振氢谱显示有5种不同化学环境的氢,峰面积之比为2:2:2:1:1,试写出W的结构简式为
(4)用B氧化法生产C,得到的C中往往混有B。
①制备过程中,证明已有C生成的试剂是:
②证明生成的C中混有B的方法是:
(5)写出由A到B的反应化学方程式
(6)设计用甲苯和乙醛为原料制备
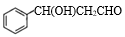 的合成路线,其他无机试剂任选(合成路线常用的表示方式为:A
的合成路线,其他无机试剂任选(合成路线常用的表示方式为:A B……
B…… 目标产物)
目标产物)
您最近一年使用:0次
2020-12-25更新
|
555次组卷
|
4卷引用:江苏省徐州市2020-2021学年高二上学期期中考试化学试题(选修)
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、有机化学基础、化学与STSE、认识化学科学、物质结构与性质、化学反应原理、化学实验基础
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 铝合金及其制品 几种铁的氧化物的物理性质及用途 常用合成高分子材料的化学成分 光导纤维与硅芯片 | |
| 2 | 0.65 | 阿伏加德罗常数的求算 22.4L/mol适用条件 原子中相关数值及其之间的相互关系 电子转移计算 | |
| 3 | 0.65 | 元素周期律、元素周期表的推断 根据原子结构进行元素种类推断 “位构性”关系理解及应用 共价键与离子键的比较 | |
| 4 | 0.85 | 二氧化硫的化学性质 碳酸氢钠的不稳定性 析氢腐蚀 苯的取代反应 | |
| 5 | 0.65 | 同分异构体的数目的确定 苯的化学性质 有机分子中原子共面的判断 | |
| 6 | 0.85 | 催化剂对化学反应速率的影响 共价键的形成及主要类型 | |
| 7 | 0.65 | 盐类水解规律理解及应用 盐溶液中离子浓度大小的比较 盐的水解常数 弱电解质的电离平衡常数 | |
| 二、解答题 | |||
| 8 | 0.65 | 氯气的实验室制法 酸碱中和滴定原理的应用 物质制备的探究 综合实验设计与评价 | 实验探究题 |
| 9 | 0.4 | 氧化还原反应方程式的配平 溶度积常数相关计算 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 10 | 0.65 | 盖斯定律及其有关计算 化学平衡的移动及其影响因素 化学平衡图像分析 电解池电极反应式及化学方程式的书写与判断 | 原理综合题 |
| 11 | 0.65 | 基态核外电子排布规律 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 金属晶体原子堆积模型 | 结构与性质 |
| 12 | 0.65 | 卤代烃的水解反应 醇的催化氧化 逆合成分析法 信息给予的有机合成 | 有机推断题 |



